宫颈癌源外泌体miR-191-5p通过靶向TJP1调控血管内皮细胞层通透性促癌细胞转移的分子机制研究
娄邵升, 欧阳云珊, 曹玲玲, 林 晨
(新疆医科大学1基础医学院病理学教研室, 2研究生学院, 乌鲁木齐 830017)
宫颈癌是女性常见的恶性肿瘤之一。在世界范围内,宫颈癌的防治负担仍很重,在发展中国家,宫颈癌的发病率和死亡率仍远高于世界卫生组织提出的“加速消除宫颈癌全球战略”所设定的临界值[1]。有研究预测,到2030年中国宫颈癌的发病率和死亡率都将上升[2]。因此,阐明宫颈癌进展的分子机制,寻找有效的治疗靶点具有重要意义。外泌体是一类微小的细胞外囊泡,能够通过胞吐作用将所携带的与源细胞相似的核酸、蛋白质、脂质和其他生物活性物质[3]释放到细胞外微环境,导致受体细胞活性或功能发生变化[4]。研究表明,外泌体中丰富的miRNA在恶性肿瘤的形成、进展中发挥关键作用[5]。闭锁小带蛋白(TJP1)是闭合带蛋白家族的成员,与细胞间的紧密连接功能相关[6],参与调节细胞旁通透性[7]。研究表明,癌源性外泌体miRNA可通过靶向TJP1来增加血管通透性,促进癌症转移[8]。前期研究表明,宫颈癌患者和正常女性阴道灌洗液提取的外泌体中的miRNA表达存在差异,其中miR-191-5p差异较显著[9]。通过文献资料发现,miR-191-5p与TJP1存在靶向关系[10]。因此本研究旨在探究miR-191-5p通过靶向TJP1调控血管内皮细胞层通透性促进宫颈癌转移的分子机制,为宫颈癌发生转移提供理论依据,也为寻找潜在的治疗靶基因提供实验基础。
1 材料与方法
1.1 细胞人宫颈癌细胞系SiHa(货号:CL-0210)和HeLa(货号:CL-0101)购自普诺赛生命科技有限公司;人脐静脉内皮细胞系HUVEC(货号:iCell-h110)和人胚肾细胞系(货号:293T)购自赛百慷生物技术股份有限公司。
1.2 试剂与仪器胎牛血清(FBS)(货号:A5669701)、蛋白酶-EDTA溶液(货号:25200114)、高糖培养基(DMEM)(货号:11965118)、罗丹明鬼笔环肽(Rhodanmine phalloidin)(货号:R415)均购自美国Thermo Fisher Scientific公司;内皮细胞培养基(ECM)(赛百慷生物,货号:PriMed-iCell-002);无外泌体FBS(优宁维生物,货号:abs993);外泌体标志蛋白Alix(货号:ab186728)、CD9一抗(货号:ab109201)、TJP1一抗(货号:ab276131)、GAPDH一抗(货号:ab8245)、二抗(货号:ab6702)均购自英国Abcam公司;RNA定量(货号:RR047A、RR820A)、miRNA定量(货号:638315、638316)购自日本TaKaRa公司;伊文思蓝(美国MCE公司,货号:HY-B1102);特超敏ECL化学发光试剂盒(货号:P0018AM)、结晶紫染液(货号:C0121)、Lipo8000TM转染试剂(货号:C0533-1.5 mL)均购自碧云天生物技术有限公司;DAPI荧光染料(货号:ID2250)、牛血清白蛋白(货号:A8020)、20×TBST (货号:T1082)、BCA蛋白浓度测定试剂盒(货号:PC0020)、SDS-PAGE凝胶制备试剂盒(货号:P1200)均购自索莱宝科技有限公司;miRNA提取试剂盒(全式金生物,货号:ER601);PKH67绿色荧光细胞连接试剂盒(德国sigma公司,货号:MINI67-1KT);QuikChange定点突变试剂盒(英国Agilent公司,货号:200515);mimics NC(货号:miR01 102-1-5)、miR-191-5p mimics(货号:miR2C M001)、inhibitor NC(货号:miR02 102-1-5)、miR-191-5p inhibitor(货号:miR1C M001)购自锐博生物有限公司;pCMV-NC(货号:NJ0101343-3-BSND)、pCMV-TJP1质粒(货号:NJ010134-4-BSND)购自擎科生物科技有限公司。常规细胞培养箱(Eppendorf公司,型号:Galaxy 170R);超净工作台(德国Hereaus公司,型号:KS-18);高速台式冷冻离心机(湘仪实验室仪器开发,型号:CHT210R);超速离心机(日本日立公司,型号:CP100NX);透射电镜(美国Phillips公司,型号:CM20);激光共聚焦显微镜(型号:Nikon C2)、倒置显微镜(型号:TI-DH 611624)均购自日本Nikon公司;酶标仪(美国Thermo Fisher Scientific公司,型号:Multiskan GO);垂直电泳仪(美国Bio-Rad公司,型号:1658001);蛋白质印迹仪(美国Bio-Rad公司,型号:Gel Doc XR);细胞电阻仪(美国Millipore公司,型号:Millicell ERS-2); 实时荧光定量 PCR 仪器(美国Thermo Fisher Scientific公司,型号:Applied Biosystems);双荧光素酶报告分析仪(美国Promega公司,型号:GloMax);摇床(北京兰杰柯科技,型号:L-RSK);涡旋混合仪(苏州捷美电子,型号:VM-02U);迷你离心机(群安实验仪器,型号:MC-4K)。
1.3 方法
1.3.1 细胞培养 SiHa、HeLa、293T细胞在含有10%热灭活FBS、1%双抗(链霉素+青霉素)的DMEM中培养。HUVEC在含有10%热灭活FBS、1%双抗的ECM中培养。
1.3.2 外泌体提取 将SiHa/HeLa细胞用上述培养基培养,当细胞生长至70%时,PBS清洗3次,改用含有10%无外泌体FBS的培养基中继续培养24~48 h至细胞完全长满,取上清,常温,500 r/min离心10 min, 去除脱落细胞。取上清, 常温, 2 500 r/min离心15 min,去除细胞碎片。取上清,4℃,11 000 r/min离心35 min,去除凋亡小体。取上清,4℃,100 000 r/min离心95 min。去除上清,得到的沉淀物为含杂质的外泌体。将上述沉淀物,用PBS重悬,4℃,100 000 r/min离心95 min,去除上清,将得到的沉淀用适量的PBS溶液重悬,即为外泌体悬液。随后分装转移至无RNA酶的EP管中,-80℃保存备用。
1.3.3 透射电镜 取15 μL外泌体悬液滴于封口膜表面,夹取聚醋酸甲基乙烯酯-碳(Formvar-carbon)载样铜网(400 目),将铜网膜面朝下放在悬液上轻轻蘸取,吸收20 min。网格用1%戊二醛后固定5 min,PBS漂洗2次,磷钨酸染色5 min,PBS漂洗2次。待网格风干后,使用透射电镜在 80 kV下拍摄显微图像。
1.3.4 蛋白质印迹实验(Western blot) 使用BCA蛋白质测定试剂盒制备蛋白质样品。聚丙烯酰胺(SDS-PAGE)凝胶分离总蛋白(30 μg),随后转移至聚偏二氟乙烯(PVDF)膜上。用1×TBST 洗涤后,用5%牛奶封闭2 h,用1×TBST洗涤后,加入一抗,4℃,孵育10 h。第二天用1×TBST洗涤后,加入辣根过氧化物酶(HRP)标记的二抗,孵育1.5 h,用1×TBST洗涤后,使用增强化学发光试剂检测蛋白质。
1.3.5 外泌体摄取测定 按照操作说明书用PKH67绿色荧光细胞连接试剂盒标记外泌体。100 μL PBS中重悬20 μg外泌体,并添加至1×105个HUVEC中。共培养24 h后,用Rhodanmine Phalloidin对HUVEC中的细胞骨架进行染色,用DAPI荧光染料对HUVEC中细胞核进行染色,在共聚焦显微镜下观察典型的外泌体摄取情况。
1.3.6 跨内皮电阻(TEER)测定 将HUVEC常规消化、计数,取1×105个HUVEC接种于Transwell小室上室,待细胞贴壁,分别在上室加入等体积PBS、40 μg S-exo、40 μg H-exo,并分为PBS组、S-exo组、H-exo组。每24 h使用细胞电阻仪测量一次TEER并记录数值,直至测到TEER达到最大值后一天,最大值当天即认为HUVEC单层细胞形成。
1.3.7 HUVEC转染 配置20 pmol/μL的转染剂。提前将1×105个HUVEC细胞/孔,铺入6孔板中。细胞贴壁后,对6孔板进行常规换液,PBS清洗2次。配置转染工作液:ECM(125 μL)+SiRNA(5 μL)+lipo 8000(5 μL),混匀,室温孵育20 min。取125 μL转染工作液与1 875 μL的5% FBS,ECM培养液混匀,并分为PBS组、mimics NC组、miR-191-5p mimics组、inhibitor NC组、miR-191-5p inhibitor组,将混匀的培养液加入6孔板中,培养48 h。
1.3.8 内皮细胞层通透性测定 将HUVEC常规消化,计数,取1×105个HUVEC接种于Transwell小室上室,待细胞贴壁,加入外泌体后,分为PBS组、S-exo组、H-exo组。转染后,分为PBS组、mimics NC组、miR-191-5p mimics组、inhibitor NC组、miR-191-5p inhibitor组。根据TEER测定结果得出的培养条件,继续培养细胞,待单层细胞屏障形成时,取出Transwell小室,PBS清洗2次,置于新的24孔板中,下室加入600 μL的4%牛血清白蛋白(BSA)溶液,上室加入100 μL的伊文思蓝-血清白蛋白(EB-BSA)(0.67 mg/mL)工作液,并保持上、下室液面的高度一致,于细胞培养箱中平衡1 h。取出Transwell小室,将下室液体置于1.5 mL的EP管中,1 000 r/min离心5 min,取200 μL加入96孔板。另将EB-BSA工作液(初始浓度为0.67 mg/mL)倍比稀释,分别取200 μL加入96孔板,使用多功能酶标仪在620 nm处测量光密度值(OD)并制作标准曲线。根据标准曲线计算Transwell下室液体中EB-BSA浓度,EB-BSA浓度提示单层内皮细胞的通透性。其浓度越大,说明HUVEC细胞层通透性越大。
1.3.9 内皮细胞层穿透实验 将HUVEC常规消化,计数,取1×105个HUVEC接种于Transwell小室上室,转染后,分为Control组、PBS组、mimics NC组、miR-191-5p mimics组、inhibitor NC组、miR-191-5p inhibitor组。其中Control组表示只有HUVEC细胞层,上层不添加宫颈癌细胞,排除HUVEC迁移至下室的干扰。根据TEER测定结果得出的培养条件,继续培养细胞,待单层细胞形成时,加入1×105个宫颈癌细胞,下室更换为低FBS完全培养基,培养24 h后,收获上室,用棉签小心拭去上室细胞,用4%多聚甲醛固定15 min,结晶紫染色液孵育15 min,PBS漂洗,风干后,倒置显微镜下观察,根据三个独立实验计算每个高倍视野的迁移细胞。
1.3.10 实时荧光定量(qRT-PCR)分析 使用试剂盒从细胞和外泌体样本中提取总RNA。U6作为miRNA的内参,GAPDH作为mRNA的内参,引物序列详见表1。RQ=2-ΔΔCt计算目的基因的相对表达量。

表1 序列引物设计
1.3.11 双荧光素酶报告基因实验 将TJP1基因的非翻译区(3′UTR)片段通过PCR扩增并插入载体中。使用定点突变试剂盒生成破坏TJP1的3′UTR区域miR-191-5p结合位点的突变构建体。使用Lipo8000TM将TJP1-wt或TJP1-mut质粒与miR-191-5p mimics或mimics NC共转染至细胞中。将使用TJP1-wt质粒的组作为野生组,使用TJP1-mut质粒的组作为突变组,使用pmirGLO质粒的组作为对照组,mimics NC作为组内对照。转染48 h后,通过双荧光素酶报告分析仪分析荧光素酶活性。
1.3.12 恢复实验 如前所述对HUVEC进行转染,分为mimics NC组、miR-191-5p mimics组、pCMV-NC组、pCMV-TJP1组和pCMV-TJP1+miR-191-5p mimics(pCMV-T+mimics)组,转染48 h后,检测各组TJP1的表达情况。
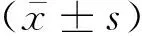
2 结果
2.1 外泌体的鉴定和摄取透射电镜下观察到所提取的微小囊泡呈杯状,有明显双层膜结构,大小在100 nm左右,符合外泌体的典型特征,见图1A。Western blot实验结果显示,外泌体标志蛋白Alix、CD9呈阳性,而肿瘤细胞不表达,见图1B。将提取的外泌体与HUVEC共培养后,HUVEC中存在PKH67标记的外泌体,证实宫颈癌源外泌体可被HUVEC摄取,见图1C。
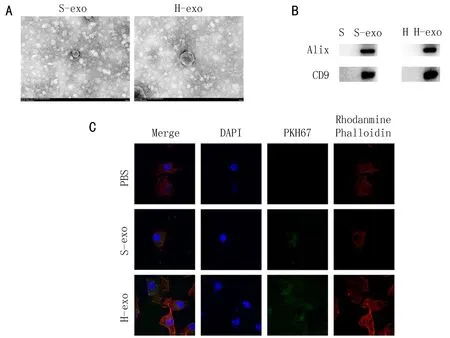
注: A, 外泌体透射电子显微镜下的代表图(比例尺= 100 nm); B, 外泌体Western blot鉴定结果图; C, 外泌体摄取测定结果图,DAPI标记的细胞核呈蓝色荧光,Rhodanmine Phalloidin标记的细胞骨架呈红色荧光,PKH67标记的外泌体呈绿色荧光。S-exo、H-exo代表由SiHa、 HeLa培养上清液提取的外泌体; S、H代表细胞裂解物,用作对照。
2.2 宫颈癌源外泌体对HUVEC细胞层通透性的影响TEER随时间增加而增大,在培养3 d时细胞形成单层,TEER达到最大值,见表2。根据TEER的结果,本研究选用培养3 d的HUVEC细胞进行内皮细胞层通透性实验。结果显示,与PBS组比较,S-exo组和H-exo组的EB-BSA浓度增大,即在宫颈癌源性外泌体的作用下,HUVEC细胞层通透性增大,差异有统计学意义(P<0.000 1),见图2。

注: 与PBS组比较, ****P<0.000 1。

表2 各组平均电阻值比较
2.3 miR-191-5p富集情况及靶向TJP1作用qRT-PCR实验结果显示,miR-191-5p在宫颈癌源外泌体中富集,并被转运至HUVEC细胞中,见图3A。双荧光素酶报告基因实验显示,野生组TJP1可与miR-191-5p结合,而突变组TJP1不能与之结合,miR-191-5p mimics显著降低了野生组TJP1的荧光素酶活性,差异有统计学意义(P<0.01)。但对突变组TJP1荧光素酶活性无影响,见图3B。因此,miR-191-5p靶向TJP1。

注: A, miR-191-5p的qRT-PCR分析结果图; B, 双荧光素酶报告基因实验结果图; **P<0.01, ***P<0.001。
2.4 转染后各组miR-191-5p、TJP1表达情况及HUVEC细胞层通透性结果qRT-PCR和Western blot结果显示,与PBS组比较,miR-191-5p mimics组的miR-191-5p相对表达水平升高,TJP1的相对表达水平下降,而miR-191-5p inhibitor组的miR-191-5p相对表达水平下降,TJP1的相对表达水平升高,差异有统计学意义(P<0.01),见图4A-C。证实了miR-191-5p靶向TJP1使其表达水平降低。内皮细胞层通透性实验结果显示,与PBS组比较,miR-191-5p mimics组通透性增加,而miR-191-5p inhibitor组通透性减弱,差异有统计学意义(P<0.000 1),见图4D。

注:A,miR-191-5p的qRT-PCR分析结果图;B,TJP1的qRT-PCR分析结果图;C,Western blot 结果图,GAPDH作内参;D,HUVEC层通透性结果图;与PBS组比较, **P<0.01, ***P<0.001, ****P<0.000 1。
2.5 各组内皮细胞层穿透实验结果比较内皮细胞层穿透实验结果显示,在SiHa细胞中,与PBS组比较,miR-191-5p mimics组穿透的平均细胞数增加,miR-191-5p inhibitor组穿透的平均细胞数下降,差异有统计学意义(P<0.05)。在HeLa细胞中,与PBS组比较,miR-191-5p mimics组穿透的平均细胞数增加,miR-191-5p inhibitor组穿透的平均细胞数下降,差异有统计学意义(P<0.05),见图5。

注: 与PBS组比较, *P<0.05, **P<0.01, ****P<0.000 1。
2.6 各组恢复实验结果比较恢复实验结果显示,与PBS组比较,mir-191-5p mimics组TJP1的相对表达量下降,差异有统计学意义(P<0.05);与miR-191-5p mimics组比较,pCMV-T+mimics组TJP1的相对表达量增加,差异有统计学意义(P<0.01)。证实过表达TJP1能恢复miR-191-5p对TJP1的靶向抑制作用,见图6。

注: A, TJP1的qRT-PCR分析结果图; B, Western blot结果图, GAPDH为内参; 与PBS组比较, **P<0.01; 与miR-191-5p mimics组比较, *P<0.05, **P<0.01。
3 讨论
近年来,宫颈癌的发病率呈上升趋势[11],严重威胁着女性健康。研究表明,癌源性外泌体miRNA在宫颈癌的进展中起关键作用[12]。本研究提取宫颈癌细胞系培养上清外泌体,经透射电镜和Western blot实验证实形态、标志物,其结果符合既往报道[13]。将外泌体与HUVEC共培养,发现外泌体能被HUVEC摄取,这是外泌体发挥输送miRNA作用的基础。在乳腺癌[14]、结肠癌[15]、卵巢透明细胞癌[16]等肿瘤中的miR-191-5p表达异常,这促进癌症的进展。本研究发现,共培养后的HUVEC中miR-191-5p的表达水平升高,可见宫颈癌源外泌体能将miR-191-5p递送进入HUVEC中。共培养HUVEC细胞层的通透性增加,提示宫颈癌外泌体来源的miR-191-5p可促进HUVEC细胞层通透性增加。瘤内和瘤旁血管在肿瘤发展过程中发挥重要作用。与正常血管网络相比,肿瘤相关的血管网络是异常的[17],而异常的肿瘤血管通透性增加,会促进肿瘤细胞的转移[18]。研究表明,miRNA在血管生成的调节过程中发挥着重要作用[19]。肿瘤细胞可通过外泌体将特定的miRNA转运至HUVEC层中从而减弱血管屏障功能,增加血管通透性,促进肿瘤细胞转移[20]。本研究发现,HUVEC高表达miR-191-5p时,HUVEC细胞层通透性增加,穿透HUVEC细胞层的宫颈癌平均细胞数增加。He等[21]的研究发现,结直肠癌源性外泌体中的miR-21-5p高表达,导致血管通透性增加,这与本研究结果一致。
TJP1是构成紧密连接(TJs)的关键蛋白[22]。当TJP1表达下调时,TJs结构破坏,细胞旁通透性屏障作用减弱,促进癌细胞穿过内皮细胞屏障,发生迁移及侵袭[23]。本研究发现,宫颈癌源miR-191-5p靶向抑制HUVEC中的TJP1,导致HUVEC中的TJs减少,进而导致内皮细胞层通透性增加,癌细胞容易穿过HUVEC细胞层,促进癌细胞迁移。Xie等的[24]研究发现,缺氧鼻咽癌外泌体miR-455通过靶向TJP1增加血管通透性以促进鼻咽癌细胞转移。高度转移性肝癌细胞分泌的miR-638可通过下调血管内皮细胞的TJP1表达,促进血管通透性[25]。上述研究结果均与本研究结果一致。因此,可认为TJP1是研究血管通透性的关键基因。
综上所述,宫颈癌源性外泌体中miR-191-5p富集,miR-191-5p通过靶向调控TJP1导致HUVEC细胞层通透性增加,促进癌细胞转移。过表达TJP1可恢复miR-191-5p靶向抑制TJP1的作用。可认为癌源性外泌体miR-191-5p具有作为临床生物学标志物的潜力,但其能否成为有效的生物标记物需要进一步探究。

