低频重复经颅磁刺激对BTBR T+ Itpr3tf/J小鼠孤独症样行为的影响☆
王心怡 蔡玉龙 李燕娜 袁琳瑛 花艳凡 李芸子 蓝文雅 刘新峰
孤独症谱系障碍(autism spectrum disorder,ASD)的核心症状是社交缺陷及刻板行为[1],其发病机制尚不清楚,通常认为与遗传和环境因素有关[2],且临床尚无针对核心症状的治疗方法[3]。近年来,重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)成为神经精神疾病的研究热点[4-6],rTMS 对抑郁症和强迫症有很好的疗效,但在ASD 中的应用尚未取得确切证据。由于ASD 的发病机制不明、症状的异质性较大[7]及磁刺激方案复杂多样,目前开展的rTMS 治疗ASD 临床研究虽观察到一些行为和电生理结果的改善[8],但尚未得出安全性及有效性的一致结论[9-10],而相关基础研究较少且尚未阐明磁刺激对ASD 疗效的具体机制[11-12]。因此本研究结合临床研究选取的刺激方案,着眼于ASD 的核心症状,用低频rTMS 治疗BTBRT+Itpr3tf/J(BTBR)ASD 模型鼠,试图探究其治疗效果及作用机制。
1 对象与方法
1.1 实验动物 所有实验经金陵医院动物护理委员会批准。本研究选用的雄性BTBR小鼠和雄性B6小鼠购自南京大学模式动物研究所。BTBR小鼠随机分配至孤独症模型+1 Hz rTMS治疗组(BTBR+1 Hz组)和BTBR 组,B6 小鼠随机分配至B6+1 Hz 组和对照组(B6 组),每组7 只。动物在受控环境条件下饲养,12 h光/暗的循环,提供足量的食物和水。
1.2 低频重复经颅磁刺激 使用丹麦MagVenture公司的MagPro X100 刺激器及配套120 mm圆形线圈。静息运动阈值(resting motor threshold, RMT)为在10个刺激中至少5个刺激可以诱发目标肌肉超过50 μV运动诱发电位的最小刺激强度。BTBR+1 Hz 组和B6+1 Hz组刺激强度采用90% RMT,频率为1 Hz。每天15个序列,每个序列包含30个刺激,序列间隔20 s,共450个刺激。BTBR组和B6组进行假刺激。磁刺激治疗在小鼠6 周大时开始,每天1 次,连续5 d,休息2 d,再治疗5 d,总计在12 d内刺激10 d。用50 mL离心管制作约束装置固定小鼠[13]。治疗前1天将小鼠放入约束装置3次,每次5 min。假刺激组的治疗与刺激组同时进行,使用同样大小但未插电的线圈,以保证和刺激组相比接受了除磁刺激以外相同的刺激。
1.3 行为学测试 治疗结束后次日开始行为学实验,各项行为学实验间隔3 d,以防止前一个实验的影响。测试当天至少提前1 h让小鼠适应环境。每只小鼠测试结束,用75%乙醇清洗装置并等待至少5 min使气味消散。
1.3.1 三箱社交实验 采用三箱社交实验评估小鼠社交能力[14]。实验箱采用具有3个等大腔室的装置(60 cm × 40 cm × 22 cm),相邻腔室间有允许小鼠通过的小门。实验包括3个阶段,每阶段10 min:习惯化阶段,将小鼠放入中间腔室,允许其自由探索3个腔室;社交偏好测试,将1 只陌生小鼠(同品系,同性别,同年龄)放在侧室中,另一侧室内放置新物体,允许其再次探索;社交新奇偏好测试,将新物体替换成另1 只陌生小鼠,让其再次探索。使用ANYmaze 7.08计算小鼠在每个侧室中花费的时间。小鼠处在陌生小鼠侧室的时间比新物体或熟悉小鼠的侧室时间长,表明小鼠具有正常的社交偏好。
1.3.2 理毛实验、埋珠实验 采用理毛及埋珠实验评估小鼠刻板行为[14]。理毛实验是将受试小鼠放入干净无垫料的透明笼子中,摄像机放置在离笼子至少15 cm 处录像20 min,统计后10 min 的理毛时间。理毛时间的长短反映刻板行为的多少。埋珠实验是在笼子中放置5 cm 厚的碎玉米芯垫料,将20 个大理石珠按照5×4 的排列方式均匀放置在垫料上。将受试小鼠轻放笼中。30 min 后,计算覆盖超过50%的大理石珠的数量。埋珠数量越多,表明小鼠刻板行为越多。
1.3.3 旷场实验 旷场实验评估小鼠运动能力及焦虑水平[14]。将小鼠置于灰色亚克力装置(50 cm×50 cm×40 cm)中心,允许小鼠自由活动5 min。使用ANYmaze 7.08评估运动总距离、进入中央区的次数和在中央区花费的时间。运动总距离的多少反映小鼠运动能力的好坏。小鼠进入中央区的次数和在中央区花费的时间减少提示存在焦虑。
1.3.4 悬尾实验、强迫游泳实验 采用悬尾及强迫游泳实验评估小鼠抑郁水平。悬尾实验固定小鼠尾部后三分之一处使小鼠悬挂,鼻尖距桌面约15 cm,如果攀爬尾巴,则该小鼠剔除。强迫游泳实验将小鼠放在装有20 cm深温水的圆桶(高25 cm,直径10 cm)中。记录小鼠6 min的活动,统计后4 min内的不动时间。小鼠的不动时间较长提示存在抑郁。
1.4 炎症因子检测 使用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测皮质及海马中白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、白介素-18(interleukin-18,IL-18)、白介素-23(interleukin-23,IL-23)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)水平。麻醉小鼠后灌注0.9%生理盐水,取脑分离皮质及海马。组织匀浆取上清液,使用武汉华美生物工程有限公司(IL-1β:CSB-E08054m,IL-18:CSB-E04609m,IL-23:CSB-E08463m,TNF-α:CSB-E04741m,IFN-γ:CSB-E04578m)和abcam(IL-6:ab100713)试剂盒,加入生物素标记的抗体工作液,37 ℃温育1 h,洗板,加辣根过氧化物酶标记亲和素工作液,37 ℃温育1 h,洗板,加底物37 ℃避光显色,加终止液,用酶标仪测定450 nm处OD值。
1.5 统计学方法 使用Graphpad Prism 9.3.1 进行统计分析。所有数据以±s描述。三箱社交实验采用配对t检验[15]对两侧室时间进行组内比较。其余实验结果采用双因素(模型因素和rTMS 治疗因素)方差分析法进行组间比较[16],并使用Tukey 法进行事后检验。检验水准α=0.05,双侧检验。
2 结果
2.1 三箱社交实验 习惯化阶段,各组小鼠在两个侧室的时间无统计学差异(P>0.05)。社交偏好测试中,BTBR+1 Hz组(t=3.167,P=0.019)、B6+1 Hz组(t=3.247,P=0.018)和B6 组(t=2.800,P=0.031)处在陌生小鼠侧室时间较新物体侧室时间更长且差异有统计学意义,BTBR 组处在两侧室时间差异无统计学意义(t=0.645,P=0.543)。社交新奇偏好测试中,BTBR+1 Hz 组(t=3.521,P=0.013)、B6+1 Hz 组(t=2.550,P=0.044)和B6组(t=3.230,P=0.018)偏好陌生小鼠侧室,BTBR 组(t=0.678,P=0.523)对陌生小鼠侧室无偏好。见图1、表1。

Tab.1 Time in each chamber during the three-chambered social approach task表1 三箱社交实验小鼠处在各腔室时间

Fig.1 Representative heat map of the three-chambered social approach task图1 三箱社交实验代表性热图 A.社交偏好测试;B.社交新奇偏好测试。颜色越红表明停留时间越长。
2.2 理毛、埋珠、旷场、悬尾、强迫游泳实验 理毛实验中,模型因素(F=9.865,P=0.004)、治疗因素(F=8.623,P=0.007)和交互作用(F=10.040,P=0.004)均有统计学意义;BTBR 组小鼠较B6组小鼠理毛时间延长(P<0.001),BTBR+1 Hz 组小鼠理毛时间较BTBR组小鼠减少(P=0.001)。见表2。
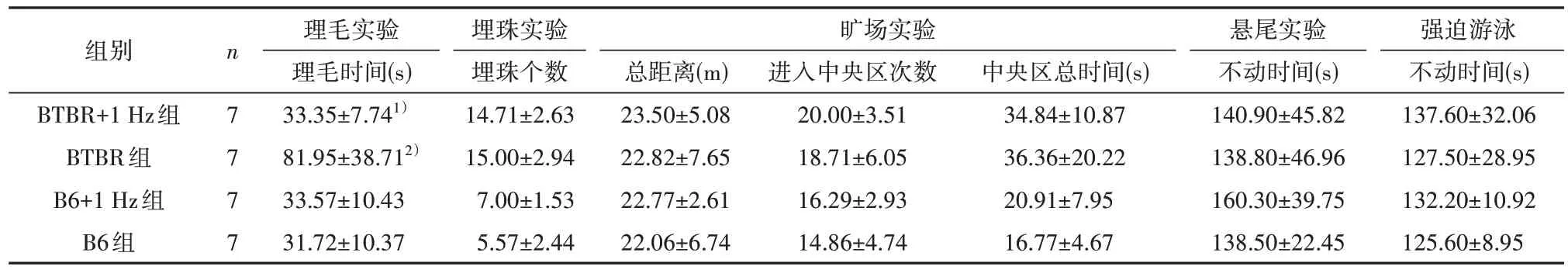
Tab.2 Results of self-grooming, marble burying, open field, tail suspension, and forced swimming tests表2 理毛、埋珠、旷场、悬尾、强迫游泳实验结果
埋珠实验中,埋珠个数模型因素(F=86.230,P<0.001)有统计学意义,而治疗因素(F=0.383,P=0.542)和交互作用(F=0.862,P=0.362)无统计学意义。见表2。
旷场实验中,运动总距离的模型因素(F=0.113,P=0.739)、治疗因素(F=0.098,P=0.757)和交互作用(F<0.001,P=0.995)均无统计学意义。小鼠进入中央区次数的模型因素(F=5.019,P=0.035)有统计学意义,治疗因素(F=0.645,P=0.430)和交互作用(F=0.002,P=0.967)无统计学意义。中央区总时间的模型因素(F=12.850,P=0.002)有统计学意义,治疗因素(F=0.079,P=0.781)和交互作用(F=0.366,P=0.551)无统计学意义。见表2。
悬尾实验中,不动时间的模型因素(F=0.401,P=0.533)、治疗因素(F=0.625,P=0.437)和交互作用(F=0.425,P=0.521)均无统计学意义。强迫游泳实验中,不动时间的模型因素(F=0.182,P=0.674)、治疗因素(F=0.950,P=0.340)和交互作用(F=0.042,P=0.840)均无统计学意义。见表2。
2.3 皮质及海马的炎症因子 小鼠皮质中,IL-1β的模型因素(F=10.400,P=0.004)、治疗因素(F=34.380,P<0.001)和交互作用(F=8.459,P=0.008)均有统计学意义。IL-6 的模型因素(F=1.680,P=0.207)、治疗因素(F=1.263,P=0.272)和交互作用(F=1.072,P=0.311)均无统计学意义。IL-18 的模型因素(F=11.900,P=0.002)、治疗因素(F=40.470,P<0.001)和交互作用(F=6.518,P=0.018)均有统计学意义。IL-23 的模型因素(F=1.810,P=0.191)无统计学意义,治疗因素(F=13.730,P=0.001)有统计学意义,交互作用(F=0.501,P=0.486)无统计学意义。TNF-α 的模型因素(F=2.746,P=0.111)无统计学意义,治疗因素(F=4.967,P=0.036)和交互作用(F=7.243,P=0.013)有统计学意义。IFN-γ 的模型因素(F=1.839,P=0.188)无统计学意义,治疗因素(F=8.748,P=0.007)有统计学意义,交互作用(F=2.622,P=0.119)无统计学意义。事后分析显示,BTBR 组小鼠IL-1β(P=0.001)、IL-18(P=0.002)、TNF-α(P=0.025)较B6 组小鼠升高有统计学意义。rTMS 治疗后,BTBR+1 Hz 组小鼠皮质IL-1β(P<0.001)、IL-18(P<0.001)和TNF-α(P=0.010)较BTBR组小鼠降低有统计学意义。见表3。

Tab.3 ELISA results for cortical and hippocampal cytokines表3 皮质、海马炎症因子ELISA结果
小鼠海马中,IL-1β 的模型因素(F=4.404,P=0.047)、治疗因素(F=33.660,P<0.001)和交互作用(F=15.600,P<0.001)均有统计学意义。IL-6 的模型因素(F=8.325,P=0.008)、治疗因素(F=23.530,P<0.001)和交互作用(F=7.213,P=0.013)均有统计学意义。IL-18 的模型因素(F=0.820,P=0.374)无统计学意义,治疗因素(F=40.780,P<0.001)和交互作用(F=16.600,P<0.001)有统计学意义。IL-23 的模型因素(F=1.011,P=0.325)无统计学意义,治疗因素(F=20.400,P<0.001)有统计学意义,交互作用(F=3.837,P=0.062)无统计学意义。TNF-α 的模型因素(F=11.020,P=0.003)、治疗因素(F=8.846,P=0.007)和交互作用(F=10.530,P=0.003)均存在统计学意义。IFN-γ 的模型因素(F=13.770,P=0.001)、治疗因素(F=5.753,P=0.025)和交互作用(F=13.190,P=0.001)均有统计学意义。事后分析显示BTBR 组小鼠IL-1β(P=0.001)、IL-6(P=0.003)、IL-18(P=0.009)、TNF-α(P<0.001)和IFN-γ(P<0.001)水平较B6组小鼠升高;rTMS治疗后,BTBR+1 Hz组小鼠IL-1β(P<0.001)、IL-6(P<0.001)、IL-18(P<0.001)、TNF-α(P=0.001)和IFN-γ(P=0.001)较BTBR组小鼠降低。见表3。
3 讨论
ASD 影响着全球约1%的儿童,但FDA 尚未批准任何针对其核心症状的干预措施。基于既往研究,本研究使用低频重复经颅磁刺激治疗BTBR ASD 模型鼠,探究其疗效及可能机制。使用三箱社交实验评估社交能力,结果表明具有正常行为学表型的B6组小鼠表现出社交偏好,而BTBR组小鼠表现出社交缺陷,rTMS 治疗后,BTBR+1 Hz 组小鼠的社交缺陷改善。使用理毛和埋珠实验评估刻板行为:理毛实验显示BTBR组小鼠刻板行为较B6组小鼠增加,rTMS治疗显著改善了BTBR 组小鼠的理毛时间;埋珠实验显示BTBR小鼠埋珠数量较B6小鼠多,而1 Hz rTMS 不影响小鼠埋珠数量。该结果表明1 Hz rTMS 可以调控BTBR 小鼠特定类型的刻板行为[17-18]。
为避免运动能力、焦虑水平对孤独症核心症状的行为学影响,使用旷场实验进一步评估各组小鼠状态。旷场实验发现各组小鼠运动能力相仿,而BTBR 小鼠较B6 小鼠进入中央区的次数多且处在中央区的时间长,表明BTBR 小鼠具有更低的焦虑水平,这与既往的研究结果相吻合[19]。1 Hz rTMS不影响小鼠的运动能力及焦虑水平。为了检测抑郁样行为,本研究采用悬尾和强迫游泳实验,结果显示1 Hz rTMS 对各组小鼠抑郁样行为没有显著影响。
既往研究认为皮质[20-21]和海马[22-23]的炎症参与ASD 的发生发展过程[24-26],ASD 的发病也与妊娠期母体的急慢性炎症相关[27]。已有研究发现,ASD 患者脑脊液中IL-6 和TNF-α 等炎症因子增加[24],而高浓度的炎症因子可通过降低长时程增强作用损害突触可塑性[28],同时小胶质细胞活化会释放更多的IL-6、TNF-α 等炎症因子[29]。而rTMS 可以直接影响皮质及海马的炎症反应[4,30-31],这可能是通过TNF-α 减少实现的[28,32],同时rTMS 可以通过调节小胶质细胞功能进而影响突触可塑性及炎症因子水平的变化[33-34]。本研究发现BTBR 组小鼠皮质中IL-1β、IL-18、TNF-α和海马中IL-1β、IL-6、IL-18、TNF-α 和IFN-γ 表达较B6 组小鼠明显升高,而BTBR+1 Hz 组小鼠皮质IL-1β、IL-18 和TNF-α 及海马中IL-1β、IL-6、IL-18、TNF-α 和IFN-γ的水平较BTBR组显著降低。此外,1 Hz rTMS显著降低小鼠皮质IL-23、IFN-γ及海马IL-23水平。这些结果提示,1 Hz rTMS 可能是通过抑制脑内炎症水平,进而发挥治疗BTBR ASD模型鼠的作用。
综上所述,本研究发现1 Hz rTMS 能显著降低BTBR 小鼠皮质IL-1β、IL-18、IL-23、TNF-α 和IFN-γ 及海马中IL-1β、IL-6、IL-18、IL-23、TNF-α和IFN-γ 的炎症因子水平,进而改善BTBR ASD 模型鼠的社交缺陷及刻板行为,且对运动能力和焦虑抑郁水平没有影响。这提示rTMS 可能通过抑制炎症水平,发挥治疗ASD的作用,为rTMS治疗ASD的应用提供了一定理论基础,但是其具体的作用机制仍需进一步探讨。

