光镊在肿瘤研究中的应用
张百红,岳红云
0 引言
光镊指用光阱对纳米至微米级的粒子进行操纵和捕获。1987年Ashkin首先发现和应用光镊捕捉和操控微粒,从那以后光镊被广泛地应用于生物学多个领域:Svoboda等应用光镊捕获的微球拖动肌动蛋白以8 nm步伐沿着微管移动,并产生3~4皮牛顿力(picoNewton, pN)的光力;Finer等发现每个ATP水解产生3~4 pN的光力和11 nm的动力冲程;Smith等应用光镊研究DNA的弹性和行为;Wang等测量了RNA聚合酶在转录期间产生的机械力;2018年Ashkin因发现并在生物系统中应用光镊而获诺贝尔物理学奖[1-6]。光镊可以在纳米空间、皮牛顿力和毫秒时间研究从单细胞到单分子的生物过程。现在已经应用到细胞、亚细胞和分子范围研究,也成为肿瘤研究的重要工具[7]。光镊用光操控物体,其作用机制见图1[8]。本文系统综述光镊在肿瘤研究中的作用。
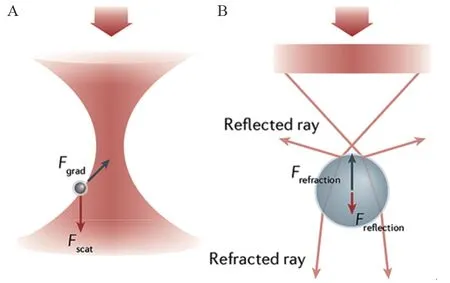
图1 光镊的作用机制[8]Figure 1 Mechanism of action of optical tweezers[8]
1 鉴别肿瘤细胞
细胞的机械特性影响细胞运动等细胞功能和过程,也是鉴别肿瘤细胞和正常细胞的主要标志。光镊可以测量细胞的硬度、弹性、粘度、流动性和细胞变形,从而无侵入、快速地识别肿瘤细胞。
1.1 细胞硬度
细胞硬度的精准测量有助于理解细胞的机械生物学,后者直接调控细胞增殖、黏附、迁移和移动等重要的细胞过程,细胞硬度也提供了肿瘤转移和分化的关键信息。Wang等[9]应用多孔磁镊操控和测量单细胞的亚细胞结构。三维磁场操控纳米磁珠进入肿瘤细胞,高通量共聚焦成像系统测量肿瘤细胞核的硬度。研究显示细胞核长轴较短轴的硬度增高,这种硬度极性可能调节肌动蛋白丝的分布,也影响核纤层蛋白和肌动蛋白的压力反应。Varol等[10]应用声镊联合全息图像直接测量结肠癌细胞和循环肿瘤细胞的硬度图谱,发现结肠癌细胞较循环肿瘤细胞的硬度增加,硬度值波动在1.79~2.26 kPa之间。
1.2 细胞弹性
细胞弹性是多个细胞功能的基础。Sirotin等[11]报告了一种新的单细胞光镊弹性成像方法测量肿瘤细胞弹性,这种方法应用光镊对细胞膜产生机械刺激联合相位敏感光学相干显微镜观察细胞机械反应,从而可检测细胞0.5 μm~10 nm范围的移动并记录光镊刺激细胞膜产生的机械波。全息图光镊可测量DNA弹性和驱动蛋白推力[12]。
1.3 细胞粘度
粘度是非均衡系统的一个重要特征,非侵入的粘度测量需要数秒时间。Terrasson等[13]应用光镊捕捉微粒的瞬时速度测量粘度,其速度精准至20微秒,而粘度测量也从静态平均转向动态跟踪。为了获取瞬时速度,研究者构建了结构光检测系统实时追踪微粒。光镊技术能够鉴别正常B细胞和非何杰金淋巴瘤B细胞,其机制是它们黏附到间充质干细胞的时间差异[14]。
1.4 膜流动性和张力
细胞膜的流动性联系着肿瘤的侵袭、转移。为了测试肿瘤细胞膜流动和侵袭的相关性,Li等[15]首先证实转染小RNA miR-92b-3p能够显著增加小细胞肺癌细胞株SHP77的侵袭性,然后应用光镊测量膜流动性。应用连续和逐步延伸方法测量SHP77细胞转染miR-92b-3p前后的膜流动性变化,通过松弛曲线构建物理模型推断细胞膜的静张力和粘度。结果显示,转染miR-92b-3p的肿瘤细胞膜流动性和侵袭性显著增加。细胞力学变化直接影响细胞变形和肿瘤细胞播散。Tsujita等[16]应用光镊、基因干预和机械扰动等方法研究显示,上皮细胞维持较高的质膜张力可能潜在地抑制肿瘤细胞迁移和播散,其机制是抑制膜弯曲敏感蛋白BAR。
1.5 细胞变形
细胞变形是肿瘤细胞侵袭的特征之一,传统检测方法通过给细胞压力观察细胞直径、面积和厚度变化,细胞物理变化的人工测量缺乏敏感性和客观性,加之细胞形态的非均质性,细胞变形和物理变化并非线性相关,这些导致细胞变形的测量有许多不确定性。Lee等[17]应用声镊联合机器学习自动测量不同压力下细胞面积变化的比率并分析比率变化和细胞变形的相关性,这种方法可以精准地鉴别侵袭性和非侵袭性乳腺癌细胞。
2 操控肿瘤细胞
2.1 细胞捕获
光镊是捕捉和操控活细胞的有力工具。Zhao等[18]构建的携带光栅的光镊能够捕捉和操控拥挤微环境中的单细胞。应用这种双捕捉光镊成功地操控淋巴结中的淋巴细胞和血管中的单个血细胞,这有助于研究自然杀伤细胞对肿瘤细胞的免疫攻击。但是强烈的光热和严格的溶液环境限制了其在生物领域的应用。低温光热泳镊采用环境冷却策略增强低温下光热泳的捕获能力并减少对靶标的热损伤,它可以在自然基质中低光力捕获各种胶体和细胞[19]。光片为基础的光镊较传统的点捕捉光镊有更高的光力和捕捉硬度,它能够同时捕捉多个活细胞[20]。光诱导的电热微流体镊能够操控等渗液中胰腺癌细胞[21]。
2.2 细胞转运
光片为基础的光镊除了捕获细胞外,还能够在横切面上转运和旋转细胞[20]。基于光电镊的微型机器人较传统的光镊更加轻柔地转运细胞,用于单细胞分离、克隆扩增和操控细胞[22]。
2.3 细胞分类
Xu等[23]建立的光镊辅助的静态池成像分类系统可以精准快速地分离、培养和测序人体肿瘤细胞。在微流控芯片中构建稳定的静态流场,靶细胞被限制在流场内进行平面明场、荧光成像或拉曼扫描,然后1 064 nm光镊捕捉并用单细胞纳升微粒包裹后分类。该系统的单细胞分类准确率>99.7%,每分钟可分选10~20个细胞,并高度保持了细胞活性,因此可能被广泛用于肿瘤细胞的分类。
各类光镊可以操控肿瘤细胞,多功能声镊也能无接触精准操控细胞,包括细胞排列、细胞刺激和细胞裂解[24]。
3 分析单分子
光镊技术对肿瘤学产生了深远的影响。普通的光镊可能导致细胞或分子损伤,低温光镊通过固态光冷却和热移产生温度场捕捉微粒和分子,同时也避免了聚焦激光束产生的光热损伤[25]。高分辨率光镊和等离子镊为光控和分析单分子带来了新可能[26-27]。
3.1 测量DNA
纳米光镊由两个间隔10~20 nm的微电极组成,它能够在单分子水平提取活细胞样本分析DNA和蛋白质[28]。Shrestha等[29]应用DNA纳米开关卡钳构成的光镊测量DNA和蛋白质,其精度可达到埃米级。通过测量DNA标记残基,研究者绘制了自然和合成多肽的单分子指纹图谱,显示了不同异质群中不同转录后修饰的蛋白质组学差异。DNA镊甚至可以直接制造DNA[30]。
3.2 可视染色体
人类细胞中的核DNA在准备细胞分裂时呈现X型的染色体,这种变形主要由凝缩蛋白和拓扑异构酶Iiα驱动。Meijering等[31]基于光镊测量和可视分裂中期染色体的力学和结构,发现在不断增加的光力下,染色体表现出不同于经典聚合物预测模型的非线性硬度特征,拓扑异构酶Iiα在维持染色体压缩方面发挥重要作用。
3.3 传输囊泡
胞外囊泡(extracellular vesicles, EVs)能够用于多种疾病的诊断、监控和治疗[32]。常规的光镊并不能捕捉和操控这些纳米尺度的EVs,几何诱导的电流体镊可以产生多个电流体电位,在几秒内实现EVs的平行传输和捕捉。通过在每个电流体阱的中心形成等离子腔,单个EVs被放置在等离子腔周围,从而实现远距离等离子增强的光捕获,但不会产生有害的热损伤效应[33]。光镊可以装配和重构囊泡,这个重新编辑的囊泡具备新的功能[34]。
光镊已经成为操控单分子的主要方法,也是研究蛋白质-核酸相互作用、蛋白质-RNA折叠和分子马达的重要工具[35]。
4 辅助肿瘤治疗
热电纳米光镊通过加热等离子基质使激光点内离子空间分离产生光热电场,联合暗场光学成像能够选择性捕捉纳米颗粒和原位观察光谱反应,这也为单细胞尺度研发抗肿瘤新药提供了新的工具[36]。
4.1 筛选靶向药物
蛋白激酶的突变常常联系着肿瘤的发生,也是肿瘤治疗的重要靶标。但是,一些突变可能导致靶向药物抵抗,而这些耐药突变常常定位在靶向药物作用位点以外,提示可能存在变构效应。Hao等[37]应用单分子光镊选择性地操控蛋白质特定区域,从而追踪变构信号和检测变构图谱。单分子光镊方法不仅可以操控蛋白激酶A的调节亚单位,也能够稳定地研究其他激酶,这为筛选潜在的肿瘤变构药物开创了新方法。有丝分裂驱动蛋白Eg5是一个重要的肿瘤治疗靶标,但Eg5小分子抑制剂的临床试验却没有进展,因为另一种内源性驱动蛋白KIF15促进有丝分裂并导致Eg5抑制剂抵抗。Milic等[38]应用小分子光捕捉技术研究KIF15的机械化学特性以及运动性,发现KIF15的运动性与Eg5完全不同,筛选KIF15运动性的潜在抑制剂KIF15-IN-1,并证实KIF15-IN-1联合Eg5抑制剂可以明显抑制肿瘤细胞的生长。
4.2 设计端粒酶抑制剂
高通量光镊可以观察端粒酶合成端粒的过程和捕捉端粒酶合成的DNA,这为设计端粒酶抑制剂提供了更加精细的方法。端粒酶维持肿瘤细胞的增殖,为了补充细胞分裂导致的端粒DNA丢失,端粒酶持续催化合成染色体末端的GGTTAG重复序列,Patrick等[39]将端粒酶和其底物DNA分别连接在聚苯乙烯微球上,随着端粒酶和底物相互作用新合成的DNA增加,两个微球之间的距离伸长,光镊能够捕获微球的位置计算伸长的距离并转换为核苷酸数量。
4.3 控制免疫治疗
T淋巴细胞通过αβ T细胞受体识别抗原肽。与传统的受体-配体作用不同,机械力在非均衡机械敏感的T细胞激活中发挥重要作用。细胞移动和细胞骨架产生的机械力作用于T细胞受体-主要组织相容性抗原,这个T细胞激活过程能够通过光镊显示和测量。因此,光镊能够控制和设计细胞毒性T淋巴细胞为基础的免疫治疗[40]。Duś-Szachniewicz等[41]应用光镊构建琼脂糖水凝胶和淋巴瘤细胞构成的淋巴瘤体,这个淋巴瘤体具有三维机构,它能够精准地评估抗肿瘤药物阿霉素、伊布替尼和普乐沙福对淋巴瘤细胞的影响。
5 未来方向
光镊因其无毒性和低损伤等特性而用于肿瘤研究。光镊正在改变着肿瘤研究和治疗,其功能从鉴别和操控肿瘤细胞、分析单分子到辅助肿瘤治疗,未来甚至可以用光镊直接捕捉和清除肿瘤细胞,或精准剪切和编辑肿瘤基因,或靶向设计和构建免疫细胞。然而,光镊辅助肿瘤治疗目前尚无临床前应用,多在实验研究阶段。与光镊作用机制相似的声镊、磁镊、静电镊、微流控光镊和全息光镊也逐渐进入肿瘤研究的视野。为了促进光镊的临床应用,安全性和毒性的准确评估是必需的。光镊和基因编辑、活细胞成像技术的联合将提供更加精细的肿瘤细胞和分子的信息,也将筛选更多地肿瘤标志物和治疗靶标。
利益冲突声明:
所有作者均声明不存在利益冲突。

