关于高效液相色谱-串联质谱法测定牛肉中β-激动剂类药物残留的研究
◎ 左 丹
(湖南省分析测试中心有限公司,湖南 长沙 410000)
1 实验部分
1.1 实验材料与设备
1.1.1 实验材料
牛肉:经检验β-受体激动剂呈现阴性的牛肉,绞碎均质。
1.1.2 主要试剂
甲醇、乙腈、甲酸、乙酸乙酯、叔丁基甲醚、高氯酸、氨水、氢氧化钠溶液、乙酸铵缓冲液、甲酸水溶液-甲醇溶液(体积比=90 ∶10)、β-葡萄糖醛酸酶(30 U·mL-1)。
对照品:莱克多巴胺、克伦特罗、沙丁胺醇(含量均≥98%)。同位素内标:莱克多巴胺-d3、克伦特罗-d9、沙丁胺醇-d3。
1.1.3 主要仪器设备
TSQ Quantis 型号高效液相色谱-串联质谱仪:配电喷雾离子源(ESI);分析天平;氮吹仪;水平振荡器;固相萃取装置等[1]。
1.2 混合对照品溶液及内标液的制备
准确称取莱克多巴胺、克伦特罗、沙丁胺醇各10 mg,放置于100 mL 的棕色量瓶内,用甲醇定容,将其制备为0.1 mg·mL-1的混合对照品溶液,4 ℃避光保存备用,临用时可用甲醇稀释为所需浓度混合液。称取3 种同位素内标10 mg,同样的方法配置为100 μg·mL-1的储备液保存,用时可用甲酸水溶液稀释为100 μg·L-1的混合液,获得内标工作液[2]。
1.3 样品前处理
1.3.1 酶解和提取
称取新鲜或者冷藏解冻的试料2 g 置于50 mL 离心管内,加入0.2 mol·L-1的乙酸铵缓冲液6 mL、β-葡萄糖醛酸酶40 μl,涡旋均匀,于避光条件下37 ℃水浴振荡16 h,放至室温备用。
1.3.2 萃取、净化、浓缩
取上步骤获得备用液,加入100 ng·mL-1的内标液100 μL,涡旋均匀并在8 000 r·min-1的条件下离心8 min,取上清液,加入5 mL 高氯酸溶液(0.1 mol·L-1),涡旋均匀,用高氯酸调节pH 至1,在8 000 r·min-1的条件下离心8 min,在获得的上清液中加入NaOH 溶液(10 mol·L-1),调节pH 至10。加入乙酸乙酯15 mL,中速振荡5 min,在5 000 r·min-1的条件下离心5 min,获取上层有机相。对于上层水相,可加入叔丁基甲醚10 mL 进行提取,将前后2 次提取的有机相进行合并,50 ℃氮吹,并用甲酸溶液(2%)溶解备用[3]。
应用混合型阳离子交换固相萃取柱进行净化,分别用3 mL 甲醇及3%甲酸活化萃取柱后,备用液过柱后用2%甲酸与甲醇各3 mL 淋洗、抽干,用5%的氨化甲醇溶液3 mL 洗脱后50 ℃氮吹。
用0.5 mL 甲醇-1%甲酸溶液溶解残余物后过滤膜(0.22 μm 孔径),获得供试品溶液。
1.4 仪器条件
色谱柱:Waters C18 (Xbridge BEH 2.5 μm);柱温:40 ℃;进样量:20 μL;流速:0.2 mL·min-1;流动相:溶剂A+溶剂B。梯度洗脱程序见表1。
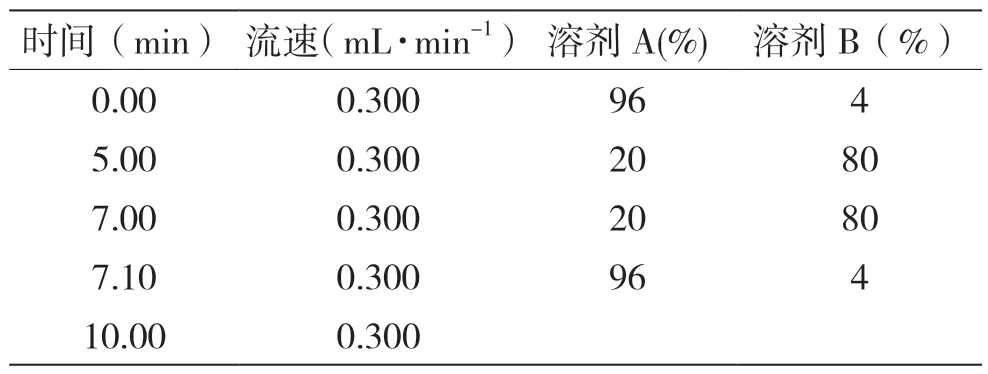
表1 流动相及梯度洗脱程序表
离子源:电喷雾(ESI+);扫描方式:选择反应检测扫描(SRM);离子喷雾电压:3 500 V;离子传输管温度:320 ℃;蒸汽温度:350 ℃;鞘气流速:40 Arb;辅助气流速:5 Arb。
2 结果与分析
2.1 酶解温度的优化
通过查阅相关文献得知,β-葡萄糖醛酸酶适用的温度处于40~110 ℃,于试料牛肉离心管内,加入0.2 mol·L-1的乙酸铵缓冲液6 mL、β-葡萄糖醛酸酶40 μL,涡旋均匀后分别于避光条件下37、45、53、61、69 ℃水浴振荡16 h,再经萃取、净化、浓缩后对3 种β-受体激动剂含量进行检测,结果见表2。

表2 不同酶解温度对β-受体激动剂测定结果的影响表
表2 显示,当酶解温度在37~45 ℃范围内时,3 种β-受体激动剂的测定结果差距不明显,均与推荐值最接近,随着温度的继续升高,在达到53 ℃后,测定值会有所降低,这可能因为温度过高会导致物质挥发丢失。所以,最合适的酶解温度为37 ℃[4-5]。
2.2 酶解时间的优化
设置样品酶解与提取前处理的酶解时间为37 ℃下水浴振荡8、12、16、20、24 h,再经萃取、净化、浓缩后对3 种β-受体激动剂含量检测,结果见表3。
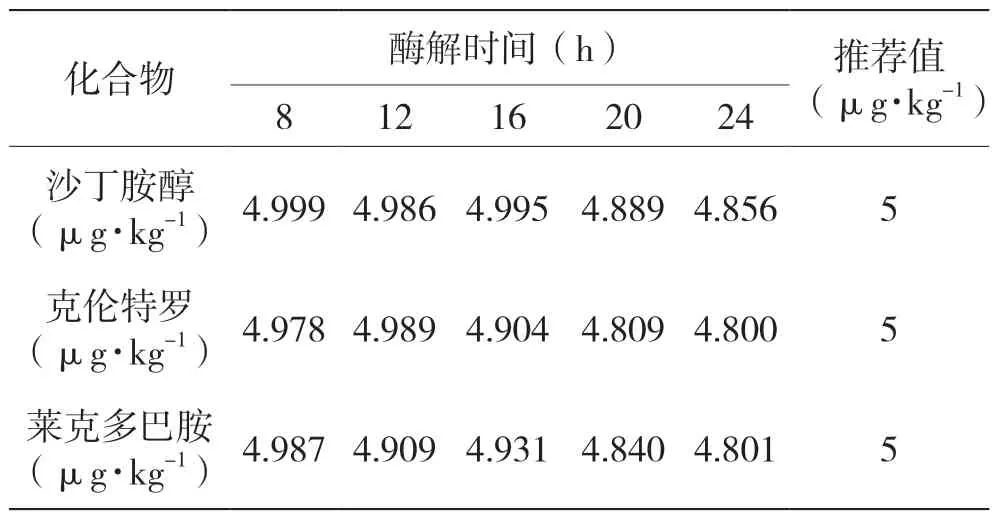
表3 不同酶解时间对β-受体激动剂测定结果的影响表
表3 显示,酶解时间为8、12、16 h 时,β-受体激动剂含量测定值差距相对较小,均接近推荐值5 μg·kg-1,适合酶解时间为8 h。
2.3 净化条件的优化
应用SPE 技术净化,分别创建4 种淋洗液与洗脱程序,研究加标回收率,选择最佳净化条件,具体见表4。
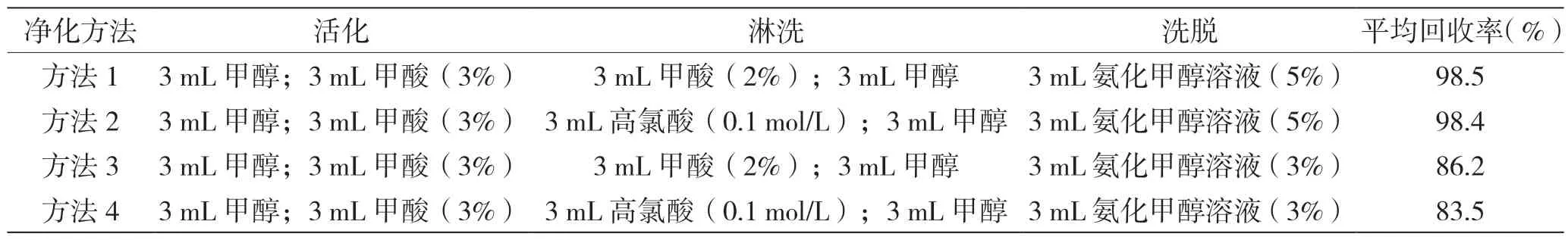
表4 不同净化条件的β-激动剂回收率表
表4 显示,方法1 与方法2 下3 种β-激动剂的平均回收率差异性不大,分别为98.5%、98.4%。因此,该实验净化条件可以选择方法1 或者方法2。
2.4 方法回收率分析
各称取牛肉样品2 g,按照上述最佳前处理条件,分别添加不同梯度的3 种β-受体激动剂标准物质0、5、5、10 ng,并定容至1 mL,计算其分析结果及回收率见表5。
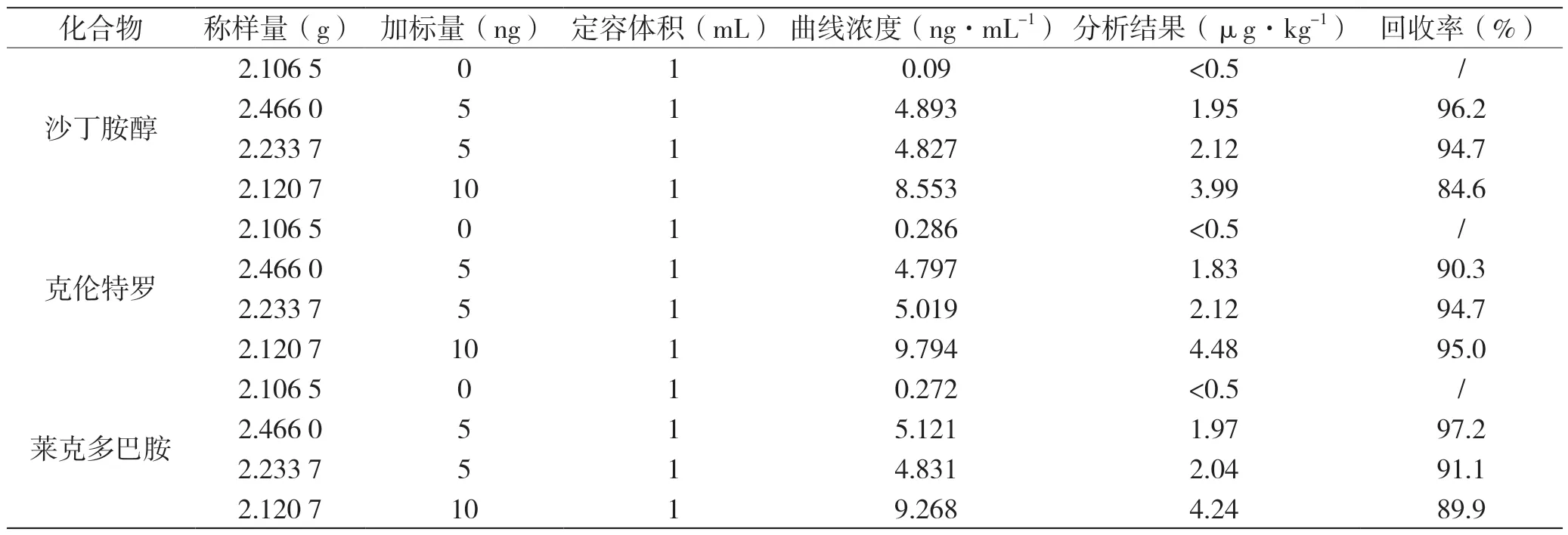
表5 3 种β-受体激动剂加标回收实验结果表
由表5 可知,β-受体激动剂化合物的加标回收率处于84.6%~97.2%,代表该检测方法具备较高的准确度,可以满足检测要求。
3 结语
本实验采用酶解与固相萃取的前处理技术和液质联用对牛肉中的3 种β-受体激动剂进行检测,发现最佳的酶解温度为37 ℃,酶解时间为8 h,净化条件如下。活化:3 mL 甲醇;3 mL 甲酸(3%)。淋洗:3 mL甲酸(2%)或者3 mL 高氯酸(0.1 mol·L-1);3 mL甲醇。洗脱:3 mL 氨化甲醇溶液(5%)或者用代替淋洗中的甲酸,该方法具备较高的加标回收率,可检测牛肉中的“瘦肉精”药剂残留。

