藻类中的汞含量和汞稳定同位素组成研究进展
李鹏高,汤顺林
河南理工大学资源与环境学院,河南 焦作 454000
藻类是一类最为简单的自养型低等植物,为水生态系统中最主要的初级生产者,处于食物链的底端.藻类具有光合色素和单细胞生殖器官,通过光合作用(占全球光合作用的32%以上[1])制造有机物并进行孢子繁殖,广泛分布于海洋、湖泊、河流与水库等自然介质中.浮游藻类的繁殖、生长和死亡后沉积等过程会吸附、吸收和累积包括汞在内的多种重金属离子,如1995 年Gonzalez-Davila 等[2]研究了杜氏藻(Dunaliellatertiolecta)表面及其分泌物键合二价Cu离子的行为,1998 年Zhou 等[3]研究了微型藻类和大型藻类对Cu 和Cd 离子的吸附与脱附,2001 年Schmitt 等[4]初步研究了微型藻类对汞等六种重金属离子的吸附动力学,这些研究已经应用于受重金属污染水体的生物修复领域[5-6].
汞是一种对生物和人体具有严重生理毒性的重金属.由于藻类对汞的生物吸附、生物累积和生物放大作用,藻类中的汞含量可能高于周围水中汞浓度的106倍[7-8],并通过食物链危害高营养级生物乃至人体.研究发现,暴露于高Hg2+浓度水体的海洋硅藻细胞对汞的吸收率是暴露于低Hg2+浓度水体的硅藻细胞对汞的吸收率的126 倍,同时硅藻细胞在低Hg2+浓度水体中的生长几乎不受抑制,而在高Hg2+浓度水体中的硅藻生长密度会下降40%,但将其转移到无汞培养基中时,遭受高Hg2+浓度暴露的藻类,其生长趋于恢复,细胞内汞浓度也明显降低[9-10].尽管没有观察到低Hg2+暴露浓度下对细胞生长的明显影响,但通过基因转录组学研究发现,莱茵衣藻(Chlamydomonas reinhardtii)即使在汞背景浓度(10-11~10-8mol/L)的暴露下,参与细胞运动、营养和氨基酸代谢的基因也会失调[11].这些研究表明,微型藻类细胞中汞的水平影响着微型藻类的生长和生理功能,与其毒性密切相关,然而汞是如何进入藻细胞的机制尚不清楚.
自然界中有7 种汞稳定同位素,包括196Hg(占0.15%)、198Hg(占9.97%)、199Hg(占16.87%)、200Hg(占23.10%)、201Hg(占13.18%)、202Hg(占29.86%)和204Hg(占6.87%),同位素之间相对质量差达4%[12].汞是目前唯一确定的既能发生质量分馏(MDF,以δ202Hg 表示)又能发生非质量分馏(MIF,以∆199Hg 表示)的重金属元素.实验研究显示:一系列涉及汞地球化学循环的重要自然过程,如挥发与蒸发过程[13]、氧化/还原[14]、微生物甲基化/去甲基化过程[15]、光致还原反应[16-17]和天然热液系统[18]等都可导致显著的汞同位素质量分馏.相比较而言,汞稳定同位素非质量分馏仅发生于特殊的光致还原反应[19],因此汞稳定同位素非质量分馏信息更常用于追踪不同地质体系中的汞循环,如藻中汞的来源和汞进入藻类中的机制.目前发展迅速的汞稳定同位素研究有助于了解汞进入藻细胞的分配与机制.
2023 年罗晓庆等[20]重点总结了室内控制实验条件下藻类对甲基汞的富集、食物链传递特征、影响因素和富集机制,而本文主要梳理了国内外野外观测与分析的有关藻类中汞含量和汞稳定同位素组成的研究结果,概述了藻类细胞吸附吸收水体中汞的可能机制,以期为利用微型藻类治理受汞污染水体技术和汞生物地球化学循环提供参考.
1 藻类中的汞含量
1.1 藻类的分布、类型和生态功能简述
藻类是地球上最古老的生物体之一,在地球上分布极广,对环境适应性较强,即使在极低的营养浓度、极微弱的光照强度和非常低的温度下也能生活.它能生长在江河、溪流、湖泊和海洋,也能生长在短暂积水或潮湿的地方.从热带到两极,从积雪的高山到温热的泉水,从潮湿的地面到不很深的土壤内,都有藻类分布.
藻类按大小分为微型藻类和大型藻类,按生态特点分为浮游藻类、飘浮藻类和底栖藻类.藻类学家按色素将藻类分为绿藻纲、褐藻纲、红藻和粘藻纲4 个纲,并根据营养细胞中色素的成分和含量及其同化产物、运动细胞的鞭毛以及生殖方法等,将藻类进一步分为11 个门,即蓝藻门、红藻门、隐藻门、甲藻门、金藻门、黄藻门、硅藻门、裸藻门、褐藻门、绿藻和轮藻门[21].据统计,全球有35 255 种藻类,其中淡水藻有20 130 种.我国已调查的淡水藻种数有8 979 种,约占全球淡水藻类种数的45%[22],近岸海藻有835 种,约占全世界海藻总数的1/8[23],优势种为硅藻门和绿藻门[24].
大多数藻类体积微小,比表面积大,结构简单,无组织分化,水体污染物很容易直接接触和进入藻细胞,因此藻类对包括汞在内的许多重金属和化合物具有较强的富集作用.由于藻类对重金属的吸附效率高且耐受能力较强,利用微型藻类等微生物对汞等重金属污染水体、废水进行生物修复已经取得了较好的效果,国外从20 世纪80 年代开始从事这一领域的研究,90 年代就已经得到了较快发展[25].
由于藻类等浮游植物繁殖周期短,对水体环境的变化响应尤其灵敏,因此藻类等浮游植物的生长状态已成为衡量水体质量的重要参考标准[26-29],区域水体内浮游植物生物量的剧烈减少或爆发式增长都预示着该水域生态环境遭受破坏.例如,由于水体富营养化导致内陆湖泊蓝藻爆发,海洋水华和赤潮等事件往往会引发水体大量缺氧、水质迅速恶化、水生生物生存环境遭受巨大威胁.
1.2 藻中汞的来源
大多数藻类生活在水环境中,依照阳光所能到达的深度分布于整个水体,是水生态系统中主要的生产者、物质循环和能量转化中连接生命与非生命成分的关键起点.藻类的光合作用利用光能裂解水分子释放氧气最终将CO2转化为有机碳,存储在细胞中,形成水生食物链的基础,维持水中溶解氧水平(高达60%来自藻类和水生维管束植物的光合作用)和大气CO2平衡,影响生活在水生生态系统中高等生物群落的组成和生产力.藻类的繁殖周期短,生长速度快,有些藻类细胞每天可以分裂两次以上[30],水生浮游植物每年大约占全球初级生产力的50%[31],为水生食物网及整个水域生产力提供物质基础.
由于大豆根系的复杂性,对于公理以及产生式规则的提取,需要考虑主根的粗度及其随时间的变化、侧根的弯曲度及随机性等因素,为了处理的方便,根系L系统在设计时区分了左右侧根,具体L系统设计如下:
藻类能直接吸附吸收水环境中的汞,并在摄食的消费者中富集和放大.大气的干湿沉降是汞进入陆地及水环境的主要途径,而水环境是汞生物地球化学循环的重要汇.全球汞循环模型研究[32]表明,自然释汞源(火山喷发、岩石风化、森林火灾、植物蒸发、土壤和水体的蒸发与挥发等)和人为释汞源(化石燃料燃烧、金属冶炼、垃圾焚烧、汞矿开采等)每年向大气排放6 500~8 200 t 汞,通过大气干湿沉降每年向海洋输入约4 000 t 汞,每年向陆地和淡水输入约3 000 t汞(其中河流每年向海洋输入约380 t 汞),每年从水环境逸散入大气环境约3 000 t 汞.
水环境是汞形态转化的重要场所,对汞的迁移、生物累积和放大有重要影响.天然水体中主要有原子态汞(Hg0)、无机汞(Hg+、Hg2+)和甲基化汞〔CH3Hg+、(CH3)2Hg〕.不同形态的汞在一定的氧化还原条件下发生相互转化(见图1).无机Hg2+是水环境中汞的主要形态,光化学反应会导致表层水中的Hg2+还原为Hg0逸散到大气中,而无机汞向甲基汞的转化过程是水环境中最受关注的生物地球化学行为.甲基汞主要是硫酸盐还原菌参与的微生物甲基化过程形成[33],但在有机质丰富的水体中化学甲基化过程不容忽视[34].微生物甲基化反应在水体和沉积物的氧化还原界面均可进行,甲基化速率主要取决于微生物的种类、活性、可供甲基化的无机汞量,同时还受温度、pH、氧化还原电位(Eh)以及有机、无机配位体(主要是OH-、Cl-和S2-)等因素影响[35].水环境中的甲基汞通过微生物和化学两种途径去甲基化降解.微生物去甲基化反应是一种生物酶催化分解过程,在好氧或厌氧条件下均可发生,其最终产物为Hg0和甲烷.甲基汞的化学降解主要通过光化学反应进行,但也有非光照介导的去甲基化反应发生[36].因此水环境中的甲基汞含量是甲基化和去甲基化两种反应综合作用的结果.目前,没有证据表明藻类可以直接产生甲基汞,但有证据表明藻类通过影响甲基汞菌活性而间接改变甲基汞浓度[37].
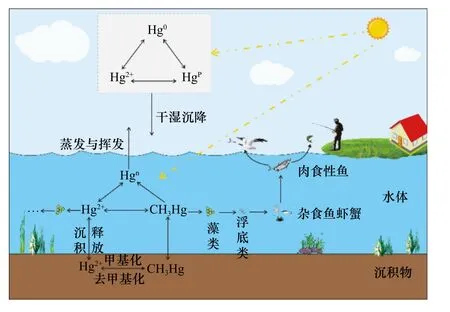
图1 汞在水生生态系统中的形态与生物传递Fig.1 The speciations and transport of mercury in aquatic ecosystem
1.3 藻类对水体中汞的吸附和吸收
水体中的汞能被藻类直接吸附吸收,并在摄食的消费者中富集和放大.海水中总汞的平均浓度(0.1~0.8 ng/L)低于淡水中总汞的平均浓度(1~10 ng/L),处于水生态系统顶端的鱼类中甲基汞含量比水体高106~107倍[38].20 世纪50 年代日本熊本县水俣湾爆发的“水俣病”事件就是当地居民食用汞和甲基汞污染的鱼、虾和贝类等海产品导致;80 年代初人们发现北欧和北美偏远地区半数以上湖泊鱼体汞含量超过世界卫生组织建议的水产品食用标准[39],研究表明这些偏远地区湖泊鱼体汞污染是人为活动排放的汞经大气长距离迁移后的沉降造成[40],对此相关国家在这些湖泊周围设警示牌,提醒公众避免食用高甲基汞含量的鱼种.
藻类等浮游植物是汞进入水生食物链的关键入口,控制着整个水生食物链中汞的水平[41].目前水生食物链中总汞和甲基汞含量的一些研究结果汇总如图2[42-51]所示.由于分离野外采集的足够分析用的单一纯藻种样品较为困难,纯活体微型藻种中汞含量研究十分缺乏,甲基汞含量报道则更少,目前仅有2012年Perrot 等[42]报道的贝加尔湖中两个淡水浮游植物样品中的总汞含量(分别为14 和6 ng/g)和甲基汞含量(分别为1.96 和0.18 ng/g),比贝加尔湖水中总汞含量(1.20 ng/L)高出2~3 个数量级[52].Perrot 等[42,52]还报道了4 个浮游生物(由不同比例的浮游植物和浮游动物组成)样品中的总汞和甲基汞含量,分别为(27.25±21.67) ng/g(n=4)和(10.72±12.38) ng/g(n=3).
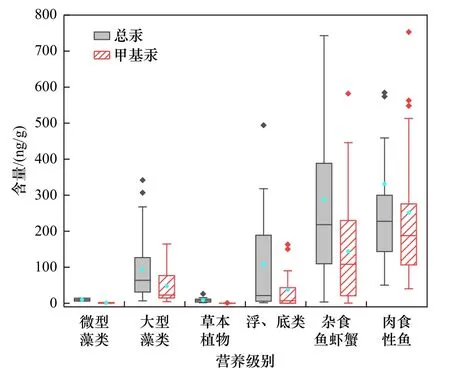
图2 藻类与水生食物链中的总汞和甲基汞含量Fig.2 Total mercury and methylmercury content in algae and their aquatic food chain
大型藻类生命周期长于微型藻类,因此大型藻类中的总汞和甲基汞含量均高于微型藻类,如2017 年Novianty 等[44]分析得到印度尼西亚Burung 和Tikus岛周围海水中大型藻类中总汞含量为(35.54±16.20)ng/g(n=14);2020 年Meng 等[45]报道显示,渤海湾大型藻类中总汞含量为(165.90±85.97)ng/g(n=13),甲基汞含量为(53.18±49.88)ng/g(n=13).以上仅有的结果与Chen 等[53-54]的研究结果一致.
野外采样分析和室内研究均观察到汞的“藻华稀释(或生物量稀释)”现象,即浮游生物中的汞含量与不同营养状态湖泊中的浮游生物密度或生物量呈负相关[53,55-58],但在中国西南部的富营养化湖泊[59]和东非不同营养状态(从中富营养到超富营养)的湖泊中并没有观察到这种关系[60].大多数学者一般采集分析天然水体中0.45~200 μm 粒径的微悬浮物样品中的汞和甲基汞含量作为水生食物链底端-初级生产者的汞和甲基汞含量[54],但这种采样方法也收集了其他一些能吸附汞的微生物、细胞碎片和非生物颗粒,这些非藻类成分可能会导致对天然藻类累积汞量的低估或高估[61].此外,一些环境因素和浮游生物群落也可能影响热带和亚热带地区水生生态系统中汞的生物累积.例如,水的溶解有机碳(DOC)和pH 会改变汞的生物利用度进而影响浮游动物[59]和浮游生物[62-65]对汞的吸收,而环境和生物因素的协同作用可能会抵消或掩盖“藻华稀释”现象.
自水生食物链底端——浮游植物以上各营养级生物对汞的生物累积和放大模式基本相似,随着营养级的提高,汞的含量和放大倍数也升高,且甲基汞占总汞的比例也随之升高(见图2),但生物累积和放大倍数远低于藻类从水体中累积和放大倍数.例如,水生草本植物是水生生态系统的二级生产者,总汞和甲基汞的含量分别为(8.60±6.28)ng/g(n=17)和(0.20±0.16)ng/g(n=17)[46-48];浮游动物和底栖动物的总汞和甲基汞的含量分别为(107.87±138.22)ng/g(n=18)和(37.75±53.22)ng/g(n=17)[45-47,49];杂食鱼虾蟹类中的总汞和甲基汞的含量分别为(37.75±53.22)ng/g(n=48)和(143.85±135.08)ng/g(n=48)[45,47-48,50];处于水生食物顶端的食肉性鱼中总汞和甲基汞含量最高,分别为(331.11±457.62)ng/g(n=77)和(251.11±233.93)ng/g(n=49)[45,50-51].这与Wu 等[66]和Lavoie 等[67]对水生食物链中总汞和甲基汞含量的结果一致.
1.4 藻类吸附吸收水体中汞的机制
尽管汞是藻类生长过程的非必需元素,但藻类等浮游植物吸收累积水体中汞的现象已被大量野外采样分析和室内研究证实.藻类为了进行光合作用,从周围水体吸收包含汞等微量重金属的营养物质,因此藻类对吸收元素的自然循环有着较大的影响,参与了决定水生生态系统中微量重金属行为的主要过程.
藻类是水体中汞进入水生食物链的关键入口和重要渠道,目前普遍接受的是水体中藻类通过细胞壁的表面吸附和细胞内的主动吸收两种方式吸收水体中的溶解态汞[11](见图3).由于藻类细胞壁上存在氨基(-NH2)、羟基(-OH)、羧基(-COOH)、硫酸根(-SO4-)等多种带有负电荷的官能团,同时水体中的一些重金属离子会刺激藻类细胞壁外侧分泌多糖等物质,这些官能团与多糖能够吸附结合水体中的无机汞和部分有机汞〔见图3(a)〕;藻类细胞的代谢过程以及在细胞表面的微生物作用下,藻类细胞外侧吸附的无机汞会逐渐转化为甲基汞,通过载体蛋白而被富集在细胞内〔见图3(b)〕.进入藻细胞内的汞能诱导藻类的生理、细胞产生变化,积累的汞将进一步转移到草食动物和微生物群落中.
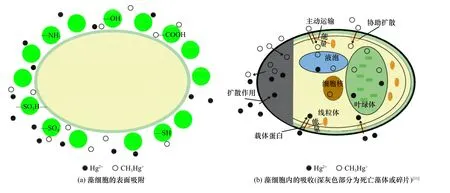
图3 藻类吸附吸收汞示意Fig.3 Schematic diagram of mercury adsorption and absorption by algae
不仅活体藻类能吸收富集水体中的汞,死亡的藻类细胞及其碎片〔见图3(b)中深灰色部分〕也能吸收水体中的汞,并最终进入到沉积物中.死亡的藻体主要通过与代谢无关的生物吸附来富集汞等重金属,相对于活体藻类虽然丧失了细胞内的主动运输,但死亡的藻类细胞有更多的官能团暴露出来,给金属离子提供更多的结合位点,在实际应用中非活体藻类生物富集量较活体藻类有更好的效果[68].
Outridge 等[69-70]研究了北极湖泊沉积物中的汞含量与初级生产力的关系,提出了类似“碳生物泵”的藻类清扫水体中汞的“汞生物泵”作用机制,即在没有人为汞输入的情况下,随着浮游植物生产力的提高,大量藻类清扫水体中的汞,导致沉积物中汞含量的显著增加.但这一“汞生物泵”作用机制仍有争议,一些研究发现多个湖泊沉积物中的总汞与藻类生产力指标之间存在显著相关性[71-79];另一些研究只在部分池塘或湖泊沉积物中观察到总汞与初级生产力指标的显著相关性[80-81],而有些湖泊水体和沉积物可能接受了较多的陆源汞和有机质[74,76,82],沉积物中的总汞与初级生产力没有相关性[83-84],由此得出藻类清扫水体中汞的“汞生物泵”作用只发生在部分水体中.淡水中汞的来源较海洋复杂,仅用总汞含量与初级生产力指标之间的关系来判别藻类对水体中汞的清除作用可能产生不一致的结果.
2 藻类中的汞稳定同位素组成
2.1 藻类及其食物链中的汞稳定同位素组成
目前报道的藻类生物与浮游动物、高等动物和高等植物中的汞稳定同位素信息汇总如图4[42-43,45,47,49,51,85-89]所示.藻类中的汞稳定同位素组成研究还十分匮乏,国外仅有1 个研究团队发表了2 个微型藻类(浮游植物)和国内1 个研究团队发表了13 个大型藻类的汞稳定同位素组成信息.无论是淡水微型藻类[42](∆199Hg=0.33‰±0.22‰;n=2)还是海洋大型藻类[45](∆199Hg=0.16‰±0.08‰;n=13)的汞稳定同位素非质量分馏信息均为明显的正值,也是目前唯一确认∆199Hg 为正值的植物(见图3),与高等植物[85-87](红树林树叶、白杨林树叶和落叶层和水稻)的∆199Hg 为负值(∆199Hg=-0.19‰±0.10‰;n=63)具有显著差异.
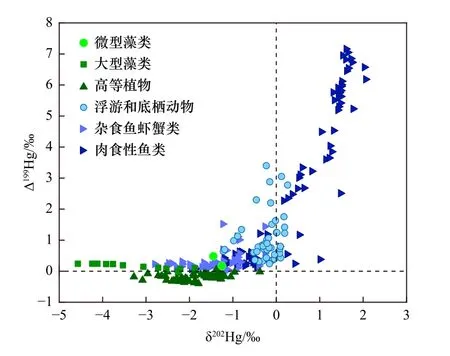
图4 藻类及其食物链中的汞稳定同位素信息Fig.4 Mercury isotopic signals in algae and their food chain
如前所述,活体藻类表面含有丰富的官能团(如-SH 等)在热力学上有利于藻类对水体中溶解的无机Hg2+迅速吸收和累积[61,90],使藻类达到一个较高的汞浓度水平.研究表明,水生环境中水体和表层沉积物中的生物过程(包括生物甲基化、去甲基化和还原过程)不可能产生汞同位素的非质量分馏[15,19,91],光化学反应才是导致汞同位素非质量分馏的主要原因[92-95].
水体中汞同位素的非质量分馏主要来自水体中无机汞的光致还原作用和甲基汞的光致降解过程,这些过程引起水体中剩余的汞反应化合物中奇数汞同位素的富集[16,96],从而导致藻类表面吸附的汞和藻体内吸收的汞表现出明显的奇数汞同位素异常,即汞稳定同位素非质量分馏信息为明显的正值.陆地高等植物主要从大气中吸收Hg0而显示负的∆199Hg[97].浮游动物、底栖动物和草食鱼虾蟹类摄食微型藻类,∆199Hg 也为明显正值但分馏程度不断变大,而处于水生食物链顶端的肉食鱼类具有最高的∆199Hg 值(∆199Hg=2.57‰±2.55‰,n=86),与许议元等[47]的研究结果一致,可能是由于营养传递过程中生物体内甲基汞的比例升高,汞的非质量分馏程度随食物链营养级的升高而变大.
所有的淡水微型藻类和海洋大型藻类的汞稳定同位素质量分馏信息均为负值,但海洋大型藻类的δ202Hg(平均值为-3.23‰±0.87‰,范围为-2.21‰~-4.57‰,n=13)比淡水微型藻类的δ202Hg(平均值为-1.35‰±0.14‰,范围为-1.25‰~-1.45‰,n=2)更偏负、范围更宽(见图4),表明藻类优先吸附和吸收水体中重的汞同位素,且淡水微型藻类中的汞稳定同位素比海洋大型藻类中的汞稳定同位素更重,这可能与水体中汞污染水平有关[42,45].
随着食物链营养级的提高,浮游动物和鱼虾类的汞稳定同位素质量分馏信息逐渐偏正,表明汞在食物链的生物富集和传递过程中相对富集偏重的汞同位素.水中浮游动物与鱼类MDF 有正有负,MIF 则显示为较大的正值,如美国杰克逊湖浮游动物和鱼类(δ202Hg 为0.03‰~2.61‰,Δ199Hg 为0.05‰~1.35‰)[49],北美五大湖中鱼类(δ202Hg 为0.17‰~2.06‰,Δ199Hg为2.50‰~6.18‰)[51],北太平洋亚热带环流区浮游动物(δ202Hg 为-0.52 ‰~0.26 ‰,Δ199Hg 为 0.24 ‰~2.78‰)、鱼类(δ202Hg 为-0.43‰~0.91‰,Δ199Hg 为0.82‰~2.09‰)[89].Δ199Hg 的正值更多的是归因于甲基汞在食物链中的传递,在生物积累之前,甲基汞在水环境中经历了显著的光降解.
2.2 藻类的相关沉积物中汞稳定同位素组成
尽管活体藻类的汞稳定同位素组成研究较少,但死亡藻类的海洋和湖泊沉积物中的汞稳定同位素信息有大量报道.海洋沉积物中MDF 一般为负值,MIF 一般为正值,如更新世北极海洋沉积物(δ202Hg为-2.34‰~-1.37‰,Δ199Hg 为-0.06‰~0.12‰)[98]、中更新世地中海腐泥(δ202Hg 为-1.11‰~-0.57‰,Δ199Hg为0.04‰~0.17‰)[99]、全新世葡萄牙大西洋边缘沉积物(δ202Hg 为-1.04 ‰~-0.21 ‰,Δ199Hg 为0.03 ‰~0.17‰)[100]、全新世亚里亚得海沉积物(δ202Hg 为-2.39‰~-1.49‰,Δ199Hg 为0.04‰~0.08‰)[101].湖泊沉积物中MDF 也为负值,且大部分湖泊沉积物的MIF 也为负值,但有少数湖泊沉积物的MIF 为正值,这可能与沉积环境有关,如北极湖泊沉积物(δ202Hg为-2.03‰~0.25‰,Δ199Hg 为-0.44‰~0.74‰)[88]、美国佛罗里达州湖泊沉积物(δ202Hg 为-1.19‰~-0.46‰,Δ199Hg 为-0.22‰~0.30‰)[102]、美国旧金山淡水沉积物(δ202Hg 为-1.08‰~-0.91‰,Δ199Hg 为0.13‰~0.20‰)[103].加拿大安大略省8 个淡水湖的表层水呈现明显正的Δ199Hg 和Δ200Hg 值,与当地大气降水的同位素特征相似,汞来源很可能是大气降水,而湖泊沉积物主要显示负Δ199Hg 值,与当地大气Hg0和陆地土壤、植物相似,沉积物中的汞主要来自流域的地面颗粒物输入[104].受人为汞污染较低的青藏高原两个湖泊——青海湖和纳木错湖的湖泊沉积物显示了正的Δ199Hg,与水中Hg2+的光化学还原相关,而且光还原受太阳辐射和水环境控制,温度升高,Δ199Hg 随之增加,偶数同位素MIF(Δ200Hg)也为正值,降水源贡献较大[105].
藻类和少数湖泊沉积物的MIF 为正值这一结果,可能对陆相油气的形成研究和勘探具有一定的指导作用.Tang 等[106-108]研究发现,烃源岩、天然气和原油的Δ199Hg 均为正值,油气生成过程中Δ199Hg 值变化不明显.基于油气与烃源岩、少数湖泊沉积物和浮游藻类Δ199Hg 为正值的相似性,预示着陆相油气的形成可能来源于藻类有机质丰富且Δ199Hg 为正值的少数烃源岩,有待深入研究.
3 结论与展望
3.1 结论
a) 藻类是汞进入水生食物链的关键入口,控制着整个水生食物链中汞的水平.藻类对汞的累积比水相中汞累积高出2~3 个数量级,自浮游植物以上各营养级生物对汞的生物累积和放大模式基本相似,随着营养级的提高,汞的含量和放大倍数也升高,且甲基汞占总汞的比例也随之升高,但其放大倍数远低于藻类对水体中汞的累积和放大倍数.
b) 藻类通过细胞壁的表面吸附和细胞内的主动吸收两种方式富集和累积水体中的溶解态汞.藻类细胞壁上多种带负电荷的官能团与多糖能够吸附结合水体中的无机汞和少部分有机汞,藻类细胞的代谢过程通过载体蛋白把藻体外的无机汞和有机汞转运至细胞内而富集汞.
c) 藻类是目前唯一确认∆199Hg 为正值的植物,无论是淡水微型藻类还是海洋大型藻类中的汞稳定同位素非质量分馏信息均为明显的正值,与高等植物的∆199Hg 为负值有显著差异.淡水微型藻类和海洋大型藻类的汞稳定同位素质量分馏信息均为负值,随着食物链营养级的增高,浮游动物和鱼虾类的汞稳定同位素质量分馏信息逐渐偏正,汞在食物链的生物富集和传递过程中相对富集偏重的汞稳定同位素.
3.2 展望
藻类等浮游植物从水体中吸收的汞决定了上层食物链中汞的水平,然而限于采样方法和分离技术,自然水体中纯藻类的汞和甲基汞含量研究还十分匮乏,因此研制和开发可行的自然水体中纯藻类分离技术是研究藻类从自然水体中吸收汞的关键和难点.目前,模拟自然条件下(汞浓度、光照、温度和水化学参数等)不同藻种的培养生长吸收水中汞的室内实验研究操作上简便可行.室内模拟研究能获得足够分析的连续纯藻种和水样品,分析藻类不同生长时期(生长密度)吸收水体中的汞量来评估藻类在水生态系统中的重要作用,分析藻类中的汞稳定同位素组成可深入探讨汞进入藻类细胞的分配和吸收机制,未来通过大量的实验与分析可筛选出对水体中汞吸收效果优良的藻种,为利用藻类修复被汞污染的水体或废水提供技术支撑.

