鄱阳湖碟形湖和通江水域有色可溶性有机物(CDOM)的吸收与荧光特性对比研究
简正军,徐 健,刘甲庆,胡启武
江西师范大学地理与环境学院,鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌 330022
有色可溶性有机物(CDOM,chromophoric dissolved organic matter)作为天然水体溶解性有机物储库中主要的光敏感组分,强烈吸收紫外光和部分可见光[1],能阻止紫外线对水生生物的有害影响,有效提高水生植物的初级生产力[2].CDOM 在吸收紫外辐射后,易发生光化学降解,释放CO2、CH4等温室气体,从而加剧全球变暖[3-4].CDOM 是重金属[5]和有机污染物[6]迁移的重要载体,其产生和迁移转化过程影响着碳、氮、磷等元素的地球化学循环[7].因此,研究CDOM组成及来源特征对于内陆水生生态环境具有重要意义.
紫外-可见吸收光谱和三维荧光光谱(3DEEMs,three-dimensional excitation-emission matrix fluorescence spectroscopy)技术因其高灵敏的特点已成为研究CDOM 组成及来源特征的重要手段[8].尤其是3DEEMs 结合平行因子分析(PARAFAC,parallel factor analysis)方法能有效揭示CDOM 荧光团信息,被广泛应用到地球表面各类水体解析CDOM 的组成及来源[9-11].例如,Bai 等[12]利用3DEEMs-PARAFAC分析得到黄海南部海域内有3 种腐殖质和1 种蛋白质;俞晓琴等[13]使用PARAFAC 解析出青海湖流域CDOM 有4 种荧光组分,河流中的CDOM 腐殖化程度高于湖泊;Liu 等[14]使用PARAFAC 解析了新安江水库的CDOM 荧光组分,并结合水质参数用于水库的水质监测;刘堰杨等[15]使用3DEEMs-PARAFAC分析得到高原河流中CDOM 主要有2 种类腐殖质和1 种类色氨酸.
已有研究[16]表明,水文条件(如洪水期和干旱期)和人类活动(如大坝建设)强烈地改变了许多河流和湖泊原有的水文模式,产生季节性或永久性的水文隔离现象.受水文条件影响的水文隔离有助于形成季节性的隔离子湖泊[17].这些子湖泊虽然表面积小、水期短,但具有较高的生物多样性和重要的生态功能[18-19].鉴于CDOM 在水生态系统中的重要性,探究水文隔离对大型淡水湖泊水体CDOM 组成变化的影响具有重要意义.鄱阳湖是中国最大的淡水湖泊,水位变化受入湖河流和长江来水的双重影响,形成“丰水一片、枯水一线”的自然景观[20].在枯水期,随着水位的下降,鄱阳湖形成许多碟形湖;这些碟形湖在丰水期会融入主湖,在枯水期又与主湖隔离[21-22].水情动态变化的鄱阳湖为研究水文隔离对大型淡水湖泊水体CDOM 组成变化的影响提供理想的研究环境.近年来,随着人口增长和工农业生产导致污染加剧,严重影响到鄱阳湖湖区范围居民生产和生活[23].因此,在鄱阳湖开展对水环境污染和富营养化状况具有指示作用的CDOM 组成和来源研究[9,24],对保护鄱阳湖湿地水生生态安全具有重要意义.当前对鄱阳湖CDOM 荧光组成特征的研究仅单一聚焦于湖区通江水域(通江水域是指低水位时与长江连通的湖区[25])或碟形湖湿地[26-27].例如,刘丽贞等[26]使用PARAFAC模型解析鄱阳湖通江湖泊水域CDOM 的荧光组分,并探讨各荧光组分与氮磷营养盐的关系;简正军等[27]利用PARAFAC 模型解析出春季鄱阳湖湿地水体CDOM 有2 种类腐殖质和1 种类色氨酸.但有关碟形湖和通江水域CDOM 组成变化的差异仍需系统研究和比较.基于此,本研究于2021 年11-12 月在鄱阳湖碟形湖和通江水域采集26 个样点的水样,运用紫外-可见吸收光谱与三维荧光光谱,结合平行因子分析法研究鄱阳湖碟形湖和通江水域CDOM 组成及来源的差异,为增强水文隔离对鄱阳湖CDOM 分布规律和组成特征影响的理解提供有价值的信息,以期进一步揭示鄱阳湖CDOM 的环境行为特性以及加强对鄱阳湖湿地碳循环过程的认识.
1 材料与方法
1.1 研究区及样品采集
鄱阳湖是长江流域范围的典型通江湖泊,是中国面积最大的淡水湖泊和国际重要湿地,位于江西省北部(见图1).上承赣江、抚河、信江、饶河与修水等五河来水,经过调节和储存,从湖口流入长江[28-29].湖区地势南高北低,以松门山为界,南部湖泊湖面辽阔,水深较浅;北部湖面狭窄,水深较深,属于通江水道区[30].鄱阳湖受入湖河流和长江来水的双重影响,水位季节性波动显著[31].特别是近年来,受江湖关系变化、地形条件及流域降雨等多种因素的影响[32],鄱阳湖水位变化较大,丰水期水位持续偏低,枯水期提前并延长,湖区内季节性洼地提前裸露[33].碟形湖是指鄱阳湖湖盆区内枯水期季节显现于洲滩之中的碟形洼地,是季节性呈现的子湖泊[18].在丰水期,碟形湖融入主湖,鄱阳湖呈现大湖特征;在枯水期,碟形湖成为孤立的水域,与主湖区隔离,形成湖中湖的自然景观[18,34].通江水域是指低水位时与长江连通的湖区[25].为了对比分析碟形湖和通江水域CDOM 组成的变化规律,同时考虑样点代表性和水样采集便利等因素,在碟形湖和通江水域共布设26 个采样点,碟形湖10个采样点(S1-沙湖、S2-朱市湖、S3-大湖池、S4-大湖池、S5-昌邑附近碟形湖、S6-常湖、S7-白沙湖、S8-东湖、S9-金溪湖、S10-晚湖);通江水域16 个采样点(S11~S26) (见图1).

图1 研究区及采样点示意Fig.1 Location of study area and sampling sites
本研究于2021 年11-12 月(枯水期)进行野外采样.在每个采样点采集0~50 cm 的表层水样,取250 mL 储存在棕色瓶中用于溶解性有机碳(DOC,dissolved organic carbon)与CDOM 检测.共采集26个点位水样,将所有装有水样的采样瓶放在装有冰块的避光冷藏箱内保存,当天运回实验室进行处理.采样点使用手持式GPS (GPSmap 62sc,美国Garmin 公司)进行定位.
1.2 水样预处理
采集的250 mL 水样使用经马弗炉450 °C 灼烧4 h 的Whatman GF/F 玻璃纤维滤膜(0.7 μm)在过滤器中过滤,将过滤液储存于30 mL 的棕色瓶中,放入冰箱4 °C 冷藏待测DOC 浓度.然后再利用0.22 μm的Millipore 滤膜过滤上述经Whatman GF/F 玻璃纤维滤膜(0.7 μm)过滤后的水样,取过滤液储存于60 mL 的棕色瓶中,放入冰箱4 °C 冷藏待测CDOM紫外-可见吸收光谱和三维荧光光谱.
1.3 DOC 浓度和CDOM 紫外-可见吸收光谱测定
DOC 浓度使用TOC-L 总有机碳分析仪(TOC-L CPN,日本岛津公司)通过680 °C 高温催化氧化燃烧法进行分析测定[35].
采用紫外-可见分光光度计(UV-2600,日本岛津公司)测定波长范围为240~750 nm (间隔为1 nm)的CDOM 紫外-可见吸收光谱,以Milli-Q 超纯水作空白对照.根据式(1)(2)计算得出CDOM 的吸收系数[36]:
式中:a′(λ)和a(λ)分别为波长λ的未校正CDOM 吸收系数和经过散射校正的吸收系数,m-1;λ为波长,nm;D(λ)为仪器测量在波长λ处的吸光度;r为比色皿的光程长度,取值为0.1 m.在本研究中,使用a(355)来表征CDOM 浓度.
E2/E3是波长在250 nm 和365 nm 处吸收系数的比值,E2/E3值越小,CDOM 的相对分子量越大[37].比吸收系数SUVA254是指CDOM 在254 nm 波长处吸收系数a(254)与样点DOC 浓度的比值,用来表征CDOM 的腐殖化程度[38-39].
CDOM 的光谱斜率利用指数函数根据式(3)[36,40]计算得出:
式中:a(λ0)为参照波长λ0在440 nm 处的吸收系数,即a(440);S为光谱斜率.本文选用275~295 nm 波段得到S275-295值.
1.4 CDOM 三维荧光光谱及平行因子分析
采用荧光分光光度计(RF-6 000,日本岛津公司)测定CDOM 三维荧光光谱,设定激发波长(λEx,Excitation wavelength)为200~450 nm (间隔5 nm),发射波长(λEm,Emission wavelength)为250~600 nm(间隔1 nm),扫描速度为2 000 nm/min,激发及发射光的狭缝宽度均为5 nm.以超纯水Milli-Q 作空白对照,将样品的三维荧光光谱数据扣除超纯水数据以修正拉曼散射的影响,样品的荧光强度归一化到λEx=350 nm 下的拉曼峰进行拉曼单位校正(R.U.,Raman Unit)[41].在MATLAB 2022a 中使用drEEM 工具箱(ver 0.6.5)对三维荧光光谱数据进行PARAFAC 分析,最终结果通过对半检验(split-half analysis)、随机初始化分析(random initialization analysis)及残差分析(residual analysis)来确定解析组分的可靠性.使用模型输出的最大荧光强度值(Fmax)表征各样品对应的各荧光组分强度[42].利用每个荧光组分的Fmax计算各组分在每个采样点的相对贡献率[27].
荧光指数(FI,fluorescence index)是 指λEx为370 nm 时,λEm在450 nm 和500 nm 处荧光强度的比值,常用来表征水体CDOM 的来源[43-44].腐殖化指数(HIX,humification index)指λEx为255 nm 的情况下,λEm在435~480 nm 和300~345 nm 范围的对应荧光强度比,可以表征CDOM 腐殖化程度,其值越大,腐殖化程度越高[45-46].
1.5 数据分析
运用Matlab R2022a 软件中的drEEM 工具箱(ver 0.6.5)处理CDOM 三维荧光光谱数据并进行平行因子分析;利用IBM SPSS Statistics 26 进行单因素方差分析和独立样本t检验分析变量间的显著差异性;使用OriginPro 2021 软件进行制图.显著性水平分为不显著(p˃0.05)和显著(p≤0.05)2 种.
2 结果与讨论
2.1 碟形湖和通江水域DOC 浓度及CDOM 吸收光谱特征
所有样点DOC 浓度的平均值为(3.48±1.21) mg/L,范围为2.40~6.16 mg/L.所有样点CDOM 在355 nm处的吸收系数〔a(355)〕范围为1.82~6.18 m-1,平均值为(2.90±1.32) m-1.碟形湖与通江水域DOC 浓度和CDOM浓度存在明显差异.碟形湖DOC 浓度〔(4.83±0.89)mg/L〕显著高于通江水域〔(2.63±0.15) mg/L〕(p<0.001);通江水域a(355)的平均值〔(2.01±0.14) m-1〕显著低于碟形湖〔(4.34±1.08) m-1〕(p<0.001).这些结果证实在碟形湖中观测的DOC 和CDOM 浓度都显著高于通江水域,表明受水文隔离影响的碟形湖水体中存在更丰富的有机物.类似地,Yu 等[19]调查了美国皮埃蒙特地区40 个季节性子湖泊的DOC 浓度,结果表明地表水文连通和湖泊周围土地利用是影响DOC 变化的主要因素,孤立湖泊的DOC 浓度高于连通湖泊.Lynch 等[47]研究发现,在河流水系中断开连通的小湖DOC 浓度(9.90 mg/L)高于附近主干河流(2.70~4.27 mg/L).碟形湖是鄱阳湖湿地中植物生物量、物种丰富的区域,也是鄱阳湖越冬候鸟重要的栖息地和觅食地[18],因此,水生植物的凋亡和越冬鸟类的活动可能是导致碟形湖DOC 浓度较高的原因.
根据CDOM 吸收光谱,将CDOM 吸收系数进行参数化表达,计算得出E2/E3、SUVA254和光谱斜率等特征指标(见表1).总体上E2/E3范围为5.69~7.45,平均 值为6.44±0.44;SUVA254平均值为(4.22±0.42)L/(mg·m),范围为3.57~5.51 L/(mg·m);S275-295的最小值为0.016 1 nm-1,最大值为0.018 7 nm-1,平均值为(0.017 4±0.000 6) nm-1.在不同湖区,碟形湖E2/E3的平均值(6.27±0.48)低于通江水域(6.55±0.38);碟形湖SUVA254的平均值〔(4.54±0.48) L/(mg·m)〕显著高于通江水域〔(4.02±0.21) L/(mg·m)〕,且差异显著(p=0.001).这些参数将为分析CDOM 的组成和来源提供参考.
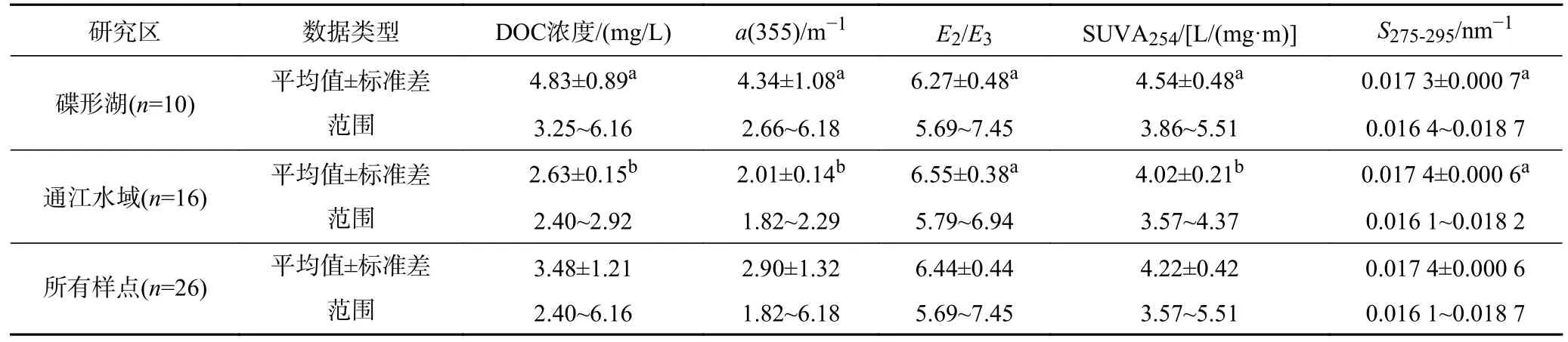
表1 碟形湖、通江水域DOC 浓度和CDOM 吸收光谱特征参数Table 1 DOC and CDOM absorption parameters of water samples collected in the sub-lakes and main lake
2.2 CDOM 荧光组分特征
基于PARAFAC 模型对鄱阳湖碟形湖和通江水域CDOM 的三维荧光光谱进行分析,得到3 种荧光组分(见图2、表2).组分C1 在最大发射波长464 nm处有2 个最大激发波长,分别为275 nm 和350 nm,对应类腐殖质荧光峰A 峰和C 峰;该组分类似于其他研究报告中观察到的类腐殖质[48],其激发和发射特征与由高分子量芳香族化合物组成的有机质有关[43].通常认为组分C1 具有陆源特征,如来自土壤、湿地和森林溪流的溶解性有机质输入来源[49].组分C2 在最大发射波长400 nm 处有2 个最大激发波长235 nm和310 nm,与UVA 类腐殖质荧光组分(λEx/λEm=<250 nm,290~325 nm/370~430 nm)相似[50-51],该组分通常出现在与生物活动相关的海洋环境中,但在湿地、农业和废水环境中也有报道[51];与刘兆冰等[7]研究中UVC类腐殖质荧光组分(λEx/λEm=230~233 nm,280~320 nm/340~420 nm)相似,在森林与湿地环境中较常见;同时与简正军等[27]在春季鄱阳湖湿地水体中报道的类腐殖质荧光组分(λEx/λEm=240 nm,315 nm/403 nm)相似;这些相似的荧光组分被证实具有陆源指示意义[50-51].组分C3 在最大发射波长324 nm 处有2 个最大激发波长,分别为225 nm 和280 nm,与传统的T峰(λEx/λEm=230~235 nm,270~280 nm/320~360 nm)的光学特性相似[52],类似于其他研究报告中观察到的类色氨酸荧光组分[53-54],被认为是陆地植物或土壤有机质降解过程生成的蛋白质成分[50,55].

表2 水体CDOM 荧光组分特征Table 2 Characteristics of CDOM fluorescent components

图2 基于平行因子分析法的荧光组分Fig.2 Fluorescent components identified by PARAFAC method
2.3 碟形湖和通江水域CDOM 荧光组分分布特征
解析出荧光组分之后,根据各荧光组分最大荧光强度值(Fmax)计算出鄱阳湖每个样点中各组分荧光相对贡献率(见图3),得到CDOM 类腐殖质C1 占总荧光组分的26.28%;类腐殖质C2 占总荧光组分的38.28%;蛋白质C3 占总荧光组分的35.44%.从各荧光组分占总荧光组分的比例来看,类腐殖质组分(C1+C2)占绝对优势,碟形湖和通江水域的类腐殖质组分(C1+C2)占总荧光强度的比例分别为71.96%和59.93%,表明碟形湖和通江水域中CDOM 成分以腐殖质物质为主.碟形湖和通江水域的蛋白质荧光组分(C3)占总荧光强度的比例分别为28.04%和40.07%,表明通江水域中CDOM 的类蛋白物质比例高于碟形湖.此外,在碟形湖中,S6(常湖)、S7(白沙湖)和S8(东湖)采样点的类腐殖质组分(C1+C2)相对贡献率相对较大,这可能因为S6~S8 采样点位于鄱阳湖南矶湿地国家自然保护区的浅水子湖中,周围有丰富的维管植物[57],CDOM 受到陆源维管植被的影响.碟形湖采样点S9(金溪湖)的蛋白质组分C3 占总荧光组分比例相对较大,这可能与生产生活中排放的污水和废水有关,使水体中类蛋白组分信号较强.该采样点位于抚河的入湖口附近,据相关研究发现枯水期抚河的荧光类物质主要是由上游抚州市排放的陆源物质与生活污水所决定[58],表明金溪湖受人类活动的影响较大.
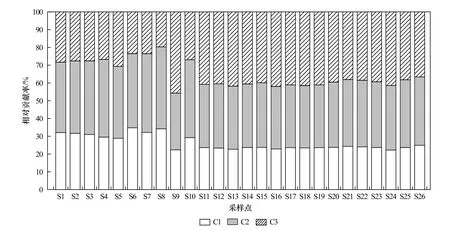
图3 碟形湖和通江水域水体荧光组分相对贡献率Fig.3 Relative contribution rate of fluorescent components in the water of the sub-lakes and main lake
鄱阳湖碟形湖和通江水域CDOM 的荧光成分如图4 所示.在碟形湖中,组分C1、C2 和C3 最大荧光强度(Fmax)平均值分别为(0.247±0.058)(0.333±0.070)和(0.223±0.053) R.U.,而通江水域分别为(0.112±0.006)(0.173±0.010)和(0.190±0.014) R.U..可以看出,鄱阳湖CDOM 荧光组分C1~C3 最大荧光强度值(Fmax)的平均值均表现为碟形湖高于通江水域.通过差异显著性检验得出:在组分C1 和C2 中,碟形湖与通江水域存在显著性差异(p<0.001);在组分C3 中,碟形湖与通江水域不存在显著性差异(p˃0.05).

图4 碟形湖和通江水域3 个荧光组分强度Fig.4 Fluorescence intensity of CDOM in the sub-lakes and main lake
2.4 水文隔离影响下碟形湖和通江水域CDOM 来源解析
鄱阳湖是典型的通江湖泊,地形特征复杂[22].近年来,鄱阳湖受气候变化和人类活动(如三峡大坝建设)等诸多因素的影响[59],枯水期提前并延长,湖区内季节性洼地提前裸露[33].历史同期低枯水位屡创新低,对鄱阳湖生态安全构成威胁[60].此外,毛玉婷等[61]研究显示,鄱阳湖枯水期水质处于富营养化水平;温春云等[62]研究发现,鄱阳湖枯水期水质较差.因此,在水文隔离程度较高的鄱阳湖枯水期开展对水环境污染和富营养化状况具有指示作用的CDOM 来源研究[9,24],对保护鄱阳湖湿地水生生态安全具有重要意义.
有关研究表明水体中CDOM 的来源主要有外源和内源两个部分,外源包括流域内地表河流输入[1]、降水输入[63]、地下水输入[64]以及人类活动造成的农业面源、工业及生活污水等点源输入[65-66];内源主要包括藻类或水生植物死亡后由微生物降解等输入[67].类腐殖质荧光组分反映农业废水及土壤淋溶有机物荧光特征,能直接反映外源输入的有机物信号强弱[68-69].类蛋白质荧光组分与藻类经微生物降解以及流域与湖泊周边生活污水排放有关[70].在本研究中,类腐殖质组分(C1+C2)占总荧光组分的比例表现为碟形湖高于通江水域(见图3),表明碟形湖CDOM 外源输入的有机物信号强.此外,E2/E3、SUVA254、S275-295等特征参数可以用来追踪CDOM 来源.Peuravuori 等[71]发现随着E2/E3值增加,CDOM 相对分子量逐渐减少.碟形湖和通江水域E2/E3的平均值(分别为6.27±0.48、6.55±0.38)均小于太湖(9.60±1.12)[72],说明碟形湖或通江水域CDOM 相对分子质量高于太湖,这意味着碟形湖或通江水域CDOM 的来源与重富营养化的太湖有所不同.碟形湖E2/E3的平均值小于通江水域(见表1),表明碟形湖CDOM 相对分子量较高.此外,鄱阳湖碟形湖和通江水域E2/E3˃3.5,说明枯水期鄱阳湖有机物中富里酸占比多于胡敏酸[73].Helms 等[74]观察到S275~295值与CDOM 的相对分子量成反比,该值越小,CDOM 相对分子量越大.碟形湖S275~295小于通江水域(见表1),表明通江水域CDOM 相对分子量低于碟形湖.Weishaar 等[38]研究发现,SUVA254值越大,其腐殖化程度越高,陆源输入信号越强.碟形湖SUVA254显著高于通江水域(p≤0.05)(见表1),反映了碟形湖CDOM 腐殖化程度高于通江水域,更多受陆源输入的影响.
除了上述CDOM 紫外-可见吸收光谱特征参数外,荧光指数(FI)也可用于辨析CDOM 的来源,分析其数值大小可得出环境中的CDOM 来自陆生源还是微生物活动源,当FI<1.4 时,CDOM 主要来自陆源;当FI 介于1.4~1.9 之间时,CDOM 呈现外源和内源的特征;当FI˃1.9 时,CDOM 以内源输入为主[43].碟形湖FI 的变化范围为1.33~1.45,平均值为1.39(小于1.4),这表明碟形湖中CDOM 以陆源性有机物输入为主;通江水域FI 的变化范围为1.40~1.46,平均值为1.43,表明通江水域CDOM 受到外源和内源的共同影响,以外源为主.HIX 可以表征水体CDOM 的腐殖化程度,该值越大,CDOM 的腐殖化程度越高[45].Zhang 等[75]提出,当1.5 图5 碟形湖和通江水域CDOM 荧光参数分布Fig.5 Distribution of fluorescence indices of CDOM in the sub-lakes and main lake 通过碟形湖和通江水域CDOM 特征参数的对比分析,得出碟形湖CDOM 相对分子量和腐殖化程度高于通江水域.碟形湖是鄱阳湖湿地中植物生物量丰富的区域[18],植被凋落物在降雨过程中被淋溶出腐殖质成分,进而通过径流与河流输运到碟形湖.由于受水文隔离的影响,碟形湖湿地植被凋落物淋溶出的腐殖质成分难以输入到通江水域;鄱阳湖是典型的河流与湖泊相连的淡水湖泊,通江水域流速大,含氧量高,使CDOM 的生物降解作用更强[16]. a) 碟形湖DOC 和CDOM 显著高于通江水域(p<0.001),表明受水文隔离影响的碟形湖水体中存在更丰富的有机物. b) 鄱阳湖CDOM 类腐殖质荧光组分(C1、C2)和蛋白质荧光组分(C3)的Fmax平均值均表现为碟形湖˃通江水域;碟形湖和通江水域的类腐殖质组分(C1+C2)占总荧光强度的比例分别为71.96%和59.93%,且通江水域CDOM 中蛋白质荧光组分C3 的贡献率高于碟形湖. c) 通过碟形湖和通江水域CDOM 特征参数的对比分析,得出碟形湖CDOM 的相对分子量和腐殖化程度高于通江水域. d) 水文隔离对鄱阳湖CDOM 空间分布及组成变化有显著的影响.
3 结论

