桂林米粉腐败菌分离鉴定及其抑菌剂筛选
严婉嘉,梁韦武,陆佳慧,黄春霞,李 霞,2,董新红,李 静,*
(1.桂林理工大学化学与生物工程学院,广西桂林 541006;2.广西电磁化学功能物质重点实验室,广西桂林 541006)
米粉是广泛流行于我国南方地区的传统主食,因其食用简便、口感爽滑劲道、营养丰富而广受人们欢迎。鲜湿米粉是一种以大米或糙米为原料,经过清洗、浸泡、磨浆、糊化成型及冷却等一系列工序制成的扁宽形或细条形的米制品[1]。
鲜湿米粉水分含量较高,一般为60%~80%,室温下通常只能保存24 h 左右,且当环境温度较高时,微生物生长繁殖速度加快,其储藏期更短[2]。由于制作米粉原料、辅料的不同和仪器设备的不同,导致制作出来的鲜湿米粉的质量良莠不齐[3]。研究表明原料大米的品种、陈放时间、理化特性及其淀粉凝胶结构特性等因素对鲜湿米粉品质有较大影响[4-8];鲜湿米粉的保鲜技术主要包括保鲜剂处理、酸浸洗丝、微波、水浴或复合处理[9-14]。
鲜湿米粉营养丰富且含水量高,有利于微生物的生长繁殖,而微生物繁殖过程中可产生许多致使食品腐败变质的代谢产物及毒素,是引起米粉腐败变质的主要生物因素[15]。因此深入研究鲜湿米粉的腐败菌及其生产工艺对米粉腐败的影响等问题,或有利于发现鲜湿米粉腐败变质的机理,为鲜湿米粉抑菌剂筛选、品质改善、货架期延长等提供依据。目前关于鲜湿米粉腐败菌方面的研究偏少。前人研究表明,γ-氨基丁酸、抗坏血酸、柠檬酸、乳糖酸和海藻酸钠作为廉价易得、安全性高且无色无味的食品添加剂,能够保持食品本身色香味不被破坏的基础上表现出良好的抗氧化、抗菌抑菌等性能,从而被广泛用于冷鲜肉、菠菜、甜樱桃和水蜜桃等多种食品防腐保鲜研究[16-20],但还未见在米粉上的应用。桂林米粉作为鲜湿米粉的一种,具有较高的营养价值和浓郁的地方特色。因此,本研究以桂林米粉为研究对象,分离鉴定其主要腐败菌并从γ-氨基丁酸、抗坏血酸、柠檬酸、乳糖酸和海藻酸钠这几种食品添加剂中筛选桂林米粉腐败菌的有效抑菌剂,旨在为桂林米粉贮藏保鲜提供一定依据。
1 材料与方法
1.1 材料与仪器
新鲜桂林米粉 桂林三养胶麦生态食疗产业有限责任公司;LB 肉汤培养基、马铃薯葡萄糖琼脂培养基、琼脂粉 青岛海博生物技术有限公司;异丙醇分析纯,天津市富宇精细化工有限公司;巯基乙醇分析纯,上海吉至生化科技有限公司;γ-氨基丁酸、抗坏血酸、乳糖酸 食品级,河北玖宇生物科技有限公司;柠檬酸、海藻酸钠 食品级,上海阿拉丁生化科技股份有限公司;细菌基因组DNA 快速抽提试剂盒、真菌基因组DNA 快速抽提试剂盒、通用引物((ITS1/ITS4)和(27F/1492R))、琼脂糖、0.5×TAE 缓冲液、2X San Taq PCR Mix(含蓝染料) 上海生工生物工程股份有限公司;液氮 桂林鑫宏益气体有限责任公司。
ZHJH-C112C 超净工作台 上海智城分析仪器制造有限公司;BXM-30R 立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;2720 thermal cycler 聚合酶链式反应(Polymerase Chain Reaction,PCR)仪 沐滕实验设备(上海)有限公司;JY5000 电泳仪 北京六一生物科技有限公司;Tanon-1600 全自动凝胶图像分析仪 广州誉维生物科技有限公司;VIS-7220N 可见分光光度计 北京瑞丽分析仪器有限公司。
1.2 实验方法
1.2.1 样品稀释 参考王欢等[21]的方法并略作修改,称取贮存1~3 d 的湿米粉各5 g,在无菌操作环境下置于已灭菌的研钵中,加入45 mL 无菌水充分研磨,制得稀释度为10-1的米粉匀浆。吸取1 mL 上述米粉匀浆于新的已灭菌离心管中并加入9 mL 无菌水,制得稀释度为10-2的米粉匀浆,依此类推进行10 倍梯度稀释制得稀释度为10-3~10-7的米粉匀浆。
1.2.2 腐败菌分离纯化 采用稀释涂布平板法。用移液枪分别移取50 μL 稀释度为10-3~10-7的米粉匀浆于LB 肉汤琼脂培养基和马铃薯葡萄糖琼脂培养基(PDA)上,用涂布器均匀涂开,每个稀释梯度设置3 次平行试验并设置空白对照。涂布完成后,细菌置于37 ℃恒温培养24 h,真菌置于28 ℃恒温培养3~5 d[22]。培养完成后,用接种环挑取形态不同的菌落分别进行划线纯化培养,并将纯化后的菌接种在斜面培养基上保存。
1.2.3 主要腐败菌反证试验 参考陈志瑜[23]的方法并略作修改,从每种菌的斜面培养基上挑取一环置于10 mL 无菌水中制成菌悬液备用。将新鲜买回的鲜湿米粉每袋20 g 分装于透明密封袋中,分装好的鲜湿米粉开袋置于无菌操作台上紫外灭菌30 min。灭菌完成后用1 mL 菌悬液污染无菌鲜湿米粉,以1 mL 无菌水代替菌悬液作空白对照。将密封袋封口并存放于25 ℃恒温箱中,分别在1 d 和2 d 后观察袋中米粉的变化,确定出导致米粉腐败变质的优势菌株。
1.2.4 腐败菌的鉴定
1.2.4.1 常规鉴定 首先用光学显微镜对从桂林米粉中筛选得到的腐败菌进行形态观察,描述其菌落形态,包括大小、颜色、质地及边缘、表面情况等,并对腐败菌进行革兰氏染色和芽孢染色后观察。然后参考《内生菌研究方法》[24]及《常见细菌系统鉴定手册》[25],通过V-P 实验、葡萄糖氧化发酵实验、淀粉水解实验、明胶液化、硝酸盐还原、接触酶实验对主要腐败菌进行生理生化鉴定。结合菌株形态特征及生理生化特征对腐败菌种类进行初步判定。
1.2.4.2 分子生物学鉴定 采用细菌基因组DNA 快速抽提试剂盒对细菌基因组DNA 进行提取。得到模板DNA 后进行PCR 扩增反应,反应体系包括:模板DNA 10 μL,2X SanTaq PCR Mix(含蓝染料)25 μL,引 物 27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')各2 μL,最后用ddH2O 补至50 μL。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,35 个循环;72 ℃终延伸10 min;4 ℃保存。
将扩增完成的PCR 产物进行琼脂糖凝胶电泳,电泳条件为80 V 电压下1.5 h,在凝胶成像仪下获得电泳图。将扩增成功的样品送至生工生物工程(上海)股份有限公司进行基因测序。得到的序列上传至NCBI 数据库中进行Blast 同源性比对,下载相似性较高的菌株序列,使用MEGA 11.0 软件中邻接(Neighbor-Joining,NJ)法构建系统发育树。
1.2.5 抑菌剂离体筛选 参照γ-氨基丁酸、抗坏血酸、柠檬酸、乳糖酸和海藻酸钠五种试剂用于食品保鲜技术的相关研究[26-28],分别配制成浓度均为50 mg/mL 的五种抑菌剂。采用打孔法,以等量无菌生理盐水代替抑菌剂作对照组,考察抑菌剂对桂林米粉主要腐败菌的抑制作用。
确定出有效抑菌剂后,参考夏飞等[29]的方法并略作修改,设置有效抑菌剂浓度梯度为30、60、90、120 和150 mg/mL,每种有效抑菌剂的各浓度分别对20 g 鲜湿桂林米粉作浸泡5 min 后捞出沥干处理。处理后的米粉打成匀浆,分别移取1 mL 匀浆注入150 mL 的LB 液体培养基中,以1 mL 无菌水代替米粉匀浆作空白对照,于37 ℃培养箱摇床培养22 h。培养过程中每隔2 h 取样一次,以不加任何试剂的空白培养基作参比,测定600 nm 处的OD 值来表征米粉中菌群浓度变化,确定有效抑菌剂的最佳浓度。
1.3 数据处理
每组试验重复三次,试验数据采用IBM SPSS Statistics 25 进行分析处理,采用邓肯(DunCan)检验法进行事后多重比较,采用Origin 2023 进行统计及绘图。
2 结果与分析
2.1 主要腐败菌的分离筛选
通过初步的分离筛选,从鲜湿桂林米粉中一共分离纯化出13 种腐败菌,均为细菌,将这些细菌分别命名为MF1、MF2、MF3、MF4、MF5、MF6、MF7、MF8、MF9、MF10、MF11、MF12 和MF13。在桂林米粉贮藏过程中,适宜温度下细菌繁殖速度快,能消耗较多米粉中的营养物质从而成为优势菌,在一定程度上抑制了真菌的生长,与Gram 等[15]得到的结果大致相符。
鲜湿米粉的感官评定指标主要是条形、色泽、气味及口感等,当贮藏环境温度高于20 ℃时米粉老化程度减小,同时会因微生物繁殖引起酸败变质问题[30]。陈志瑜[23]用菌悬液污染无菌米粉并常温贮藏1 d 后根据米粉外观及气味变化确定了引起鲜湿米粉腐败变质的污染菌。祝红等[31]发现在25 ℃下米粉的各项感官指标随时间延长而得分降低且18 h 后米粉呈现变黏、变黄、发臭等明显腐败变质的现象。由此可见感官评定虽易受主观因素与环境影响,但对只考察微生物因素的反证试验而言是较为直观简便的方法。因此本实验将从筛选出的13 种细菌进行反证实验,记录分别接种13 个菌株的米粉放置2 d 后的结果。结果见表1。
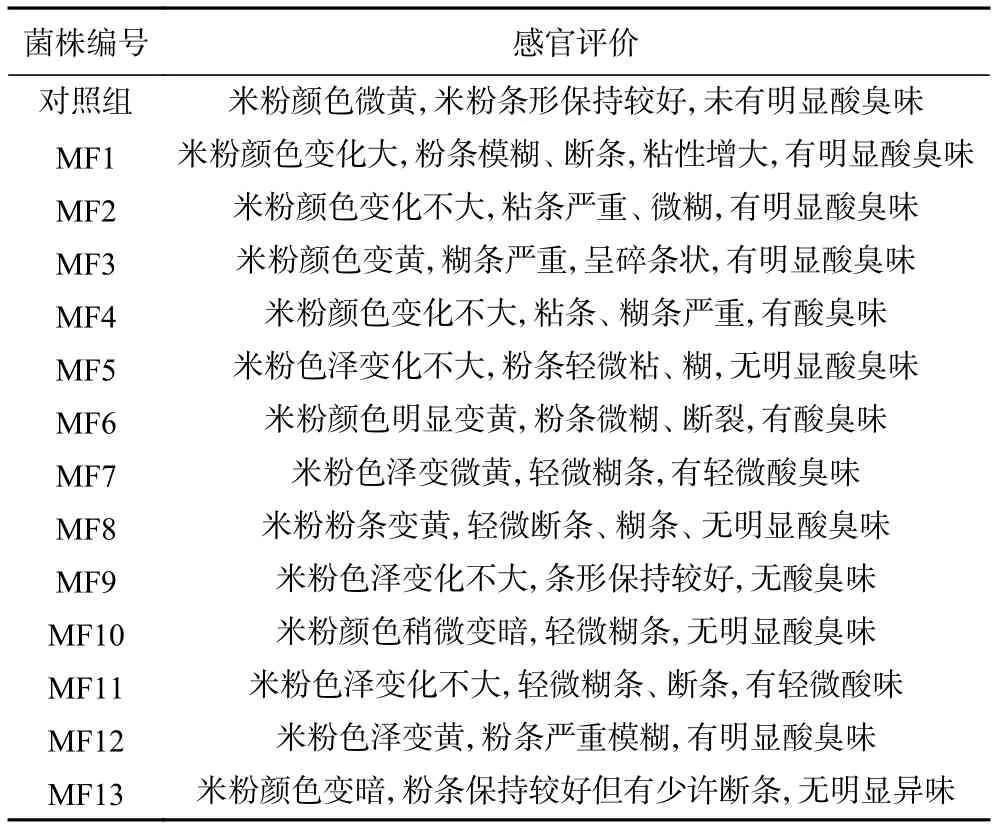
表1 桂林米粉主要腐败菌反证试验结果Table 1 Guilin rice noodles main spoilage bacteria disproof experimental results
由表1 可知,接种MF1、MF2、MF3、MF4、MF6、MF12 鲜湿米粉出现了变色、糊条、粘条的现象,且密封袋中的米粉有产生明显酸臭味,随着时间的增加,米粉的颜色会逐渐加深,米粉糊条、粘条更加严重。相比之下其他组别的米粉变化不明显,因此可以判定MF1、MF2、MF3、MF4、MF6、MF12 是引起桂林米粉变质的主要腐败菌。
2.2 桂林米粉腐败菌鉴定
2.2.1 腐败菌常规鉴定 经反证试验筛选得到的6 株主要腐败菌常规鉴定结果如下所示,菌株形态鉴定结果见表2,生理生化鉴定结果见表3。根据常规鉴定结果,结合《常见细菌系统鉴定手册》[25]可以得出,菌株MF1、MF2、MF3、MF12 为革兰氏阳性菌,产芽孢,产接触酶、明胶酶,初步鉴定为芽孢杆菌属(Bacillus)的细菌;菌株MF4 为革兰氏阴性菌,产接触酶,不产芽孢,不产明胶酶,可发酵葡萄糖产酸产气,初步鉴定为柠檬酸杆菌属(Citrobacter)的细菌;菌株MF6 为革兰氏阳性菌,产接触酶,不产芽孢,不产明胶酶,初步鉴定为微小杆菌属(Exiguobacterium)的细菌。
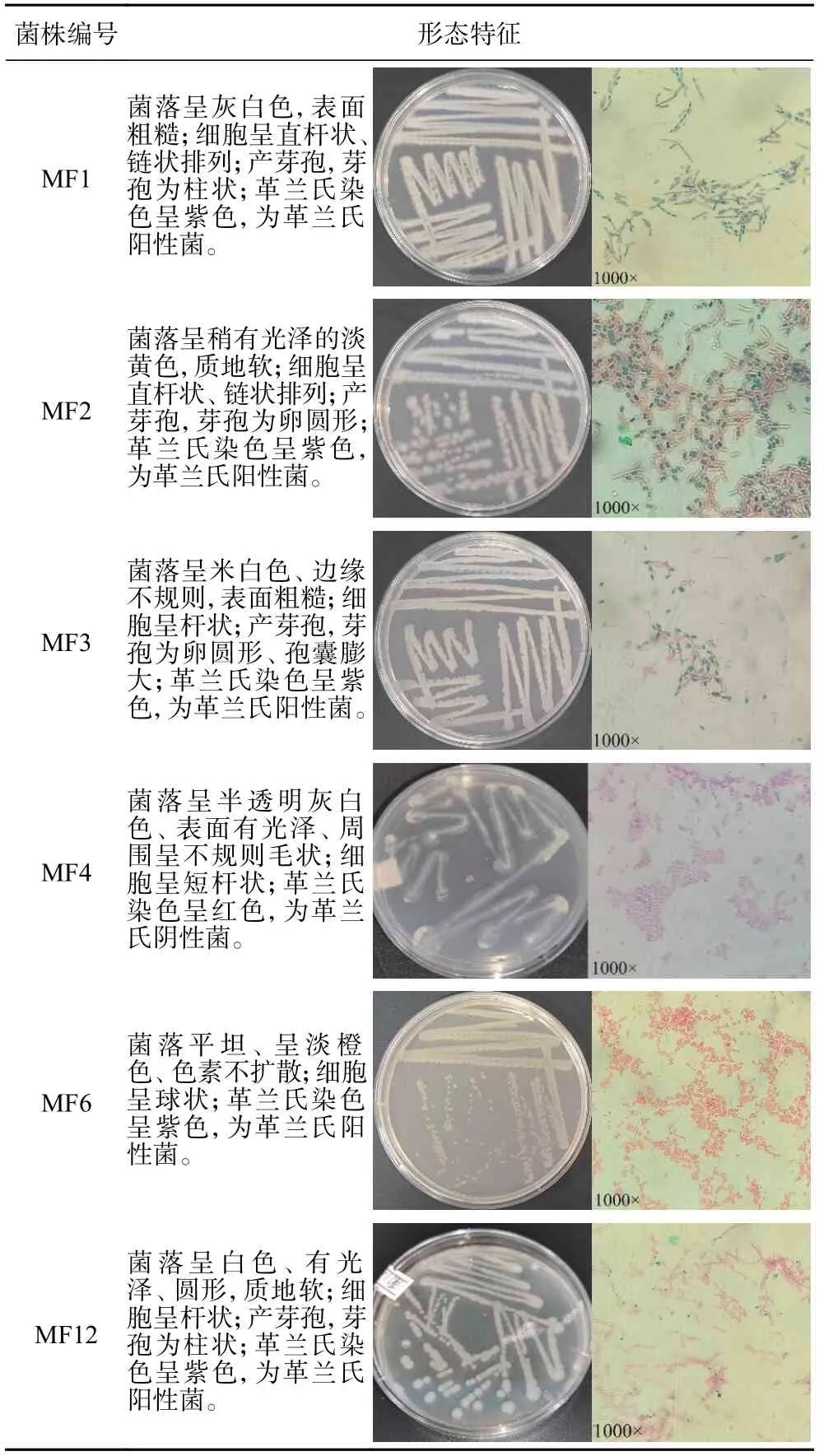
表2 主要腐败菌形态鉴定Table 2 Morphological identification of main spoilage bacteria

表3 主要腐败菌生理生化特性鉴定Table 3 Identification of physiological and biochemical characteristics of main spoilage bacteria
主要腐败菌的致腐性与其生理生化特征有一定关系。有研究表明,贝莱斯芽孢杆菌在生长繁殖过程中会产生乙酸和丁酸等挥发性脂肪酸[32];柠檬酸杆菌属是肠杆菌科中的一种肠道病菌,其发酵产物为混合酸,这些代谢产物均会加速桂林米粉的酸败变质。蜡样芽孢杆菌可利用食品中的糖类及蛋白质,并经代谢产生大量伯醇和酯类物质,还会分解硫和支链氨基酸而使食品产生异味[33]。此外在细菌生长代谢过程中,苏云金芽孢杆菌会产生内毒素,蜡样芽孢杆菌会产生肠毒素,这都是导致桂林米粉变质甚至引起食品安全问题的重要因素[34-35]。
2.2.2 主要腐败菌分子生物学鉴定 对筛选出的6种主要腐败菌进行PCR 扩增并送检,6 株细菌PCR电泳图显示其碱基对均在1500 bp 附近,扩增结果如图1 所示。
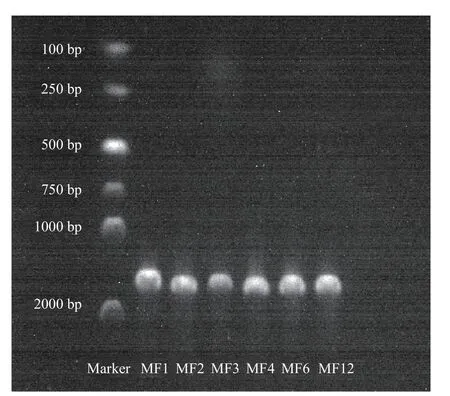
图1 菌株PCR 产物电泳图Fig.1 PCR product electrophoresis map of strain
将测得的基因序列结果经NCBI 网站Blast 比对,在MEGA 11.0 上进行同源性分析及构建系统发育树,见图2。菌株MF1 与苏云金芽孢杆菌(Bacillus thuringiensis)聚于一支,亲缘关系最近;菌株MF2 与蜡样芽孢杆菌(B.cereus)聚于一支,亲缘关系最近;菌株MF3 与贝莱斯芽孢杆菌(B.velezensis)亲缘关系相近;菌株MF4 与柠檬酸杆菌属(Citrobactersp.)聚于一支,亲缘关系最近;菌株MF6 与乙酰微小杆菌(Exiguobacterium acetylicum)聚与一支,亲缘关系最近;菌株MF12 与蜡样芽孢杆菌(B.cereus)聚于一支,亲缘关系最近。
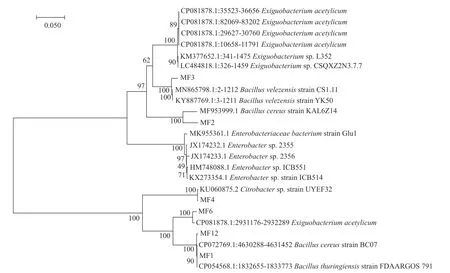
图2 菌株MF1、MF2、MF3、MF4、MF6 及MF12 基于16S rRNA 基因序列构建的系统发育树Fig.2 Phylogenetic tree based on the 16S rRNA gene sequence of strain MF1,MF2,MF3,MF4,MF6 and MF12
综合鉴定结果,最终确定菌株MF1 为苏云金芽孢杆菌(B.thuringiensis),菌株MF2、MF12 为蜡样芽孢杆菌(B.cereus),菌株MF3 为贝莱斯芽孢杆菌(B.velezensis),菌株MF4 为柠檬酸杆菌属(Citrobactersp.),菌株MF6 为乙酰微小杆菌(Exiguobacterium acetylicum)。
2.3 有效抑菌剂及抑菌浓度筛选
采用打孔法得到的抑菌圈结果如图3 所示。其中,编号1~6 分别对应柠檬酸、抗坏血酸、γ-氨基丁酸、海藻酸钠、乳糖酸和无菌生理盐水。从图中可以看出,编号1 和编号2 的抑菌圈较大,且对6 种细菌均有一定的抑制作用,说明柠檬酸和抗坏血酸的抑菌效果较好。因此,可将抗坏血酸和柠檬酸作为桂林米粉腐败菌的有效抑菌剂。
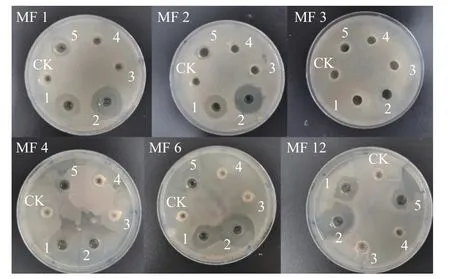
图3 打孔法抑菌圈效果图Fig.3 Punching method bacteriostatic circle effect diagram
进一步研究不同浓度柠檬酸和抗坏血酸对米粉主要腐败菌的抑制作用,结果分别如图4 和图5 所示,由图可见处理组在细菌生长的对数期菌群浓度均有下降。由图4 可以得出,与清水组相比,抗坏血酸浓度为30、60 mg/mL 时,微生物的生长仍然较快。而另外三组浓度较高的抗坏血酸中微生物生长均相对较慢。培养22 h 时,90 mg/mL 的抗坏血酸处理的米粉中菌体浓度最低,综合考虑,90 mg/mL 为抗坏血酸的最佳抑菌浓度。由图5 可得出,与清水组相比,柠檬酸浓度≤90 mg/mL 时,微生物仍有较快的生长速度,抑菌效果不明显。当柠檬酸浓度达120、150 mg/mL 时,微生物的生长整体呈缓慢趋势,但两者之间无显著性差异(P>0.05)。考虑经济成本与绿色环保因素,确定柠檬酸的最佳抑菌浓度为120 mg/mL。
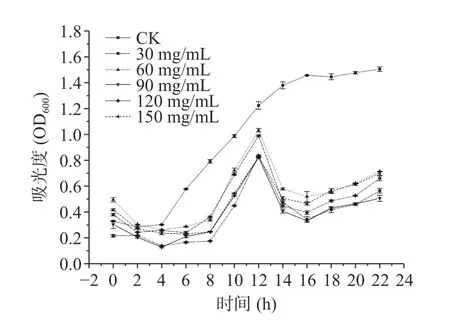
图4 抗坏血酸处理对腐败菌浓度的影响Fig.4 Effect of ascorbic acid treatment on the concentration of spoilage bacteria
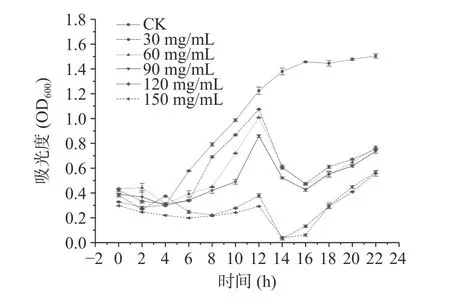
图5 柠檬酸处理对腐败菌浓度的影响Fig.5 Effect of citric acid treatment on the concentration of spoilage bacteria
有研究表明,酸浸可作为鲜湿米粉的有效灭菌方式,工业生产上常用有机酸与弱酸盐复配成缓冲液后用于米粉灭菌处理,且比单一酸浸方式更能保持米粉的蒸煮品质[36]。此外,酸浸灭菌较热力、微波等灭菌方式更简单易行且更节省时间及能耗,故实际生产上常将酸浸与其他灭菌处理相结合以达到经济环保的目的。邹仙果等[37]研究发现酸浸与蒸煮相结合可使鲜米粉货架期延长一倍,卫攀杰等[38]对比了鲜湿米粉不同灭菌处理的品质变化,发现酸浸与水浴相结合处理米粉可促进淀粉糊化,增强其凝胶结构从而改善米粉品质。本实验基于微生物层面为开发桂林米粉保鲜剂及高效保鲜方式提供一定数据支撑,后续尚可从酸处理时间及方式优化、筛选复配弱酸盐及浓度进行深入研究,以期在高效灭菌的基础上最大限度保持桂林米粉口感和品质。
3 结论
本研究从室温贮藏1~3 d 的桂林米粉中分离纯化得到13 株腐败菌,均为细菌,再通过反证试验确定MF1、MF2、MF3、MF4、MF6 和MF12 为主要腐败菌,这6 株细菌能使桂林米粉在贮藏过程中会出现色泽变黄、断条、粘条、糊条及产生酸臭味等腐败变质现象。通过形态、生理生化等常规鉴定结合分子生物学鉴定,确定这6 株腐败细菌为苏云金芽孢杆菌(B.thuringiensis)、蜡样芽孢杆菌(B.cereus)、贝莱斯芽孢杆菌(B.velezensis)、柠檬酸杆菌属(Citrobactersp.)和乙酰微小杆菌(Exiguobacterium acetylicum)。通过平板培养从五种食品添加剂中筛选有效抑制上述6 种腐败细菌的抑菌剂,发现抗坏血酸和柠檬酸有良好的抑菌效果;进一步通过测定菌密度的方法确定两者的最适抑菌浓度分别为90 和120 mg/mL。结果表明,一定浓度的抗坏血酸和柠檬酸对桂林米粉具有良好的杀菌防腐作用,为两者在桂林米粉贮藏保鲜上的应用提供了一定的参考。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

