拮抗菌防治葡萄采后病害研究进展
张苗苗,张雨晨,杨怡中,范盈盈,何伟忠,王 成,黄 伟,刘峰娟,*
(1.新疆农业科学院农业质量标准与检测技术研究所,农业农村部荒漠绿洲生态区特色农产品功能营养与健康重点实验室(部省共建),农业农村部农产品质量安全风险评估实验室(乌鲁木齐),新疆农产品质量安全实验室,新疆乌鲁木齐 830091;2.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;3.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830000)
葡萄是一种木质藤本植物、隶属于葡萄科,具有非常高的营养价值,其富含氨基酸、糖、有机酸、维生素等多种营养元素,受到广大消费者的青睐[1]。中国是全球最大的鲜食葡萄产区,也是大多数地方农业经济中的支柱产业[2-3]。在采摘、储藏和出售过程中,因葡萄水分多、皮薄肉软,含糖量高,极易受到损伤,为病原菌侵染打开通道[4-5],导致灰霉病、青腐病、葡萄曲霉腐烂病等病害发生[6-7],造成葡萄采后减产39%左右,经济价值损失约30%[8]。因此,研究人员开展了大量葡萄采后病害防治的研究,也取得了较好的效果。目前,国内外葡萄贮藏中应用最广泛的化学杀菌剂以二氧化硫及含硫化合物为主[9]。我国从20 世纪90 年代开始大范围使用熏硫技术[10]。王凤超[11]采用200 μL/L 的二氧化硫熏蒸处理无核白葡萄30 min,葡萄未出现漂白损害,且能有效降低果实腐烂率,并能有效控制二氧化硫残留。但熏硫处理也存在极大的隐患,过剩的二氧化硫气体挥发到空气中会引发酸雨、硫酸雾、土壤酸化等环境问题[12],且食用残留亚硫化合物的葡萄更会危害人体健康。因此,葡萄采后保鲜急需更环保安全的方法。近年来,生物防治已成为一项绿色的采后水果保鲜技术,它可以有效地抑制病原菌,不会对环境造成污染[13-14]。由此,本文对葡萄采后侵染性病害及症状、拮抗菌的来源及应用现状、作用机制及联合其他方法结合使用增强生防效果等内容进行综述,阐述了拮抗菌在应用方面存在的问题并提出未来研究中应该考虑的解决措施,以期为拮抗菌在葡萄采后病害控制中的进一步开发与应用提供借鉴。
1 葡萄采后侵染病害种类及发病症状
近年来,葡萄采后侵染性病害的常见病原菌种类繁多,其中包括数十种,如灰葡萄孢菌、黑曲霉、青霉菌、根霉、链格孢霉、拟茎点霉等(表1)。低温条件下优势菌为灰葡萄孢(重要的低温致病菌)、青霉;而常温条件下优势菌为黑曲霉和根霉[15];灰葡萄孢、链格孢和拟茎点霉能引起各种葡萄发生病害,黑曲霉和青霉常见于巨峰和马奶子葡萄[16],根霉腐烂病常见于早中熟葡萄的贮藏。大多数病害初期症状表现为葡萄表皮生长白色菌丝,并伴有水渍状[17-19],一旦发现此症状,提示我们需要采取措施进行控制,如气调、预冷后转入低温环境等。

表1 葡萄采后主要侵染性病害及其症状Table 1 Main postharvest infectious diseases and symptoms of grapes
2 拮抗菌的来源
2.1 拮抗酵母菌
葡萄采后病害拮抗酵母菌大多来自葡萄果实和葡萄园土壤(表2),其中以葡萄果实表面来源居多,葡萄表皮的环境适宜酵母菌生长,一些酵母菌对病原菌具有较好的抑菌能力[26]。从葡萄表面分离得到的解脂亚罗酵母Y-2 对根霉腐烂病有显著抑制作用,腐烂直径比对照降低了23.8%[27]。葡萄园土壤中含有丰富的营养元素,从而为有益微生物提供了良好的繁殖条件,毕赤酵母属是葡萄园土壤中的优势酵母,也是拮抗酵母中的优势菌属[28],对葡萄青霉病有较好的抑菌作用[29]。此外,从其他水果上也筛选到了拮抗酵母,对葡萄采后病害具有明显的拮抗效果,从苹果表面筛到的罗伦隐球酵母能有效抑制葡萄采后灰霉病的自然发病率,抑制率高达90%[30]。
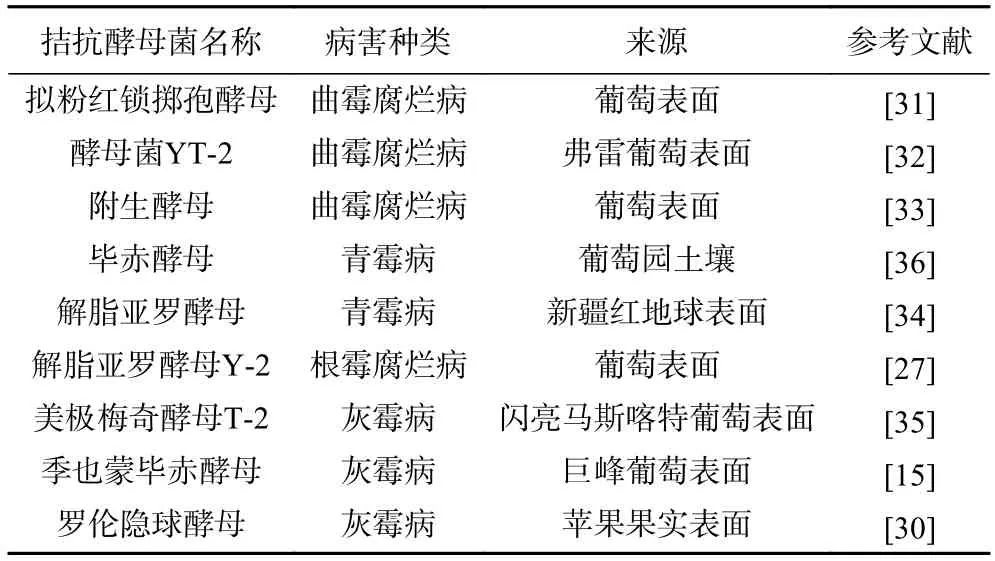
表2 防治葡萄果实采后病害主要的拮抗酵母菌Table 2 Main antagonistic yeast for the prevention and control of postharvest diseases of grape fruits
2.2 拮抗细菌
目前文献中对葡萄灰霉病的拮抗细菌研究较多,来源相对广泛[37],葡萄果实以及与葡萄相关的葡萄植株、叶片及葡萄园土壤环境均有所涉及(表3)。葡萄果皮和叶面附生微生物区系中含有大量的微生物,其中细菌的种类和数量在不同生育期均高于真菌和酵母菌数量[38],而筛选到的拮抗细菌大多数为芽孢杆菌,从葡萄果穗中筛选到了两株拮抗芽孢杆菌B5和B12,对葡萄灰霉病的防治效果均达到了50%以上[39]。葡萄园根际土壤中芽孢杆菌属(Bacillusspp.)是优势细菌属[36],从新疆的葡萄园土壤中分离出了暹罗芽孢杆菌,能有效防治葡萄曲霉腐烂病[40]。此外,从其他植株根系也筛选到了拮抗细菌,在橄榄树根系中分离得到的贝式芽孢杆菌Bvel1 对葡萄灰霉病具有显著的抑制作用,发病率比对照降低了64.77%[41]。

表3 防治葡萄果实采后病害主要的拮抗细菌Table 3 Main antagonist bacteria for the prevention and control of postharvest diseases of grape fruits
3 拮抗菌在葡萄病害防治中的应用效果
3.1 拮抗酵母菌在葡萄病害防治中的应用效果
3.1.1 单一拮抗酵母菌在葡萄病害防治中的应用效果 拮抗酵母在葡萄主要病害防治中应用越来越多(表4),研究表明拮抗酵母对不同品种葡萄的拮抗效果不同,使用浓度为1×108cells/mL 的解脂亚罗酵母Y-2 分别接种处理夏黑、巨峰和红提葡萄,与对照相比,三种葡萄的病斑直径分别降低了28.7%,19.7%和18.5%[27]。对夏黑的自然发病率防治效果更好,夏黑葡萄属于早熟葡萄,说明解脂亚罗酵母Y-2 更适合早熟品种葡萄的采后病害防治。一般来说,酵母浓度越大,生防效果越好。以1×108cells/mL 浓度的拮抗酵母菌YT-2 处理红提葡萄,与对照相比,其对黑曲霉的抑制率高达100%[32],但拟粉红锁掷孢酵母Y16 在不同浓度(1×108cells/mL 和1×109cells/mL)下分别处理鲜食葡萄,1×108cells/mL 浓度下果实腐烂率更低(P<0.05),生防效果更好[46]。可能是浓度越大,酵母所占空间越多,反而不利于酵母的生长。现有文献中拮抗酵母的浓度大多采用1×108cells/mL,因此该浓度是拮抗酵母在葡萄体内防治实验的推荐浓度。
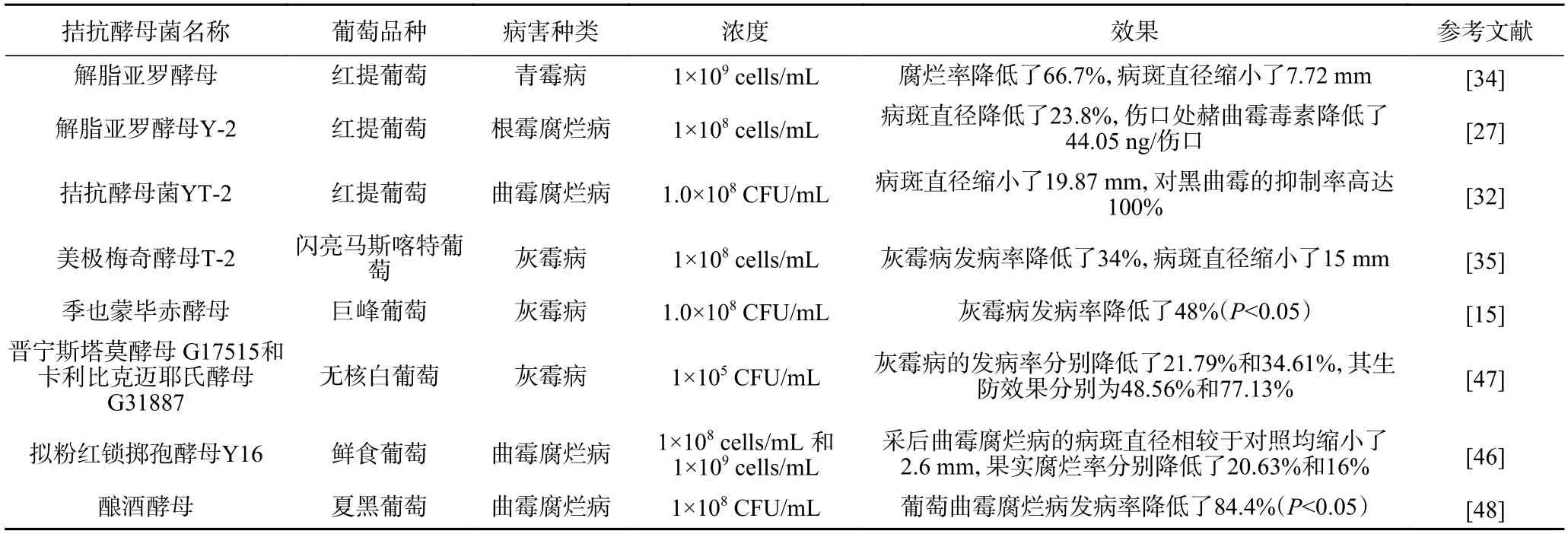
表4 单一拮抗酵母菌在葡萄病害防治中的应用效果Table 4 Application effect of single antagonistic yeast in grape disease control
灰霉病是在低温环境下更容易产生的病害,低温下经卡利比克迈耶氏酵母G31887 处理的葡萄灰霉病腐烂率比常温时降低了24%,表明卡利比克迈耶氏酵母G31887 可以应用于低温环境下葡萄的保鲜[15]。但是单独使用拮抗酵母的生物防治效果不稳定,且无法达到与化学杀菌剂相当的水平。与使用0.1%的富马酸二甲酯相比,单独使用1×108CFU/mL浓度的季也蒙毕赤酵母菌处理葡萄,自然腐败率提高了40%左右(P<0.05),化学防腐剂对酵母和病原菌均有较大抑制作用,拮抗酵母的防腐效力没有得到发挥[15]。研究人员在评估酵母的拮抗效果时,需要将拮抗酵母的浓度、葡萄的品种、贮藏条件等因素设计于实验中,考虑到目前鲜食葡萄采用的技术为冷链低温贮运,为了保证酵母在低温条件下发挥抑菌效果,一方面可以从低温环境中筛选酵母,另一方面可以采用与助剂复配组成制剂的方法提高其生防效力,延长葡萄采后保鲜的贮藏期。
3.1.2 拮抗酵母菌与其他方法联合在葡萄病害防治中的应用效果 单一使用拮抗酵母菌防治葡萄采后腐烂效果通常有限,而化学杀菌剂作为葡萄保鲜最主要的方式,长期使用多菌灵、嘧霉胺、唑菌胺酯+啶酰菌胺等又会使灰葡萄孢产生不同程度的抗性[49]。因此,在寻找新的高效拮抗酵母菌株之际,可以使用组合的方式增强拮抗酵母的生物防治效果[50]。
目前文献中使用化学物质诱导拮抗酵母来提高其抑菌效果的研究较多。使用4 mg/mL 的γ-氨基丁酸(GABA)诱导拟粉红锁掷孢酵母Y16(Sporidiobolus pararoseusY16)24 h 后,对葡萄果实进行处理,曲霉腐烂病发病率比对照降低了36.11%,病斑直径缩小了1.49 mm;采后葡萄在20 ℃贮藏9 d 后,GABA 诱导培养的S.pararoseusY16 的葡萄自然腐烂率为5.56%,显著低于单一酵母处理组的12.5%[31]。说明经GABA 诱导培养的S.pararoseusY16 不仅可以防治曲霉腐烂病也可以防治葡萄采后其他病害。Esa 等[51]研究表明当用1%壳聚糖预处理24 h后,与对照组相比,葡萄青霉病的发病率降低了10%、病斑直径缩小了3.4 mm;在低温和常温下贮藏9 d后,均能够显著提高异常毕赤酵母对于葡萄青霉病的生物防治效果。但有些化学物质却不宜与拮抗酵母配合使用,如添加焦亚硫酸钠和甲基托布津会抑制酵母的生长,抑制率接近100%[15]。因此拮抗酵母只有与它本身不产生有毒作用或者影响较小的物质结合使用,才能达到增效的目的。
3.2 拮抗细菌在葡萄病害防治中的应用效果
3.2.1 单一拮抗细菌在葡萄病害防治中的应用效果目前文献中拮抗细菌对葡萄采后灰霉病的研究较多,葡萄品种以红地球葡萄和玫瑰香葡萄居多(表5)。假单胞杆菌BHG13 菌株对红地球葡萄采后灰霉病的防治效果最好,高达68.59%[52]。而伯克霍尔德氏菌B-1 和洋葱霍尔德氏菌则对玫瑰香葡萄采后灰霉病的抑制效果最好,果梗和果肉的腐烂率分别都下降了69.58%和63.93%[42,54]。同时红地球葡萄和玫瑰香葡萄都属于果皮较厚的品种,表明大多拮抗细菌更适合厚皮葡萄的采后病害防治。当贝式芽孢杆菌Bvel1 的使用浓度为1×108CFU/mL 时,对红地球葡萄采后灰霉病的防治率为64.77%[41],比使用浓度为1×106CFU/mL 高出9%(P<0.05)。随着拮抗细菌浓度的升高,防治效果也随之增强。
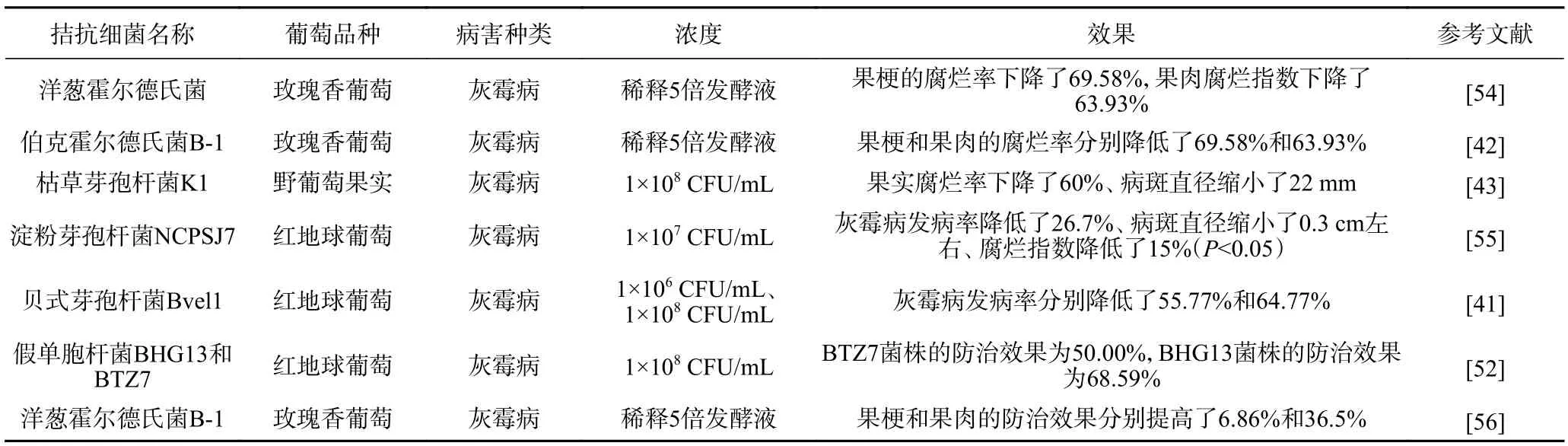
表5 单一拮抗细菌在葡萄病害防治中的应用效果Table 5 Application effect of single antagonistic bacteria in grape disease control
虽然利用拮抗细菌防治葡萄采后灰霉病取得了一定的效果,但在后续实际生产应用仍具有较大的挑战,尤其是制剂加工及其对葡萄采后的抑菌效果。枯草芽孢杆菌BS2 粉剂发酵7 d 后,芽孢杆菌的含量不再变化,保持在1.56×1011个孢子/g,但保存6 个月后含量降低到0.53×1011个孢子/g[53],对葡萄灰霉病防治效果不稳定且在实际生防应用中并不持久。枯草芽孢杆菌B579 粉制剂的有效活菌数为3.0×1011CFU/g,有效期可以达到7.2 个月[38]。说明制剂剂型会显著影响其抗菌效果,在做相关研究时,应该测试不同助剂对拮抗菌剂的影响,既要延长保存时间,又要维持较高的拮抗效果。
3.2.2 拮抗细菌与其他方法联合在葡萄病害防治中的应用效果 针对单一拮抗细菌在抑菌方面的局限性,采用两种及两种以上的拮抗细菌复合处理,可以达到在功能上相互补充,同时防治多种病害,效果持久协同控制的目的[57]。当使用内生荧光假单胞菌CT2 与聚群泛球菌AF2 两菌株联合处理葡萄时,对灰霉病的抑制率最高,发病率降低约93%[58]。离体条件下,菌株GLB191 和GLB197 的发酵原液联合使用处理葡萄,腐烂抑制率比单一处理组分别提高了15.41%和17.98%;在葡萄果实成熟期和采收期,两菌株发酵液联合处理的防效为55.02%和70.20%,与化学药剂的防效相当,药剂组防效为48.57%和71.78%[47]。由此提示可以在采前使用复合拮抗细菌处理葡萄,从而提高葡萄采后抑菌能力。此外,与某些化学物质结合也可提高拮抗细菌对于葡萄采后病害的防治效率,当芽孢杆菌QST713 和普鲁兰芽孢杆菌DSM14940 与杀菌剂氟吡虫啉交替混合使用,对葡萄灰霉病的防治效果可达96%[50]。
盐城地区三麦面积常年稳定在550-600万亩,根据农业区划,分属里下河农业区(含射阳河上游平原区、中部低洼圩区、串场河西平田区和射阳河荡田区四个二级区)、沿海农业区(含射阳河下游平田区、沿海垦区和堤东平田区三个二级区)和徐淮农业区(包含沙土平田区和淤土平田区两个二级区)。
虽然采用拮抗细菌组合的方法防治葡萄采后病害被认为是一种更实际、有效的生物防治策略,但此方法在使用上也存在一定局限性。混合使用的两菌株之间互作关系若是亲和的,则混合使用可以达到增效的目的[59],反之则相反,假单胞菌属、欧文氏菌属、短小杆菌属三种细菌的混合液对黄瓜枯萎病的生防效果较差,是阳性对照药剂的50%左右[60]。因此研究者需要通过体外实验确定拮抗细菌之间无寄生、竞争和溶解互斥关系,并在体内测试中观察到与体外实验一致的结果。
4 拮抗菌防治葡萄采后病害的主要机理
通过对拮抗菌作用机理的深入研究,可为其制定预防药物、使用方法和定向改造策略提供理论基础。在外部环境条件的影响下,拮抗菌、病原菌和寄主三个方面之间的相互作用,形成了多种机制的综合效应,从而导致了每种拮抗菌拮抗效果的产生。Wisniewski 等[61]通过图表展示了这种相互作用的关系。经对比分析,果蔬采后病害生物防治主要采用的拮抗作用机理为:抗生作用、竞争作用、重寄生作用和抗性诱导。
4.1 抗生作用
用于生物防治的众多拮抗菌都能产生抑制病原菌生长的抗生素,而用于采后病害生物防治的拮抗菌主要是以分泌抗菌素的方式发挥作用。Nifokas 等[41]的实验结果表明菌株Bvel1 含有13 个抗菌生物合成基因簇,包括伊藤素A、表面活性素、杆菌素、胆小霉素等,菌株Bvel1 能有效抑制受损葡萄体内灰霉病的侵染和扩散,其在受伤葡萄中表现出足够的定殖效率。Li 等[62]体外实验结果表明,枯草芽孢杆菌K1 能显著抑制灰霉病菌菌丝的生长,抑制率达到78.42%±1.23%。同时基因分析显示,枯草芽孢杆菌K1 染色体含有许多已知的生物合成基因簇,如编码枯草菌素、硅藻烯、芽孢杆菌素和风霉素等。阴沟肠杆菌S6 存在不同的次生代谢产物基因簇,包括芽孢杆菌素、风霉素、表面素和杆菌素,以及非核糖体肽合成酶和细菌素[45],其能够限制病原菌的发展,对灰霉病菌菌丝生长的抑制率达到37%左右,并显著减少与灰葡萄孢属相关的坏死。
红酵母能够分泌抑制霉菌的酵母酸,酵母酸能鳌合铁离子,使病原菌缺少铁元素而死亡。陈莹莹等[63]研究表明灰葡萄孢菌被C4H10O2、C4H8O2和C5H10O2等挥发性物质熏蒸48 h 时,菌丝生长势明显受阻,抑制率高达72.41%,其产孢量始终低于空白组(P<0.05)。李贞景等[64]研究发现6.0 g TD-1 菌株麦麸培养物产生的二甲基异冰片和1,4-二甲基金刚烷等挥发性物质对灰霉孢菌的抑菌率为66.67%,灰霉孢菌的产孢量(3.9×106个/cm2)较空白组(5.9×107个/cm2)显著降低(P<0.01)。张迪[65]检测到异常威克汉姆酵母产生的Styrene 对于葡萄灰霉病菌菌丝有明显抑菌作用,导致灰霉病菌菌丝体的扭曲和畸形。采用双板法检测表明枯草芽孢杆菌K1 的挥发性物质邻苯二甲酸二丁酯显著抑制了灰葡萄球菌的生长,抑制率达到83.32%±1.84%[43]。高全等[66]发现草果挥发油中桉油醇对葡萄灰霉病菌的抑菌活性最显著,EC50值为235.30 mg/L,且活体试验证明,当质量浓度为500 mg/L 时,草果挥发油对葡萄灰霉病的防治效果为76.51%。
4.2 竞争作用
许多酵母菌和类酵母菌都通过相互抵消对方的营养来保护它们免受侵害。酵母菌的一个显著的优势在于它们能够迅速地增加它们的数量,从而获得更多的营养来满足它们的生存需求[67]。拮抗酵母菌可在短时间内快速利用果实皮孔、伤口处的低营养物质,迅速繁殖,最终占领全部生长空间。康萍芝等[68]明确了木霉菌主要是通过快速繁殖与病菌竞争营养和生存空间以及重寄生作用达到抑菌效果,尤其是康氏木霉表现出了很强的竞争优势,抑菌率达61.8%~77.6%。Lucia 等[69]的研究证明对铁的竞争以及形成生物膜和定殖果实伤口的能力是异常威克汉姆酵母(M.pulcherrima)的主要作用机制。当细胞悬浮液浓度为3×108CFU/mL 时,异常威克汉姆酵母对灰霉病菌有显著抑制作用,抑制效果最佳[65]。实验结果表明Y.lipolytica接种于葡萄果实伤口处,在20 ℃或4 ℃中存放4 d 后,该酵母菌能够快速利用葡萄伤口处的营养物质,长时间在伤口处定殖和大量繁殖,保持较高酵母菌数量[34]。有研究发现用芽孢杆菌Bvel1 细胞培养处理受损葡萄果实时,菌落数量迅速增加从1.09 lg CFU/创面增加到2.91 lg CFU/创面,接种4 d 后达到最大种群数为3.50 lg CFU/葡萄,表现出了足够的定殖效率,可有效控制灰霉病在体内的侵入和蔓延[41]。无论是接种还是浸泡处理,荧光假单胞菌都能在葡萄果实上快速生长定殖,消耗营养,抢占生态位点,从而抑制B.cinerea的生长[70]。
4.3 重寄生作用
4.4 抗性诱导
有些拮抗菌可诱导果蔬合成与抗性提高有关的物质。如添加假丝酵母(Candida oleophila)细胞悬浮液的葡萄果皮组织能够更多的合成乙烯,积累苯丙氨酸氨基裂解酶,从而诱导宿主产生抗性[34]。酵母菌诱导寄主提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、多酚氧化酶(PPO)等抗性相关酶类的活性,增强寄主对病虫害、高温的抵抗能力[74]。肖金玮[31]的研究表明在以γ-氨基丁酸(GABA)为激发子诱导培养的S.pararoseusY16 相比S.pararoseusY16 单独处理对葡萄采后黑粉病具有更好的控制效果。Li 等[62]实验表明在接种芽孢杆菌K1 后,葡萄中诱导了更高水平的防御相关酶,包括POD、PPO 和苯丙氨酸解氨酶(PAL)。Qiao 等[46]通过基因水平验证经S.pararoseusY16 处理提高了鲜食葡萄PPO、CAT、PAL 和抗坏血酸过氧化物酶(APX)的活性。经洋葱霍尔德氏菌处理可提高葡萄果实PAL、POD、SOD 和PPO 的活性,促进过氧化氢(H2O2)含量积累,延缓CAT 活性峰值出现的时间[52]。Zhou 等[55]发现淀粉芽孢杆菌NCPSJ7 诱导的GLU 活性(136.04 U/g FW)高于CK 组(128.58 U/g FW),高于单独接种病原菌组(127.18 U/g FW),表明拮抗细菌NCPSJ7 可以诱导果实对病原菌产生抗性。Esa 等[51]发现单用毕赤酵母或用1% w/v 的壳聚糖诱导食用葡萄采后处理,可提高葡萄果实中PPO、POD、PAL、CAT 的活性和总酚的含量。Wu等[35]发现PulcherrimaT-2 处理后显著提高POD、CAT、PAL 等抗氧化酶活性,同时总酚和黄酮类化合物含量及代谢途径关键酶基因的表达水平均有所升高。
5 总结与展望
利用拮抗菌进行生物防治,有望取代传统的化学杀菌剂,成为应对葡萄采后病害的一种绿色环保的方法。尽管目前已经成功地筛选分离出多种有效防治葡萄采后病害的拮抗细菌和酵母,但较难达到与化学保鲜剂相当的防效,在应用方面也存在一些问题:一是研究中大多使用从葡萄生长相关的自然环境中筛选获得的拮抗菌来防治葡萄采后病害,防治效果有限;二是拮抗菌制剂保存条件严格且抗菌活性不稳定;三是拮抗菌与其他方法联合防治时,对拮抗菌耐受物理、化学及生物条件要求较高,加大了测试工作量;四是拮抗菌应用于葡萄时需要考虑其安全性,保障人体健康安全。
随着我国葡萄产业的蓬勃发展,对葡萄采后保鲜技术的深入研究已成为当务之急,尤其是对于环保安全的生物防治技术的探索和研究,更是至关重要。未来对拮抗菌应用于葡萄贮藏保鲜方面的研究应考虑以下几点:a.可从特殊环境(如冰川、沙漠、古树林等)中筛选拮抗菌,一方面其产生的新的代谢产物可能会提高防治效果,另一方面也将提高其联合防治的耐受力;b.开发新型的拮抗菌制剂加工技术,最大程度保留其活性抑菌成分,延长保存期,提高防治效果;c.可将拮抗菌与采后物理技术(如冷库保存、热处理、气调保鲜等)间隔一定时间交替处理葡萄,避免同时处理降低拮抗菌的抗菌活性;d.需要将拮抗菌纳入小鼠急毒性试验,观察是否对其生长存在不利现象,以此确定拮抗菌的安全性,用于后续开发并应用于葡萄采后病害防治。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

