提取温度对乌鱼鱼鳞明胶功能性质和结构特性的影响
黄丽金,闻怡凡,罗美玲,乔娟娟,蒋文丽,谢 欢,舒 圣,方 婷,涂宗财,3,沙小梅,4,*
(1.江西师范大学生命科学学院国家淡水鱼加工技术研发专业中心,江西南昌 330022;2.希而思(长沙)科技研究院有限公司,湖南长沙 410000;3.南昌大学食品科学与资源挖掘全国重点实验室,江西南昌 330047;4.江西德上医药研究院有限公司,江西樟树 331208)
我国水域辽阔,水产资源丰富,是世界第一渔业大国[1]。乌鱼又称乌鳢、黑鱼、生鱼、蛇头鱼等,在我国除西部高原地区外,其他地区均有分布,是中国最重要的商业鱼类之一[2]。乌鱼肉味鲜美、营养丰富,具有较高的经济价值与药用价值。研究表明,乌鱼的平均含肉率为68.24%,高于四大家鱼和鲤、鲫、鲂等鱼种[3]。乌鱼除鲜活销售外,其加工模式主要集中于生鱼肉和冻鱼片。鱼骨、鱼皮、鱼鳞等副产物常作为废弃物,利用率低。如果不妥善处理,不仅会污染环境,还会浪费现有资源[4-5]。
明胶是最受欢迎的生物聚合物之一,因其有良好的凝胶性、起泡性、乳化性和成膜性而被广泛应用于制药、材料、化妆品、摄影和食品等领域[6]。近年来,全球对明胶的需求量一直在增长,世界上约98.5%的明胶是在哺乳动物身上提取出来的[7]。但由于宗教信仰,以及随着疯牛病和口蹄疫在世界范围内的蔓延,寻找哺乳动物的明胶替代物受到了越来越多的关注[8]。鱼鳞由蛋白质、矿物质等组成,蛋白质的量从41%至84%[9],可作为提取明胶的良好材料。
常用的明胶提取方法有热水提取、稀酸提取、酶法提取[10]。热水法提取鱼鳞明胶,对生产要求低,操作简便,对设备要求低,无污染,有利于环境保护。近年关于鱼鳞明胶的报道日益增多,对鱼鳞明胶功能性质和结构特性进行了一些研究,如乳化活性[11]、起泡性[12]、凝胶强度[13]、流变性[14]、分子量分布[15]、二级结构[16]等。有研究报道表明,提高提取温度,胶原蛋白中α链之间结合不稳定,三螺旋结构解旋,不利于凝胶强度,但会有更好的得率、起泡性和乳化活性[10]。迄今为止,未见系统研究温度对乌鱼鱼鳞明胶功能性质和结构特性的报道。本研究采用不同的温度提取乌鱼鱼鳞明胶,并探究温度对鱼鳞明胶得率、功能性质和结构特性的影响,为乌鱼鱼鳞的利用提供一条操作简便、价格低廉的途径,将有利于乌鱼加工副产物的综合利用。
1 材料与方法
1.1 材料与仪器
新鲜乌鱼鱼鳞 江西省南昌市南昌县长胜大市场;盐酸 上海试剂一厂;十二烷基硫酸钠 天津市大茂化学试剂厂;其他所用试剂均属于分析纯或更高的等级。
Bio Tek Synergy H1 全功能酶标仪 美国Bio Tek 仪器有限公司;T25 分散机 德国IKA 公司;LGJ-1 型冷冻干燥机 北京亚泰科隆仪器有限公司;HH-8 数显恒温水浴锅 江苏科析仪器有限公司;TA.XT Plus 质构仪 英国Stable Micro System 公司;Nicolet 5700 傅里叶变换红外光谱仪 美国Thermo 公司;Bio-Rad 型电泳仪 美国Bio-Rad 公司;S-3400N 形扫描电子显微镜 日本株式会社日立高新技术那珂事务所;MCR 302 型剪切应力控制流变仪 奥地利Anton Paar 公司;XS-402 型实验室生物显微镜 南京江南永新光学有限公司。
1.2 实验方法
1.2.1 热水法提取乌鱼鱼鳞明胶 将乌鱼鱼鳞清洗3 遍以去除杂质,再置于组织捣碎机中捣碎5 min,水洗以去除鱼鳞表面的银白色物质。用0.50 mol/L 的盐酸,以1:25(m/v)的料液比进行1 h 的脱钙处理。水洗鱼鳞至pH 为6~7 以去除残留酸液,等份分成五组。将预处理后的鱼鳞,根据料液比1:3(m/v)加去离子水,在60、70、80、90、100 ℃下分别加热2 h提胶,提取得到的鱼鳞明胶溶液pH 为5.00~5.50。抽滤除去鱼鳞残渣,滤液经冷冻干燥后制得鱼鳞明胶,密封保存,备用。
1.2.2 显微镜观察乌鱼鱼鳞表观形貌的变化 分别取脱钙前、脱钙后的鱼鳞以及各个提取温度下的鱼鳞残渣制成临时装片,在光学显微镜下观察鱼鳞表面的纹路及破损情况。
1.2.3 鱼鳞明胶得率 以称重法来计算鱼鳞明胶得率,将脱钙后并去除水分的鱼鳞和冷冻干燥后的鱼鳞明胶进行称重。按以下公式进行计算:
式中:R1表示鱼鳞明胶得率,%;m0表示明胶干质量,g;m1表示脱钙后鱼鳞干质量,g。
1.2.4 乌鱼鱼鳞明胶凝胶强度的测定 根据GIMENEZ 等[17]的方法并适当修改,具体描述如下。在55 ℃水浴锅中利用去离子水溶解明胶制备成66.70 mg/mL 的明胶溶液,置于小烧杯中使得样品直径33 mm、高度22 mm,于4 ℃条件下保存16~18 h后测定凝胶强度。采用TA.XT Plus 质构仪,选择NO-P/0.5R 的平底圆柱形探头,测试速率为1 mm/s,下压高度为4 mm。凝胶强度即为鱼鳞明胶样品被压缩4 mm 所需的最大应力g。
1.2.5 乌鱼鱼鳞明胶温度扫描的测定 根据CHANDRA 等[18]的方法并适当修改,具体描述如下。采用流变仪进行测量,取17 mL 66.70 mg/mL 的明胶溶液置于PP50 圆筒中40 ℃保持3 min,溶液先从40 ℃降温至5 ℃,5 ℃保持30 min,再从5 ℃升温至40 ℃,速率均为0.50 ℃/min,应变力为0.50%,频率为1 Hz。
1.2.6 乌鱼鱼鳞明胶起泡性的测定 运用T25 分散机以13500 r/min 分散20 mL 2 mg/mL 鱼鳞明胶溶液2 min,再将起泡后的溶液倒入50 mL 的量筒中,立即记录总的样品体积,起泡能力计算公式如下:
式中:R2表示起泡能力,%;v0表示分散前的体积,mL;v1表示分散后的体积,mL。
1.2.7 乌鱼鱼鳞明胶乳化活性的测定 根据NAGARAJAN 等[19]的方法并适当修改,具体描述如下。取18 mL 浓度为1%(w/v)的鱼鳞明胶溶液和6 mL大豆油混合,运用T25 分散机以9500 r/min 的速度均匀混合1 min。分散完后立即从烧杯底部取100 μL乳浊液,加入5 mL 0.10%(w/v)十二烷基硫酸钠溶液,混匀10 s 后。立即采用酶标仪在500 nm 波长下测定吸光度(A),计算乳化活性指数,公式如下:
式中:DF 表示稀释系数,50;ρ表示蛋白质量浓度,10000 g/m3;φ表示油占乳浊液的比例,0.25;I 表示溶液高度,m。
1.2.8 SDS-PAGE 的测定 根据LAEMMLI[20]的方法并适当修改,具体描述如下。使用质量分数为5%的浓缩胶和质量分数为7.50%的分离胶。制备5 mg/mL 的鱼鳞明胶样品,沸水浴10 min,取10 μL上清液上样。采用直流恒流电源,电压80 V,电泳时间约2 h。电泳结束后,用考马斯亮蓝R-250 染色30 min,不定时更换脱色液,直至成像清晰,再使用凝胶成像系统对脱色的凝胶进行紫外透射拍照。
1.2.9 FTIR 光谱的测定 根据MUYONGA 等[21]的方法并适当地进行修改,具体描述如下。使用研钵将干燥的鱼鳞明胶样品和光谱级的溴化钾研磨成粉末混合均匀,装入压片模具,抽气加压,压力约为600 kg/cm2,维持3~5 min,得透明样品片。使用红外光谱仪的波数在范围为4000~500 cm-1,数据采集速率为2 cm-1每个点,将获得的数据以吸光度为y 轴,波数为x 轴绘制成图。
1.2.10 SEM 的测定 将66.70 mg/mL 的明胶溶液置于4 ℃冰箱保存16~18 h,取出明胶样品,将不同的样品切成厚度2~3 mm 的薄片,用2.5%(w/v)戊二醛溶液(pH7.2 的磷酸盐缓冲液稀释)固定。将固定好的不同样品切成方块,放入-80 ℃冰箱冷冻。将样品置于样品盘导电胶上,镀金。使用扫描电子显微镜在低真空模式下放大500 倍拍摄鱼鳞明胶的微观结构。
1.3 数据处理
样品做3 次平行实验,结果取平均值,实验数据通过SPSS 软件进行分析,选取Duncan’s test 用于显著性分析,P<0.05 表示差异显著;利用Orign 2019进行绘图。
2 结果与分析
2.1 提取温度对乌鱼鱼鳞表面形貌的影响
脱钙前后乌鱼鱼鳞表面形貌见图1,脱钙前鱼鳞呈粗糙致密状,这是由于鱼鳞表面被羟基磷灰石等无机矿物质所覆盖。经过脱钙处理鱼鳞表面清晰突出规则排列的纹路,这是由于鱼鳞表面钙质被盐酸溶出,暴露出了原有的生物结构,且表面结构变得疏松有利于后续明胶的提取[22]。由鱼鳞表面形貌显微图片可知,鱼鳞在不同的温度下提取,原本规则排列的纹路被破坏,表面出现纵横交错的裂痕。60 ℃提取的鱼鳞跟脱钙后的鱼鳞相比,鱼鳞表面都可以看到清晰的纹理结构,但60 ℃提取的鱼鳞表面小部分有裂痕的出现。随着温度的提升,鱼鳞表面的裂痕进一步加重,规整的条纹结构逐渐破碎呈网状,到100 ℃提取时,鱼鳞表面基本全是裂痕,且裂痕的交错程度更加密集。
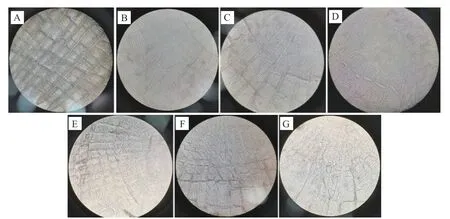
图1 不同提取温度下的乌鱼鱼鳞临时装片(100×)Fig.1 Temporary filleting of mullet scales at different extraction temperatures (100×)
2.2 提取温度对乌鱼鱼鳞明胶得率的影响
明胶得率是制备明胶的一项重要指标。不同温度提取对明胶得率的影响见图2,明胶得率随温度的升高而增加,这与黄雯等[23]采用响应面法得到的结果一致。当提取温度为60 ℃时,明胶得率为31.72%,当提取温度为100 ℃时其得率升至50.97%。这是因为温度的升高提供了更多的能量来破坏结合稳定的胶原结构,使原本规整的三螺旋结构彼此松开,肽链内部的共价键断裂,更有利于明胶的提取[24]。因此随着提取温度的升高,胶原蛋白分子内及分子间的化学键断裂的更多、更彻底,明胶溶出更多,得率升高。
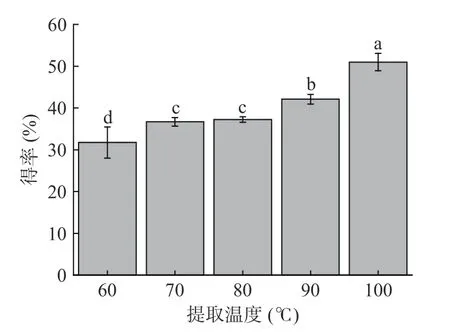
图2 提取温度对乌鱼鱼鳞明胶得率的影响Fig.2 Effect of extraction temperature on yield of mullet scale gelation
2.3 提取温度对乌鱼鱼鳞明胶凝胶强度的影响
凝胶强度是评判鱼鳞明胶品质的一个重要指标,与明胶的类型和提取工艺条件有关[25]。不同提取温度对乌鱼鱼鳞明胶凝胶强度的影响见图3,由图3 可知,提取温度对明胶凝胶强度有显著的影响(P<0.05),随着提取温度的升高,凝胶强度呈现明显的下降趋势。其中,60 ℃提取的鱼鳞明胶凝胶强度最大可达677.82 g,而100 ℃提取的鱼鳞明胶凝胶强度仅为372.91 g。明胶的凝胶强度主要取决于α、β肽链的含量[26]。因此,明胶凝胶强度的减小可能是由于明胶分子中的α和β肽链在加热过程中逐渐降解。明胶分子与水分子发生氢键等非共价相互作用,温度降低后,明胶溶液形成具有一定网状结构的胶凝体。明胶分子链越长,网状结构越坚固,相应的胶凝体凝胶强度更大。在高温下,明胶分子发生降解,分解成更小的短链,导致凝胶内部的作用力减弱,结构变得更为疏松,凝胶强度下降[27]。
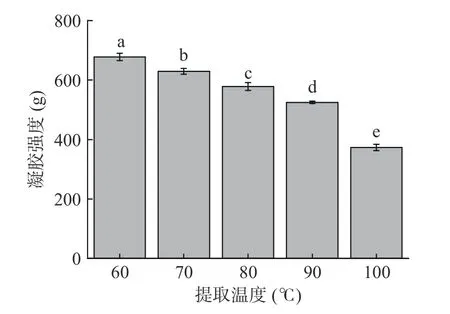
图3 提取温度对乌鱼鱼鳞明胶凝胶强度的影响Fig.3 Effect of extraction temperature on gel strength of mullet scale gelation
2.4 提取温度对乌鱼鱼鳞明胶流变特性的影响
图4 展示了不同提取温度对降温过程和升温过程中鱼鳞明胶的凝胶以及胶融温度的影响,其中储能模量代表的是弹性变化(G'),损耗模量代表的是黏性变化(G'')。图4A~D 表明,不同提取温度的G'及G''都呈现出相同的变化趋势。G'和G''在加热过程中均减小,在冷却过程中均增大。随着温度的降低,G'和G''曲线变得更陡。特别是G'迅速增加,可能是因为液态单链的明胶分子在低温下逐渐转化为有序的三螺旋结构形成凝胶[28]。升温阶段则是降温阶段的逆过程,明胶由固态转化为液态,可以看出鱼明胶有很好的温度可逆性。在图4A~D 中也可以看出G'和G''都随着提取温度的提高而降低,这种变化可能对应于明胶从三股螺旋向单螺旋的转变,三螺旋结构减弱[29]。
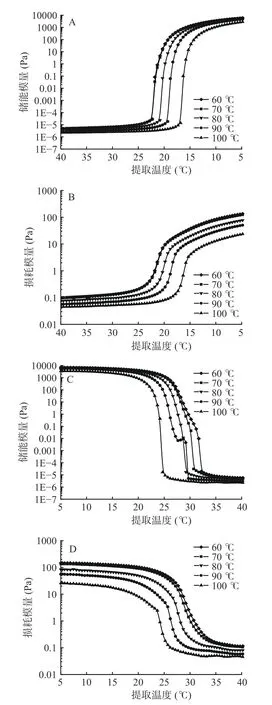
图4 乌鱼鱼鳞明胶从40 ℃冷却至5 ℃的储能模量(A)和损耗模量(B)及从5 ℃加热至40 ℃时的储能模量(C)和损耗模量(D)Fig.4 Storage modulus (A) and loss modulus (B) of mullet scale gelatin upon cooling from 40 ℃ to 5 ℃ and storage modulus (C) and loss modulus (D) of mullet scale gelatin upon heating from 5 ℃ to 40 ℃
此外,在降温和升温曲线中G'和G''的交点被定义为凝胶温度和胶融温度。60~100 ℃提取温度下的凝胶温度分别为20.80、20.70、19.50、18.20、15.80 ℃,胶融温度分别为28.70、28.30、27.30、25.90、23.90 ℃。随着提取温度的升高,明胶的凝胶温度和胶融温度也随之下降且胶融温度大于凝胶温度。这可能是高温使明胶分子形成了更多的短肽,而这些短肽只能在更低的温度下才能形成凝胶。
2.5 提取温度对乌鱼鱼鳞明胶起泡性的影响
泡沫是由分散在液态相中的气态相组成的,常见的形式是空气-水界面,这种界面在热力学上是不稳定的。而在这个界面上扩散、吸附和排列的蛋白质可以作为表面活性剂,蛋白质通过在这个界面形成立体屏障阻止气泡相互接近,并且降低其表面张力使其在动力学上稳定下来[30-31]。如图5 所示,不同温度提取鱼鳞明胶的方式显著地改善了明胶的起泡能力(P<0.05),60、100 ℃提取温度下乌鱼鱼鳞明胶起泡能力分别为23.33%、73.33%,即随着温度的升高,鱼鳞明胶起泡能力呈现增加的趋势。这可能是由于在热力作用下,胶原蛋白之间的化学键和肽键发生断裂,形成的胶原蛋白降解片段因疏水作用在气泡周围形成更稳定的蛋白质膜[32]。除此之外,随着提取温度的升高会导致明胶分子的水解。水解时,疏水基团和可电离基团的释放会加速蛋白质在空气-水界面的扩散和吸附[33]。
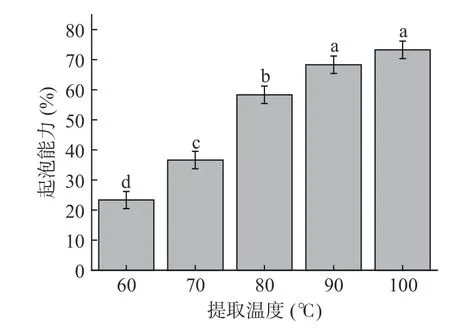
图5 提取温度对乌鱼鱼鳞明胶起泡能力的影响Fig.5 Effect of extraction temperature on the foaming capacity of mullet scale gelation
2.6 提取温度对乌鱼鱼鳞明胶乳化活性的影响
由于蛋白质具有疏水基团和亲水基团以及成膜能力,在油-水界面时,蛋白质可以重新排列,分别将表面疏水基团和亲水基团定位在油相和水相,形成一层粘弹性薄膜,使油均匀分散在水中形成乳状液[34]。根据图6 可知,随着提取温度的上升,鱼鳞明胶的乳化活性指数普遍呈现增加的趋势。这可能是随着提取温度的升高,蛋白质在受热过程中会经历构象的改变,产生大量的肽段,这些肽段能够快速迁移到油-水界面,并迅速吸附在油滴周围,显示出更强的乳化能力[35]。除此之外,温度的升高,胶原蛋白受热水解程度也相应增加,水解可以提高蛋白质的溶解度,暴露隐藏的疏水基团,增加其表面疏水性,从而更好地吸附至油-水界面[36]。
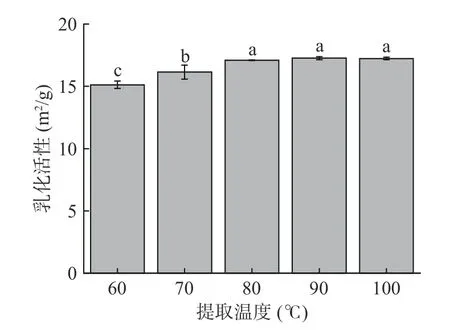
图6 提取温度对乌鱼鱼鳞明胶乳化活性的影响Fig.6 Effect of extraction temperature on the emulsifying activity of mullet scale gelation
2.7 提取温度对乌鱼鱼鳞明胶分子量分布的影响
由图7 可知,所有明胶样品均含三条特征条带,分别是245 kDa 附近的β链,100~135 kDa 之间的α1与α2链。在较低温度下,这三条带十分明显,但随着温度的升高,这三条带逐渐模糊。从80 ℃起,这三条带变得不再清晰,且100 kDa 以下的短肽逐渐增多,可能是较高的温度导致了明胶分子的降解。有研究表明,明胶凝胶强度与其分子量的分布和氨基酸组成有关,一般高分子量的组分所占比例越大,凝胶强度也越强[37]。本文的SDS-PAGE 结果也证明了为何在80 ℃下制备得到的乌鱼鱼鳞明胶凝胶强度会大幅下降。此外,70 ℃的凝胶强度也比60 ℃有所降低,图7 表明,70 ℃的小分子组分有所增加。
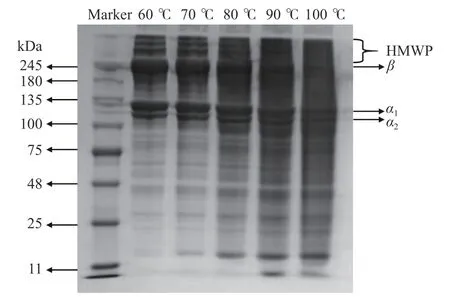
图7 不同提取温度下的乌鱼鱼鳞明胶 SDS-PAGE 电泳图Fig.7 SDS-PAGE electrophoresis pattern of mullet scale gelation at various extraction temperatures
2.8 提取温度对鱼鳞明胶二级结构的影响
由图8 可知,不同温度下提取的乌鱼鱼鳞明胶在4000~500 cm-1范围内的FTIR 光谱均呈现出相似的光谱形状和四个酰胺带吸收峰(酰胺A、酰胺I、酰胺II、和酰胺III)。60、70、80、90、100 ℃提取温度下的乌鱼鱼鳞明胶的酰胺A 带吸收峰波数分别为3436.52、3448.10、3444.24、3434.60、3423.02 cm-1,即整体趋势是波数先升高后降低。酰胺A 带(3500~3400 cm-1)是由N-H 基团的伸缩振动所产生的。当N-H 基团参与氢键时,吸收峰波数会降低,氢键越强,波数越低[38]。随着温度的升高,热力作用会进一步导致明胶分子水解,进一步断裂为更小的分子[39],这可能成为增强氢键的重要原因。
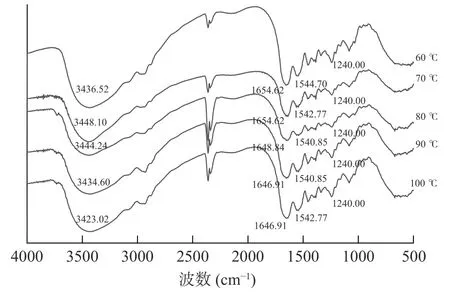
图8 不同提取温度下的乌鱼鱼鳞明胶FTIR 图Fig.8 FTIR spectra of mullet scale gelatin at various extraction temperatures
酰胺I 带出峰位置都在1648.84 cm-1左右,符合酰胺I 带常见频率范围(1700~1600 cm-1),该带主要是由反对称羧基或C=O 振动所引起的,是明胶分子具有二级结构的重要因素。在60、70、80、90、100 ℃提取温度下,乌鱼鱼鳞明胶的酰胺II 带吸收峰波数分别为1544.70、1542.77、1540.85、1540.85、1542.77 cm-1。酰胺II 带(1560~1540 cm-1)主要是由C-N 伸缩和N-H 弯曲振动的耦合[40]。酰胺III 带(1250~1230 cm-1)是酰胺键的CN 伸缩振动和NH变形的组合峰,是由甘氨酸主链和脯氨酸侧链的CH2基团的摆动振动引起的,与胶原蛋白的三螺旋结构完整性有关[41]。60、70、80、90、100 ℃提取温度下的乌鱼鱼鳞明胶的酰胺III 带吸收峰波数均为1240.00 cm-1。
2.9 提取温度对鱼鳞明胶微观结构的影响
图9 展示了乌鱼鱼鳞明胶的微观结构。一般来说,凝胶基质中蛋白质的构象和链长直接影响了明胶的凝胶强度[42]。在60 ℃下提取的明胶,微观结构比较平整,显示出非常小的空隙和最精细的凝胶网络。70 ℃的样品微观结构开始存在一些空隙,蜂窝状的网格更多也更明显,但彼此间并不相连。80 ℃以及更高温度下提取样品的微观结构,发现了较大的空隙,网格也开始变得不清晰、不平整。低温下提取的明胶具有较高分子量的链,可以更大程度地交联,凝胶结构更精细,空隙更小,表明水在精细有序的凝胶基质中均匀分布[43]。随着提取温度的提高,明胶受热降解,分子量逐渐下降,小分子量肽段更容易填充于凝胶网络的孔隙中,形成的网状链更大。因此,这种类型的凝胶无法抵抗施加的力,导致凝胶强度降低。
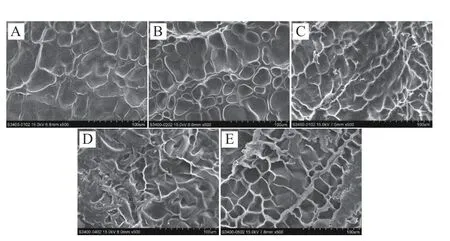
图9 不同提取温度下的乌鱼鱼鳞明胶微观结构图(500×)Fig.9 SEM micrographs of mullet scale gelation at various extraction temperatures (500×)
3 结论
提取温度能显著影响乌鱼鱼鳞明胶的功能性质和结构特性。随着提取温度的升高,明胶的得率、乳化活性以及起泡能力逐渐升高,而其凝胶强度、凝胶温度和胶融温度逐渐下降。当提取温度为100 ℃时,乌鱼鱼鳞明胶得率、乳化活性、起泡能力最好,分别为50.97%、17.27 m2/g、77.33%。但提取温度为60 ℃时,乌鱼鱼鳞明胶的凝胶强度、凝胶温度、胶融温度最佳,分别为677.82 g、20.80 ℃、28.70 ℃。此外,随着提取温度的升高,乌鱼鱼鳞表面的破损程度逐渐扩大,制得的乌鱼鱼鳞明胶α1、α2、β链三条特征带逐渐模糊,红外光谱图均呈现出相似的四个酰胺带吸收峰,酰胺A 带吸收峰波数先升高后降低,扫描电镜图中明胶网络结构的紧密程度降低。高温破坏了明胶分子的结构,尤其是对特征链内共价键的破坏,这直接导致了大量小分子肽的产生,而更高比例的小分子肽也正是造成不同提取温度下明胶功能性质不同的原因。上述实验结果表明,乌鱼鱼鳞是一种很有前途的明胶来源,可根据其应用需求采用特定的提取温度,以提高其市场潜力。本文可为乌鱼鱼鳞的高值化利用提供理论和技术依据,后续可针对乌鱼鱼鳞明胶的实际应用进一步开展研究,以提升其应用价值和产业化进程。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

