保幼激素环氧水解酶基因在蠋蝽滞育过程中的表达模式及其功能研究
王胜男 张茂森 周磊 井晓宇 张洪志 李玉艳 吴惠惠 张礼生

摘要:保幼激素(juvenile hormone,JH)缺乏是引发昆虫生殖滞育的主要原因,保幼激素环氧水解酶(JHEH)作为JH的主要降解酶,通过调控JH滴度水平在昆虫滞育中发挥重要作用。为研究JHEH在蠋蝽生殖滞育中的调控功能,克隆获得了蠋蝽JHEH基因(AcJHEH),该基因编码452个氨基酸,具有典型环氧水解酶结构特征,无跨膜结构域,存在1个信号肽位点。同源性及系统进化分析结果表明,AcJHEH在不同物种间具有较高保守性,与茶翅蝽(Halyomorpha halys)的JHEH相似性较高,达65.46%。利用RT-qPCR 技术测定了AcJHEH在蠋蝽不同组织及滞育不同时期的表达量,发现AcJHEH表达量在滞育诱导期先下降后升高,滞育诱导20 d时表达量最低;滞育初期(诱导 40 d)表达量最高,滞育维持期(诱导50~60 d)的表达量稳定在较高水平,与成虫初羽化时水平接近。AcJHEH在滞育蠋蝽的头部表达量最高,其次是中后肠和脂肪体,在卵巢中表达量最低。利用RNAi敲降蠋蝽初羽化成虫的JHEH基因表达后,雌虫体内的卵黄蛋白原(vitelliogenin,Vg)基因表达量上升,卵黄沉积明显,推测滞育诱导期高表达的JHEH基因可能通过抑制Vg基因的表达,抑制卵黄蛋白沉积和卵巢发育,从而促进蠋蝽的生殖滞育。本研究结果为解析JHEH在生殖滞育中的调控作用提供了参考依据。
关键词:蠋蝽;生殖滞育;保幼激素环氧水解酶;基因表达模式;基因功能
中图分类号:S476.2;S433 文献标志码:A
文章编号:1002-1302(2024)06-0043-09
收稿日期:2023-05-04
基金项目:国家烟草总局重大专项[编号:110202001032(LS-01)];贵州省烟草公司项目(编号:201937、201941)。
作者简介:王胜男(1997—),女,山东泰安人,硕士研究生,研究方向为农业昆虫与害虫防治。E-mail:3221905868@qq.com。
通信作者:吴惠惠,博士,助理研究员,研究方向为农业昆虫与害虫防治,E-mail:wuhuihui@tjau.edu.cn;张礼生,博士,研究员,研究方向为害虫生物防治,E-mail:zhangleesheng@163.com。
蠋蝽(Arma chinensis Fallou)因其具有适应性强、捕食范围广等优点[1-2],在对包括草地贪夜蛾(Spodoptera frugiperda)在内的入侵害虫也有較高的捕食能力,因此在生物防治中具有较高应用价值[1-9]。在蠋蝽的生产应用中,产品足量稳定供应和批量释放是影响其控害效果的关键因素,研究蠋蝽的大量扩繁、储存及释放应用对促进其产业化发展具有重要意义[2,10-16]。自然条件下,部分昆虫为躲避不利环境影响会选择进入一种发育停滞状态,即滞育(diapause)。滞育过程受环境因子、遗传和激素的共同调控,滞育期间常伴随能源物质积累、代谢抑制、抗逆性提高、生殖抑制等生理变化[17-20]。研究明确昆虫的滞育特征及其调控机制,不仅有助于掌握昆虫的环境适应机制、预测种群发生动态,还可通过人为操控有益昆虫的滞育进程延长其贮存和使用寿命,提高天敌的货架期和应用潜力,或可干预害虫的滞育发生控制其危害[18]。笔者所在实验室在前期研究中证实蠋蝽能以成虫形态进行滞育,雌成虫在短光照低温条件下诱导40 d后进入滞育态,滞育率可达90%以上,滞育期平均可维持160 d,部分能达300 d以上[21]。在此基础上深入解析蠋蝽生殖滞育的调控机制,对促进蠋蝽的扩繁应用具有重要应用价值。
保幼激素(juvenile hormone,JH)能使幼虫蜕皮后仍保持幼虫状态,抑制成虫特征的出现,并在成虫期促进卵子成熟,调控昆虫生殖发育的一种倍半萜烯类激素。大量研究表明,JH是控制昆虫滞育的主要调节激素[22-24]。通常生殖滞育的雌虫JH滴度低于正常发育的雌虫,JH缺乏是成虫滞育的主要原因[23,25-26]。保幼激素滴度受合成和代谢共同调控,其中,JH的代谢主要受保幼激素酯酶(juvenile hormone esterase,JHE)、保幼激素环氧化物水解酶(juvenile hormone epoxide hydrolase,JHEH)和保幼激素二醇激酶(juvenile hormone diol kinase,JHDK)的调控[27-31]。JHEH是调控昆虫体内保幼激素滴度的关键酶[30],在昆虫中,JHEH可把JH降解成保幼激素二醇(juvenile hormone diol,JHD),并把保幼激素酸(juvenile hormone acid,JHA)降解为保幼激素酸二醇(juvenile hormone acid diol,JHAD)[22-25]。在异色瓢虫(Harmonia axyridis)及大猿叶甲(Colaphellus bowringi)等昆虫的生殖滞育研究中发现,JHEH基因在滞育期间显著上调,干扰该基因表达,可明显抑制滞育反应,促进卵巢发育及脂肪积累等,证明JHEH基因的高表达对促进滞育,维持滞育表型具有重要作用[28,32-34]。并通过分别干扰JHE、JHEH或JHDK在成虫滞育期间的表达,发现JHEH和JHDK比JHE在调控JH滴度水平中可能发挥更重要的作用[35-39]。
本研究为解析保幼激素环氧水解酶基因JHEH在蠋蝽生殖滞育中的作用及调控机制,首先对克隆的JHEH基因的全长序列进行生物信息学分析,在此基础上,运用实时荧光定量PCR技术测定了JHEH基因在蠋蝽不同组织及滞育不同时期的转录表达水平,明确了JHEH基因在蠋蝽生殖滞育过程中的表达规律。利用RNA干扰技术,对蠋蝽初羽化成虫的JHEH基因进行干扰,并分析了干扰后对蠋蝽Vg基因表达及卵巢发育的影响,为进一步揭示JHEH通过调控JH滴度影响滞育进程的作用机制奠定了基础。
1 材料与方法
1.1 供试昆虫
供试蠋蝽种群来自中国农业科学院植物保护研究所河北省廊坊基地实验室,于2021年7月在北京实验室继代饲养建立稳定种群。正常发育的蠋蝽饲养条件为:温度(27±2) ℃,相对湿度75%,光—暗周期16 h—8 h;滞育诱导下的蠋蝽饲养条件为温度周期15 ℃(光)—5 ℃(暗),相对湿度75%,光—暗周期8 h—16 h。
1.2 试验处理
蠋蝽雌虫作为供试虫源,取非滞育雌虫(NE)、滞育诱导期(诱导10、20、30 d)、滞育初期(诱导 40 d)、滞育维持期(诱导50、60 d)的蠋蝽雌虫整个虫体样品用于RNA的提取。解剖诱导40 d的蠋蝽雌虫的不同组织(头、脂肪体、卵巢、中肠和后肠)样品用于RNA的提取。
1.3 AcJHEH基因克隆及序列分析
1.3.1 引物设计与合成
根据笔者所在实验室已测蠋蝽的转录组数据,鉴定得到AcJHEH基因序列,并设计引物(表1)。
1.3.2 RNA提取、-cDNA、5′/3′-RACE-ready-cDNA的合成
蠋蝽的总RNA提取步骤按照试剂盒(TransZol Up Plus RNA Kit,北京全式金生物技术股份有限公司)说明书进行。使用1.5%琼脂糖凝胶电泳检测RNA完整性,利用北京金沙生物科技有限公司的UnionScript First-strand cDNA Synthesis反转录试剂盒将上述不同样品的 RNA反转录合成第一链cDNA。按照试剂盒(SMARTer RACE 5′/3′Kit,Clontech)说明书,合成5′/3′-RACE-ready-cDNA,置于-80 ℃冰箱保存。
1.3.3 中间片段扩增
以滞育蠋蝽cDNA为模板,利用AcJHEH-F/AcJHEH-R进行中间序列扩增。反应体系(50 μL):上下游引物各2 μL,模板1 μL,PCR Master Mix 25 μL,ddH2O 20 μL轻微振荡混匀。反应程序:98 ℃预变性2 min;98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸15 s,共40个循环;反应完成后对PCR产物进行测序。
1.3.4 5′/3′-RACE PCR
分别以5′-RACE-ready-cDNA和3′-RACE-ready-cDNA为模板,按照试剂盒说明书扩增RACE全长。反应体系(50.0 μL):PCR-Grade H2O 15.5 μL,Buffer 25.0 μL,SeqAmp DNA Polymerase 1.0 μL,混匀后加入2.5 μL模板,10×UPM 5.0 μL,AcJHEH-5′GSP或AcJHEH-3′GSP 1.0 μL。反应程序:94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,69 ℃ 30 s,72 ℃ 3 min,20個循环。将PCR 产物进行回收、连接、转化及测序。
1.3.5 序列拼接与生物信息学分析
利用DNAMAN和EditSeq,对PCR试验中得到的中间序列和5′/3′RACE得到的序列进行拼接,得到AcJHEH基因cDNA全长序列。利用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测氨基酸序列,用NCBI BLAST软件进行序列比对及同源序列搜索;利用MEGA 7.0进行系统进化树构建,用PredictProtein(https://predictprotein.org/)在线分析和ExPASy Protteo tmics Server在线分析进行蛋白二级结构预测;利用在线软件ExPASy-ProtParam tool(https://web.expasy.org/protparam/)进行蛋白分子式预测,用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白跨膜结构的预测,用SignalP 5.0 Server在线分析(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)进行信号肽预测;利用SWISS-MODEL(https://www.swissmodel.expasy.org/)进行蛋白三级结构预测。
1.4 实时荧光定量 PCR(qRT-PCR)
运用Primer Premier 6.0 软件设计qRT-PCR引物,选取蠋蝽AcActin基因作为内参基因,并设计合成引物,见表1;实时荧光定量检测使用 LightCycler 96 Instrument(Roche,瑞士)进行,试剂使用北京全式金生物技术股份有限公司的GS AntiQ qPCR SYBR Green Master Mix试剂盒进行。反应体系(20.0 μL)为:2×GS AntiQ qPCR SYBR Master Mix(1×)10.0 μL,cDNA模板1.0 μL,上、下游引物各 0.8 μL,超纯水 7.4 μL。反应条件为:95 ℃变性 60 s,95 ℃ 20 s,60 ℃ 30 s,共40个循环。
1.5 AcJHEH基因的RNA干扰和干扰后表型观察
根据AcJHEH的cDNA序列,设计并合成带有T7(TAATACGACTCACTATAGGG)启动子序列的特异性引物[表1,由生工生物工程(上海)股份有限公司合成]和dsGFP(基于绿色荧光蛋白基因设计的dsRNA,用于对照试验),以蠋蝽雌成虫cDNA为模板进行PCR 扩增,扩增产物通过琼脂糖凝胶电泳检测纯度后利用胶回收试剂盒(EasyPure Quick Gel Extraction Kit)进行纯化。以1 μg胶回收产物为模板,利用dsRNA合成试剂盒(MEGA scriptRNAi Kit,Thermo Fisher)合成dsAcJHEH和dsGFP,试验步骤和试剂参照Li等的方法[33],将产物进行琼脂糖凝胶电泳检测为单一条带后定量至2 μg/μL。选取初羽化的蠋蝽雌成虫,使用Nano Ject Ⅲ,Drummond Scientific Company注射仪(Drummond,美国)对其注射dsAcJHEH(注射数量为47头),注射部位统一为蠋蝽第二、第三腹节之间的节间膜,注射剂量为3 μg/头,同时注射等量的dsGFP(共47头)作为对照,将注射后的试虫饲养在正常条件下。将注射后的蠋蝽雌虫用于基因沉默效率检测和Vg含量检测,检测时取3组重复,每组雌虫为5~6头,设3次技术重复。取注射后24、48、60、72、96 h的试虫进行qRT-PCR試验,检测其干扰效率,并检测注射后48、60、72 h的Vg含量。分别对未滞育,注射dsGFP、注射dsAcJHEH后4 d的蠋蝽进行解剖,对其卵巢进行拍照。
1.6 数据统计与分析
时空表达试验采用单因素方差分析(One-way ANOVA)对数据进行分析,RNA干扰试验后检测AcJHEH基因沉默效率以及对沉默AcJHEH基因后Vg基因的相对表达量进行t检验和单因素方差分析,并采用Tukeys多重比较法进行显著性分析,数据均为平均值±标准误。
2 结果与分析
2.1 AcJHEH基因序列分析
由图1可知,AcJHEH基因 cDNA 全长 2 109 bp,开放阅读框(ORF)为1 359 bp,编码452个氨基酸,5′非编码区135 bp,3′非编码区616 bp,预测该基因编码蛋白的分子式为C2 402H3 641N597O652S12,预测蛋白的分子量为51.69 866 ku,理论等电点为8.21,带正电荷的氨基酸45个,带负电荷的氨基酸43个,极性氨基酸216个,非极性氨基酸203个。亲水性系数为-0.143(<0),不稳定系数为32.80(<40),是疏水的稳定蛋白。JHEH全长序列包含完整开放阅读框,N端包含1个由18~22 个氨基酸组成的疏水性信号肽序列,第49~161个氨基酸之间存在EHN环氧水解酶超家族结构域,跨膜结构域预测结果表明,该蛋白包含0个跨膜区域和1个信号肽切割位点(图2、图3)。蛋白的螺旋(helix)、折叠(strand)、其他(other)占比分别为37.25%、8.65%和54.10%。以保幼激素环氧水解酶(SMTL ID:4qla.1.A)为模型预测蠋蝽JHEH蛋白的3D结构(图4)为同源JHEH序列,序列相似度约为46.14%。
2.2 构建AcJHEH系统进化树
由图5可知,在NCBI数据库中选取8种不同昆虫的JHEH氨基酸序列,与蠋蝽的JHEH序列进行同源性分析,结果显示相似性达65.46%,JHEH
包含1个HGWP氨基酸序列,该序列在七星瓢虫和其他昆虫的JHEH中高度保守,因此,基序HGWP或许参加了JHEH的催化作用[33-34]。由图6可知,将从数据库中选取的31种同源性较高的物种与蠋蝽JHEH氨基酸序列一起构建进化树,从进化树中可以看出,JHEH氨基酸序列与鞘翅目、双翅目等昆虫的亲缘性较高,其中与茶翅蝽(Halyomorpha halys)(登录号XM_014437801)的亲缘关系最近。
2.3 AcJHEH基因的时序表达分析
由AcJHEH基因在蠋蝽滞育不同时期的表达结果(图7)可知,AcJHEH基因在蠋蝽滞育诱导及滞育
期间均有表达,不同时期间存在极显著差异(F=8.009,df=26,P<0.01)。成虫初羽化时期AcJHEH表达量较高;滞育诱导10 d时表达量极显著降低,滞育诱导20 d时表达量达最低,随后逐渐升高;在滞育初期(诱导40 d)达到峰值,进入滞育维持期(50、60 d)后稳定在较高水平。
蠋蝽滞育初期(诱导40 d)检测AcJHEH基因在雌虫不同组织中的表达量,由图8可知,AcJHEH在雌虫头部的表达量极显著最高(F=311,df=19,P<0.01),是脂肪体中基因表达量的2.3倍;AcJHEH基因在中肠和后肠中的表达量均极显著高于脂肪体和卵巢中的表达量,但两者间无显著差异;AcJHEH在卵巢中的表达量最低,仅为头部表达量的5%。
2.4 AcJHEH基因的功能分析
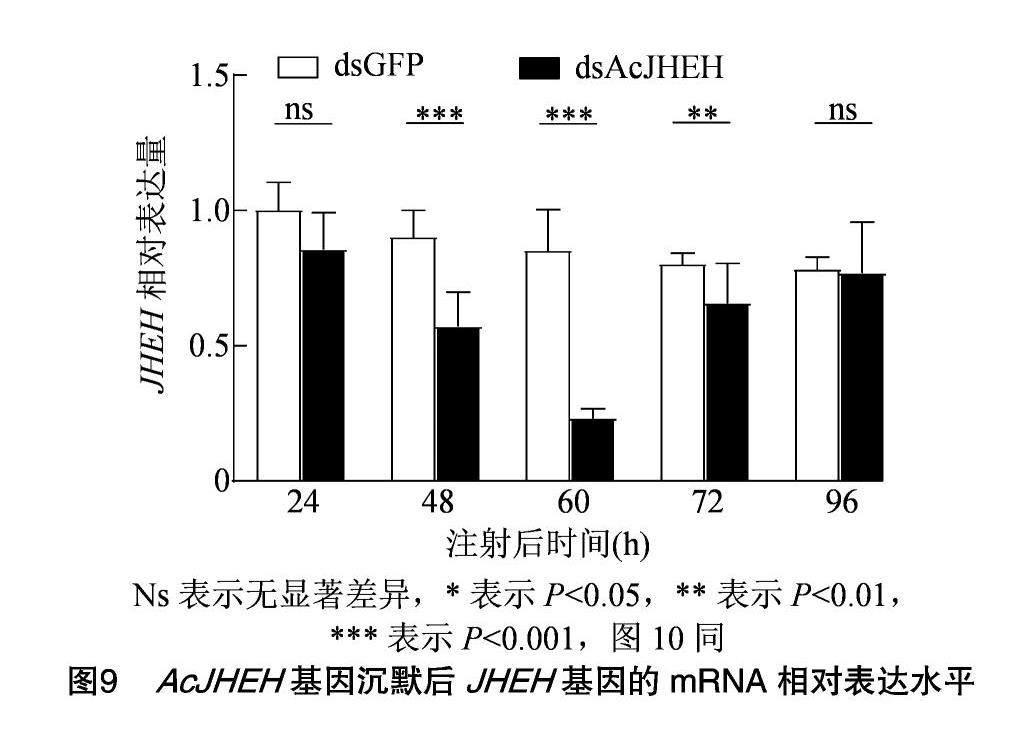
由图9可知,未注射dsAcJHEH的对照组中,JHEH的表达量持续下降;注射dsAcJHEH后,JHEH的表达量先下降再上升,注射后60 h的表达量最低,说明注射dsAcJHEH会影响JHEH的表达;在注射dsAcJHEH试验后的24 h,对照组和处理组的JHEH相对表达量差异不大;注射后48~72 h,对照组和处理组的相对表达量差异极显著。注射后 60 h,处理组的AcJHEH相对表达量极显著低于对照
组的相对表达量,表明基因干扰成功。
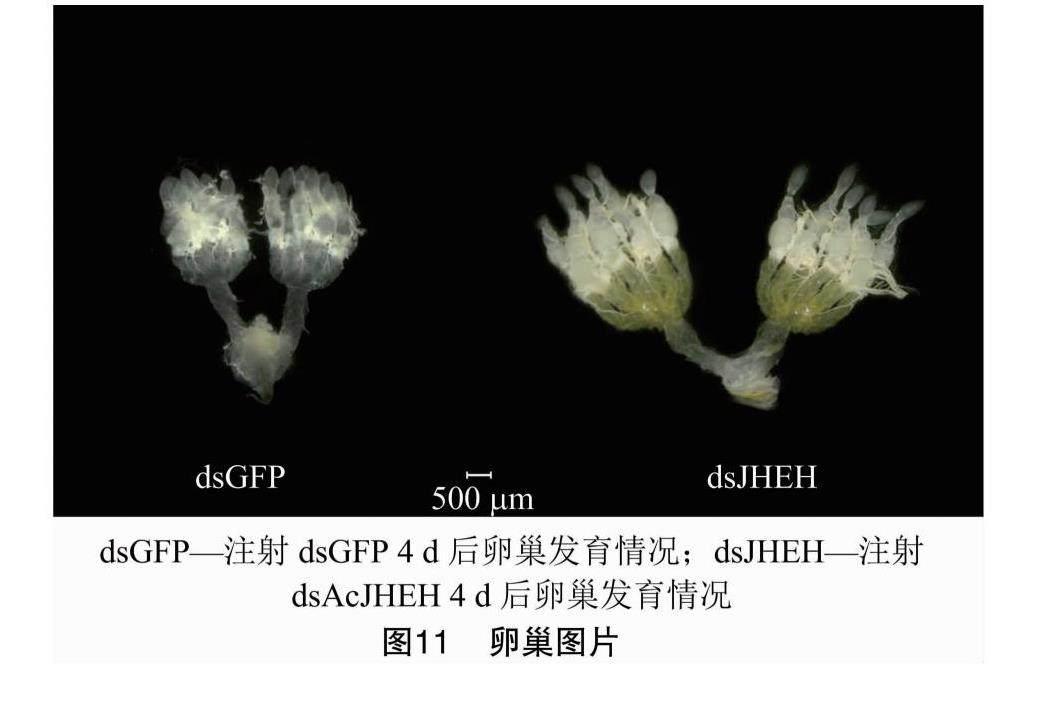
由图10可知,检测注射dsAcJHEH 48、60、72 h 后试虫的Vg基因的转录水平,发现注射dsGFP试虫的Vg基因在注射后48、60 h的相对表达量呈下降趋势;注射dsAcJHEH后,Vg基因的相对表达量极显著高于注射dsGFP对照组的相对表达量,Vg基因的表达在注射后60 h时达最高,至注射72 h后,Vg基因的相对表达量下降,但依然极显著高于对照组。由图11可知,比较分别注射dsAcJHEH和注射dsGFP后4 d的雌虫卵巢图片,发现与注射dsGFP的对照组相比,注射dsAcJHEH后,卵巢发育,卵黄原堆积现象更加显著。
3 结论与讨论
滞育是昆虫在应对不良环境压力,如夏季高温、冬季严寒及食物缺乏等因素时的一种重要生存策略[17-20],对个体存活和种群维持具重要意义。蠋蝽成虫的生殖滞育主要表现为生殖系统的发育停滞,如雌虫卵泡不分化、无卵黄沉积、卵巢管呈透明色,雄虫附腺发育抑制等[21]。以往研究证实,成虫进入滞育,伴随着保幼激素水平下降,其中,JH生物合成下降或关闭被认为是诱发一些昆虫启动滞育的关键环节[33-37],有些研究也表明JH降解在调控滞育中发挥重要作用,如在滞育准备期JH代谢增强可促进脂肪积累、提高抗逆性,并抑制卵巢发育[32-37]。JH的代谢分为2个途径:(1)JH被JHE降解成为JHA,JHA再被JHEH降解为JHAD;(2)保幼激素被JHEH降解为JHD,JHD再被JHDK降解成为保幼激素二醇磷酸(juvenile hormone diol phosphate,JHDP),即JH最终被降解为JHAD和JHDP[40-43]。已有研究表明,JH降解酶基因在不同种类昆虫的生殖滞育中发挥不同程度的调控作用,且同种降解酶基因的不同亚型也具有不同功能,如在生殖的烟粉虱(Bemisia tabaci)和意大利蜜蜂(Apis mellifera)中,JHE与卵黄原蛋白基因表达水平一致,两者均与JH滴度呈负相关[42-44];而黄斑星天牛(Psacothea hilaris)幼虫进入滞育后,JHE活性显著降低且在滞育期间维持较低水平[45],在滞育准备期的大猿叶甲雌虫中,3个JHE基因也以低水平表达[36]。
在本研究中,克隆获得了AcJHEH基因全长,分析AcJHEH基因序列特征发现,蠋蝽JHEH的N端包含1个由18~22个氨基酸组成的疏水性信号肽序列,不含有跨膜结构域,第49~161个氨基酸之间存在EHN环氧水解酶超家族结构域,具备环氧水解酶的典型结构特征[27-29,33-35],推测为JHEH1[35]。通过进化树分析蠋蝽JHEH氨基酸序列与近源物种的同源比较,蠋蝽保幼激素环氧水解酶基因在进化上高度保守,与同属半翅目蝽科的茶翅蝽JHEH聚类到同一分支,说明亲缘关系较近。
分析JHEH基因在蠋蝽滞育过程中的时序表达规律特征,结果表明JHEH基因表达与滞育进程联系密切,可能在滞育过程中也发挥重要调控作用。保幼激素降解代谢增强是生殖滞育激素调控的一个普遍特征。本研究结果表明,JHEH基因表达在蠋蝽滞育前期和滞育期均显著提高,这和JHEH基因在七星瓢虫滞育期间的表达规律相似[32],说明JHEH基因的转录水平变化与滞育进程密切相关。AcJHEH在滞育准备期和维持期的高表达,可能促进保幼激素的降解,降低JH滴度,从而促进滞育发生和维持。本研究也发现,蠋蝽成虫和七星瓢虫成虫在初羽化时,JHEH表达水平均较高,在对初羽化成虫进行滞育诱导处理后,JHEH表达量逐渐下降至最低水平后又随诱导时间延长而显著升高,推测初羽化成虫体内高表达的JHEH与成虫羽化行为有关,高表达的JHEH有助于维持低水平的保幼激素,从而完成羽化过程[46]。在滞育蠋蝽中,JHEH基因在头部高表达,说明该基因主要在头部发挥重要调控作用,与本研究不同,JHEH1基因在滞育大猿叶甲头部表达量较低[35]。JHEH基因在蠋蝽中肠和后肠中的表达量仅次于在头部的表达量。蠋蝽脂肪体中JHEH的表达量较低,和滞育大猿叶甲中JHEH1的研究结果[35]相似,但JHEH基因在滞育九香虫(Aspongopus chinensis Dallas)的脂肪体中高表达[29]。滞育蠋蝽的卵巢中JHEH表达量极低,这与九香虫的研究结果[29]近似。上述研究结果表明,JHEH基因在蠋蝽滞育成虫中的表达具有组织特异性,其在不同组织的差异表达发挥相应的生理调节功能,具体功能仍需进一步研究证实。
接下来,本研究对初羽化的蠋蝽进行JHEH基因的RNA干扰试验,发现干扰后,Vg的表达量上升,卵黄沉积明显,推断JHEH基因可通过促进Vg基因的表达来促进蠋蝽卵巢的发育。在七星瓢虫JH降解基因的功能研究中,发现在滞育准备期干扰JHE或JHEH基因表达均可促进卵黄沉积和卵子发生[35],但对大猿叶甲JH降解基因的研究中发现,JHE在滞育准备的雌虫中低表达,干扰JHEHs和JHDK在滞育准备期的表达后,虽然能降低脂肪積累和抗逆性,但不能促进生殖,也没有促进卵巢发育[37-39]。现有这些结果说明,JH降解酶基因在不同昆虫生殖滞育中的调控作用程度不完全相同,因此,研究者认为虽然保幼激素降解基因可通过调控JH水平对昆虫生殖滞育产生影响,但这种影响在某些昆虫中的作用是有限的,在这些昆虫中,或许JH生物合成水平的下降可能才是诱导生殖滞育的主要因素[35,37-41],仅通过抑制JH降解酶基因表达是否能逆转成虫进入滞育状态还需要进一步研究。JHEH基因在蠋蝽生殖滞育中的具体调控作用仍需深入探索。
此外,保幼激素的代謝不仅受降解酶基因的调控,还受如叉头转录因子(forkhead-boxO,FoxO)等的调控,其表达上调时可促进代谢酶类的转录翻译,同时沉默Kr-h1(krüppel-homolog1)基因片段的表达,阻断Kr-h1对JHD的应答反应,从而降低保幼激素滴度[38,46]。在后续研究中,除继续开展JHEH基因功能和上游信号通路研究,解析JHEH在滞育不同时期的特定作用机制,还要探索转录因子和保幼激素信号响应元件对保幼激素滴度的调控作用,为全面解析保幼激素调控生殖滞育的机制提供理论参考。
参考文献:
[1]任春燕,刘杰,罗明华,等. 天敌昆虫——蠋蝽的研究进展[J]. 中国农学通报,2022,38(12):100-109.
[2]邹德玉,徐维红,刘佰明,等. 天敌昆虫蠋蝽的研究进展与展望[J]. 环境昆虫学报,2016,38(4):857-865.
[3]马润国,秦世杰,张新鹏,等. 蠋蝽对桑木虱的捕食功能反应[J]. 蚕业科学,2022,48(6):559-564.
[4]孙婧婧,王孟卿,张长华,等. 蠋蝽对亚洲玉米螟幼虫的捕食作用[J]. 植物保护学报,2022,49(4):1187-1193.
[5]孟建玉,李治模,董详立,等. 蠋蝽若虫对草地贪夜蛾3~5龄幼虫的捕食能力[J]. 江苏农业科学,2022,50(8):1-5.
[6]唐艺婷,王孟卿,李玉艳,等. 蠋蝽对斜纹夜蛾幼虫的捕食作用[J]. 中国烟草科学,2020,41(1):62-66.
[7]唐艺婷,郭义,潘明真,等. 蠋蝽对小菜蛾幼虫的捕食作用[J]. 植物保护,2020,46(4):155-160.
[8]陈沉,宋丽文,左彤彤,等. 蠋蝽对美国白蛾的捕食行为观察和捕食能力评价[J]. 北京林业大学学报,2022,44(1):94-102.
[9]杨灿. 蠋蝽对斜纹夜蛾和烟青虫的捕食、选择性及生命表研究[D]. 贵阳:贵州大学,2021.
[10]廖平,石新如,郭义,等. 低温饲养对蠋蝽生长发育的影响[J]. 中国生物防治学报,2020,36(3):340-346.
[11]高卓,王皙玮,张李香,等. 蠋蝽人工繁殖技术及田间释放控制研究[J]. 黑龙江大学工程学报,2012,3(1):65-73.
[12]郑志英,陈瑜伟,温宇光. 利用蠋蝽防治几种林业害虫的试验[J]. 生物防治通报,1992,8(4):155-156.
[13]邹德玉. 取食无昆虫成分人工饲料蠋蝽的转录组研究及饲养成本分析[D]. 北京:中国农业科学院,2013.
[14]王权,车明柱. 蠋蝽生物学特性观察[J]. 吉林农业,2011(12):185.
[15]贵州省烟草公司遵义市公司. 捕食性天敌昆虫:蠋蝽[J]. 中国烟草学报,2018,24(4):135.
[16]朱艳娟,殷焱芳,王震,等. 蠋蝽在饲养中的品质退化观察[J]. 中国生物防治学报,2022,38(1):159-165.
[17]Denlinger D L. Regulation of diapause[J]. Annual Review of Entomology,2002,47:93-122.
[18]Denlinger D L. Why study diapause?[J]. Entomological Research,2008,38(1):1-9.
[19]Denlinger D L,Yocum G D,Rinehart J P. 10-Hormonal control of diapausee[M]//Gilbert L I. Insect endocrinology. San Diego:Academic Press,2012:430-463.
[20]Denlinger D L,Armbruster P A. Mosquito diapause[J]. Annual Review of Entomology,2014,59:73-93.
[21]李玉艳. 烟蚜茧蜂滞育诱导的温光周期反应及滞育生理研究[D]. 北京:中国农业科学院,2011.
[22]Smykal V,Bajgar A,Provaznik J,et al. Juvenile hormone signaling during reproduction and development of the linden bug,Pyrrhocoris apterus[J]. Insect Biochemistry and Molecular Biology,2014,45:69-76.
[23]Gilbert L I. Insect endocrinology[M]. San Diego:Academic Press,2012.
[24]于鹤,张智博,郑彬悦,等. 蜕皮激素、保幼激素在蜜蜂等昆虫中的作用[J]. 中国蜂业,2018,69(6):65-67.
[25]Tusun A,Li M,Liang X Z,et al. Juvenile hormone epoxide hydrolase:a promising target for hemipteran pest management[J]. Scientific Reports,2017,7:789.
[26]Share M R,Roe R M. A partition assay for the simultaneous determination of insect juvenile hormone esterase and epoxide hydrolase activity[J]. Analytical Biochemistry,1988,169(1):81-88.
[27]徐素平,张帅,吕丽敏,等. 棉蚜保幼激素环氧水解酶基因克隆及表达初步分析[J]. 棉花学报,2014,26(4):326-333.
[28]刘梦姚,王娟,王曼姿,等. 七星瓢虫保幼激素环氧水解酶基因克隆及表达分析[J]. 植物保护,2019,45(6):156-162.
[29]周汶楨,吴有芳,郭建军. 九香虫保幼激素环氧水解酶基因克隆、生物信息学及表达分析[J]. 应用昆虫学报,2021,58(3):612-622.
[30]Kotál V.Eco-physiological phases of insect diapause[J]. Journal of Insect Physiology,2006,52(2):113-127.
[31]Taub-Montemayor T E,Dahm K H,Bhaskaran G,et al. Rates of juvenile hormone biosynthesis and degradation during reproductive development and diapause in the boll weevil,Anthonomus grandis[J]. Physiological Entomology,1997,22(3):269-276.
[32]Khalil S M S,Anspaugh D D,Roe R M. Role of juvenile hormone esterase and epoxide hydrolase in reproduction of the cotton bollworm,Helicoverpa zea[J]. Journal of Insect Physiology,2006,52(7):669-678.
[33]Li Y Y,Chen J J,Liu M Y,et al. Enhanced degradation of juvenile hormone promotes reproductive diapause in the predatory ladybeetle Coccinella septempunctata[J]. Frontiers in Physiology,2022,13:877153.
[34]Zhou K,Jia N,Hu C,et al. Crystal structure of juvenile hormone epoxide hydrolase from the silkworm Bombyx mori[J]. Proteins:Structure,Function,and Bioinformatics,2014,82(11):3224-3229.
[35]Guo S,Sun D,Tian Z,et al. The limited regulatory roles of juvenile hormone degradation pathways in reproductive diapause preparation of the cabbage beetle,Colaphellus bowringi[J]. Journal of Insect Physiology,2019,119:103967.
[36]Zhu L,Yin T Y,Sun D,et al. Juvenile hormone regulates the differential expression of putative juvenile hormone esterases via methoprene-tolerant in non-diapause-destined and diapause-destined adult female beetle[J]. Gene,2017,627:373-378.
[37]Gao Q,Li B,Tian Z,et al. Key role of juvenile hormone in controlling reproductive diapause in females of the Asian lady beetle Harmonia axyridis[J]. Pest Management Science,2022,78(1):193-204.
[38]Sim C,Kang D S,Kim S,et al. Identification of FoxO targets that generate diverse features of the diapause phenotype in the mosquito Culex pipiens[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(12):3811-3816.
[39]Tian Z,Guo S,Li J X,et al. Juvenile hormone biosynthetic genes are critical for regulating reproductive diapause in the cabbage beetle[J]. Insect Biochemistry and Molecular Biology,2021,139:103654.
[40]Bomtorin A D,Mackert A,Rosa G C C,et al. Juvenile hormone biosynthesis gene expression in the corpora allata of honey bee (Apis mellifera L.) female castes[J]. PLoS One,2014,9(1):e86923.
[41]Anspaugh D D,Roe R M.Regulation of JH epoxide hydrolase versus JH esterase activity in the cabbage looper,Trichoplusia ni,by juvenile hormone and xenobiotics[J]. Journal of Insect Physiology,2005,51(5):523-535.
[42]Mackert A,do Nascimento A M,Bitondi M M G,et al. Identification of a juvenile hormone esterase-like gene in the honey bee,Apis mellifera L.:expression analysis and functional assays[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,150(1):33-44.
[43]王柄权,程凌寒,方宇,等. 植物次生代谢物质对草地贪夜蛾解毒酶活性及相关基因表达的影响[J]. 江苏农业科学,2022,50(8):11-15.
[44]Huang C,Wu Q,Jiang C Y,et al. Identification and developmental expression of putative gene encoding juvenile hormone esterase (CpJHE-like) in codling moth,Cydia pomonella (L.)[J]. Journal of Integrative Agriculture,2019,18(7):1624-1633.
[45]李勝,蒋容静,曹梅讯. 保幼激素的代谢[J]. 昆虫学报,2004,47(3):389-393.
[46]Yin Z J,Dong X L,Kang K,et al. FoxO transcription factor regulate hormone mediated signaling on nymphal diapause [J]. Frontiers in Physiology,2018,9:1654.

