L-赖氨酸功能化纤维素对模拟苹果汁中铅的吸附特性研究
吴思邈,蒋浩源,安 莹,张丽冕,李 彭
(南京财经大学食品科学与工程学院,江苏南京 210023)
随着大量的农业活动和工业活动,重金属污染愈加严重,其广泛分布在大气、土壤和水体中。铅(Pb2+)等重金属离子在生物上是不可降解的[1-3],它们会通过物质循环、食物链不断富集,诱发多种人类疾病,从而产生各种社会经济问题[4]。木本[5]和草本[6]水果所受重金属污染如2019 年美国《消费者报告》报道,市售果汁中几乎一半的果汁产品中铅超标[7-8]。研究者对山东省的45 个果园的苹果进行有害离子检测,发现铅这种具有强毒性的重金属离子检出率均超过93.0%[9],山西省13 个种植园的苹果中铅的检出率为94.6%[10]。因此,当务之急是选择安全性较高的方式去除水果制品如果汁饮料中的重金属。果汁的浓缩进一步提高了重金属离子浓度,铅是果汁中常见的重金属离子之一,主要侵入神经系统、造血器官和肾[11]。
目前,吸附法一种很有前途的低铅浓度处理技术[12-16]。吸附剂的选择是吸附过程的关键。传统吸附剂如活性炭、沸石、硅胶等的比表面积或者吸附位点有限,导致吸附效率和吸附容量通常有限。具有大表面积和更多活性位点的生物大分子材料受到越来越多的关注,在重金属去除方面更有前景。纤维素是自然界中最丰富的生物可再生资源,被认为是最适合合成绿色产品的候选原料之一,已然广泛用于食品领域等[17-20]。根据提取物的大小和方法,纤维素可分为微米级纤维素(microcrystalline cellulose,MCC)和纳米级纤维素。其中,从植物中提取纳米级纤维素可分为纳米纤维素纤维(nanocellulose fibre,CNF)和纤维素纳米晶体(nanocellulose crystal,CNC)[21-23]。纤维具有比表面积大、吸附活性位点多、无毒、低成本和生物相容性高等特点[24-25],其结构上存在的大量羟基[26],满足了表面化学改性的必要条件[27-28],胺化与羧化是当前应用较多的纤维素改性方法。如今已有多种改性纤维素基吸附剂用于水体重金属的去除[29-32],且去除效果良好。例如,Yakout 等[33]将丙烯酰胺接枝到纤维素上,再与氧化石墨烯交联,合成的氨基纤维素在pH 为7,25 ℃的条件下,对Pb2+的最大吸附容量为186.48 mg/g。
目前,改性所选化合物大多为有毒有害且价格高昂的高自由基密度化合物,例如丙烯酰胺[34]、三乙烯四胺[35]、1,2,3,4-丁烷四羧酸[36]、氨基三唑[37]等。在吸附处理重金属的过程中,易向水体引入毒害物质,因此在果汁重金属的去除中,寻找无毒无害又高效的改性化合物质极其重要,对拓宽其适用性与实用价值具有重大作用,甚至还可应用于医药、液体食品等领域。果汁饮料中多存在葡萄糖、蔗糖、单宁酸及许多风味物质和营养物质,吸附剂与这些物质间的作用对重金属的吸附影响尚不清楚。
本研究在此背景下,采用大小不同的纤维素(MCC,CNF)为基质,选择无毒无害的L-赖氨酸进行接枝改性。以L-赖氨酸为单体,通过自由基聚合反应制成L-赖氨酸功能化纤维素基吸附剂,对比研究了尺寸不同的基质纤维素在不同氧化条件下得到的吸附剂对单一铅体系中Pb2+的吸附效果,后用于模拟果汁体系中Pb2+的吸附,以期证实纤维素基无毒害改性吸附剂在重金属去除上的潜力及探究其在果汁中重金属去除的可能性。
1 材料与方法
1.1 材料与仪器
纳米纤维素纤维分散液(1.60%)购自浙江金加浩绿色纳米材料股份有限公司;氯化铅PbCl2、微晶纤维素MCC、高碘酸钠NaIO4、乙二醇、赖氨酸L-lys、硼氢化钠NaBH4、硝酸HNO3、二甲基亚砜DMSO、四甲基哌啶酮TEMPO、次氯酸钠NaClO、溴化钠NaBr、葡萄糖、果糖、蔗糖、苹果酸、柠檬酸试剂均为分析纯,购自国药集团化学试剂有限公司。
1260 高效液相色谱仪 美国Agilen 公司;L-8900 全自动氨基酸分析仪 日本日立公司;M6 原子吸收分光光谱仪 美国Thermo 公司;Nova nano 450 扫描电子显微镜 美国FEI 公司;Spectrum Two傅里叶红外光谱仪 美国PerkinElmer 公司;ASAP型比表面及孔隙分析仪 美国Micromeritics 公司;D8 advance 型X-射线衍射分析仪 德国Bruker 公司;TG 209 F3 Tarsus®型热重分析仪 德国Netzxch 公司;DHG-9240A 电热鼓风干燥箱 上海一恒科技公司;FE28 pH 计 上海梅特勒-托利多公司;524G 恒温磁力搅拌器 上海梅颖浦公司;Smart-S15 实验室纯水系统 上海和泰公司。
1.2 实验方法
1.2.1 吸附剂的制备 根据之前的研究结果[38],本论文选择使用NaIO4作为引发剂氧化活化MCC 为双醛基微晶纤维素,从而接枝L-赖氨酸得到L-赖氨酸功能化微晶纤维素;使用TEMPO/NaClO/NaBr 氧化体系作为引发剂氧化活化CNF 为羧化纳米纤维素纤维,从而接枝L-赖氨酸得到L-赖氨酸功能化纳米纤维素纤维。
1.2.1.1 纤维素的引发活化NaIO4氧化微晶纤维素的制备:首先配制0.5mol·L-1的NaIO4溶液,并加以摇瓶、超声辅助溶解。称取8 g MCC 固体样品,加入到NaIO4溶液并完全置于黑暗条件下,其中纤维素与NaIO4的质量比为3:10,随即用0.1 mol·L-1盐酸溶液调pH 至4 后,以800 r/min 的速度在40 ℃条件下恒温水浴搅拌3 h,再添加9 mL 乙二醇以猝灭反应,调pH 至8 后继续搅拌30 min 后将所得的反应悬浮液倒入透析袋(透析分子量:3500 Da)中透析至pH 达中性,以去除反应体系中过量的离子。旋转蒸发、冷冻干燥后得到双醛基化的纳米纤维素中间产物,即为NaIO4氧化后的微晶纤维素(Sodium periodate-oxidized MCC,POCM),研磨待用。
TEMPO 体系氧化纳米纤维素纤维的制备:在烧杯中配制含10 g TEMPO 和1.0 g NaBr 的水溶液1000 mL,称取10 g CNF 加入后逐渐加入1.6 mL NaClO 溶液,用0.1 mol·L-1NaOH 溶液将反应溶液的pH 维持在10 左右,并用磁力搅拌器与超声波清洗仪辅助氧化过程。室温继续反应6 h 后加入100 mL 甲醇,并继续搅拌反应1 h。用2:1 的乙醇猝灭反应并反复洗涤产物后倒入透析袋中透析至pH 达中性,以去除反应体系中过量的离子。旋转蒸发、冷冻干燥后所得即为TEMPO 氧化纳米纤维素纤维(TEMPO-oxidized cellulose nanofiber,TOCF),研磨待用。
1.2.1.2 L-赖氨酸功能化接枝 根据物质的量的比例为1:1 进行混合,称取8 g 上述所得氧化纤维素(POCM、TOCF)与L-赖氨酸于800 mL 水中,使得L-赖氨酸的含量为0.4 mol·L-1,以400 r/min 的转速在40 ℃条件下搅拌10 min 后滴加5 mL 二甲基亚砜,并继续搅拌6 h 直至溶液完全均匀。加入5 g 硼氢化钠反应3 h 至无气泡后用乙醇猝灭反应并反复洗涤产物;倒入透析袋中透析至pH 达中性,以去除反应体系中过量的离子。旋转蒸发、冷冻干燥后即为所得L-赖氨酸功能化纤维素吸附剂(Lysinefunctionalized grafted cellulose,L-g-cellulose),并分别命名为L-g-POCM、L-g-TOCF,合成路线见图1。
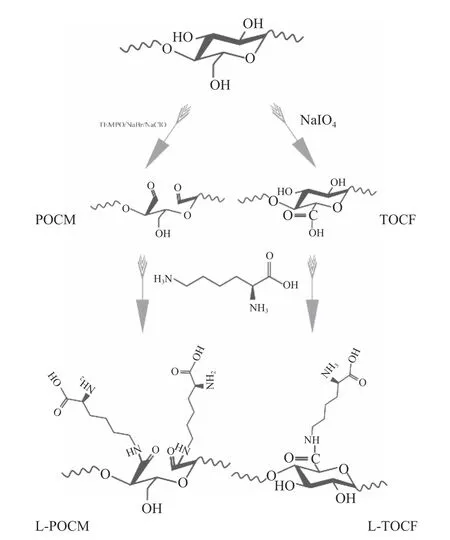
图1 L-赖氨酸功能化纤维素基吸附剂的合成路线Fig.1 Synthetic route of L-lysine functionalized cellulosebased adsorbent
1.2.2 储备溶液的配制
1.2.2.1 单一铅体系(浓度:20 mg/L)的配制 取500 mL 容量瓶,量取10 mL Pb2+离子储备液于容量瓶中,添加超纯水并定容至500 mL 混匀得到20 mg/L 的铅离子溶液备用(考虑到苹果汁制备的每一项工艺流程的重金属含量,因此选择20 mg/L 的铅离子浓度作为常用浓度)。
模拟苹果果汁:根据所用NFC 浓缩苹果汁中有机质的测量结果,模拟苹果汁体系包括单一糖-铅体系、复合糖-铅体系、单一酸-铅体系、复合酸-铅体系和复合糖酸-铅体系,糖类分为葡萄糖、果糖、蔗糖,浓度分别为1.9、1.3、1.0 g/L,有机酸分为L-苹果酸、柠檬酸,浓度分别为0.26、0.1 g/L;结合实际,每个体系作四个不同的浓度,分别由储备液稀释10、100、1000 倍所得。
单一糖-铅体系储备液:分别量取0.19 g 葡萄糖、0.13 g 果糖、0.10 g 蔗糖到100 mL 铅体系中,混匀备用,分别制得葡萄糖浓度为1.9 g/L 的葡萄糖-铅体系、果糖浓度为1.3 g/L 的果糖-铅体系和蔗糖浓度为1.0 g/L 的蔗糖-铅体系。
复合糖-铅体系储备液:量取0.19 g 葡萄糖、0.13 g 果糖、0.10 g 蔗糖到100 mL 铅体系中,混匀备用。
单一酸-铅体系储备液:分别量取0.026 g L-苹果酸、0.010 g 柠檬酸到100 mL 铅体系中,混匀备用,分别制得L-苹果酸浓度为0.26 g/L 的L-苹果酸-铅体系和柠檬酸浓度为0.1 g/L 的柠檬酸-铅体系。
复合糖-酸-铅体系储备液:量取0.19 g 葡萄糖、0.13 g 果糖、0.10 g 蔗糖、0.026 g 苹果酸、0.010 g 柠檬酸,并选择性地加入到100 mL 铅体系中,混匀备用,制得铅浓度为20 mg·L-1的复合糖-酸-铅体系。
1.2.3 表征分析
1.2.3.1 微观形貌与结构观察 采用扫描电子显微镜观察筛选后的基质纤维素、氧化纤维素和L-赖氨酸功能化纤维素的微观形貌和表面形态的变化,样品在测试前均进行喷金处理以提高电导率,分别用5000 和50000 放大倍率记录图像。
1.2.3.2 表面官能团和元素分析 借助压片法测得筛选后的基质纤维素和L-赖氨酸功能化纤维素的傅里叶红外光谱,扫描范围是4000~400 cm-1,通过官能团分析探究材料的合成机理。采集SEM-EDS 电子能谱图数据确定材料中各元素的分布情况,从而验证合成路径。
1.2.3.3 比表面及孔隙分析 在液氮条件下,借助比表面积分析仪进行BET 和全孔分析,对筛选后的基质纤维素和L-赖氨酸功能化纤维素进行氮气吸附/脱附实验,脱气温度为90 ℃,脱气时间为5 h,采用Barrett-Joyner-Halenda 和多点Brunauer-Emmett-Teller 方法计算比表面积和孔径分布。
1.2.3.4 热稳定性分析 利用热重分析仪探究筛选后的基质纤维素和L-赖氨酸功能化纤维素的热稳定性。通过热重分析,可更全面地了解吸附剂的应用范围。
1.2.4 吸附剂Pb2+的吸附实验 在100 mL 锥形瓶中加入20 mL 单一铅溶液和不同剂量的吸附剂,将锥形瓶封口后置于搅拌器上,在室温下以400 r/min的速度搅拌30 min,用0.45 μm 水相滤膜过滤后用原子吸收分光光谱仪(Atomic absorption spectrometer,AAS)测定清液中Pb2+浓度,并计算其吸附效率(%)和吸附容量(qe,mg/g),计算公式如下:
其中,吸附效率:体系中被去除的Pb2+浓度与原始浓度的比值,%;C0:原始体系中Pb2+的浓度,mg/L;Ct:吸附过后,体系中Pb2+的浓度,mg/L;qe:平衡状态下吸附剂对Pb2+的吸附容量,mg/g;V:铅离子溶液的体积,mL;m:所用吸附剂的质量,g。
为了探究模拟苹果汁体系对吸附剂吸附性能的影响,进行Pb2+静态吸附实验,L-g-POCM 与L-g-TOCF 剂量分别为优化后的剂量,Pb2+浓度为20 mg/L,体系的体积为20 mL,实验温度为室温(25 ℃),实验时间为30 min,用0.45 μm 水相滤膜过滤后用AAS 测定清液中Pb2+浓度。并计算其吸附效率(%)和吸附容量(qe,mg/g)。所用模拟苹果汁包括葡萄糖-铅体系、果糖-铅体系、蔗糖-铅体系、复合糖-铅体系、L-苹果酸-铅体系、柠檬酸-铅体系、复合酸-铅体系、复合糖-酸-铅体系。
1.2.5 模拟苹果汁的品质研究 选择复合糖-酸-铅体系模拟苹果果汁,探究L-g-POCM 和L-g-TOCF对吸附前后模拟苹果汁品质的影响
1.2.5.1 基础指标 基础指标包括pH、可溶性固形物(Total soluble solid,TSS)、色值、透光率、糖类含量和有机酸含量。测定方法如下:
pH:用pH 计测试吸附前后苹果汁溶液的pH。
TSS 含量:参照GB/T 12143-2008《饮料通用分析方法》中的方法,用阿贝折光计读取吸附前后苹果汁溶液的可溶性固形物含量。
色值:参照GB/T 18963-2012《浓缩苹果汁》中的方法,取一份待测试样(吸附前后的模拟苹果汁),加入等体积的乙醇溶液混匀后静置30 min,用0.22 µm滤膜过滤后转移至比色皿,以蒸馏水为参比,在紫外分光光度计波长430 nm 处测定吸附前后苹果汁溶液的吸光度。
透光率:参照GB/T 18963-2012《浓缩苹果汁》中的方法,用1 cm 比色皿,以蒸馏水为参比,在紫外分光光度计波长625 nm 处测定吸附前后苹果汁溶液的透光率。
1.2.5.2 吸附稳定性 吸附稳定性是衡量吸附剂吸附性能的重要指标,主要从吸附前后吸附剂浸出量和有机质含量进行分析,对苹果汁的品质影响具有重大意义。其中,L-g-POCM 和L-g-TOCF 的吸附剂浸出量以L-赖氨酸的物质的量为标准,有机质包括果糖、葡萄糖、蔗糖等糖类和L-苹果酸、柠檬酸等有机酸。
吸附剂浸出量:参照GB 5009.124-2016《食品安全国家标准:食品中氨基酸的测定》中的方法,将吸附后的溶液经过水解、过膜后转移至仪器进样瓶,供全自动氨基酸分析仪测定用,经过计算可得溶液中赖氨酸的浸出量。
糖类含量:参照GB 5009.8-2016《食品安全国家标准:食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》中的方法,采用HPLC 测定吸附前后模拟苹果汁中的糖类含量,并计算其保留率。色谱条件为:色谱柱为COSMOSIL Packed Column Sugar-D(4.6×250 mm),柱温40 ℃,流速:1.0 mL/min,进样量:20 µL,流动相为70%乙腈-水溶液。
有机酸含量:参照GB 5009.157-2016《食品安全国家标准:食品中有机酸的测定》中的方法,采用HPLC 测定吸附前后模拟苹果汁中的有机酸含量,并计算其保留率。色谱条件为:色谱柱为CAPECELL PAK MG S5 C18(4.6×250 mm,5 µm),柱温40 ℃,流速:1.0 mL/min,进样量:20 µL,流动相为0.1%磷酸溶液-甲醇。保留率计算公式如下:
1.3 数据处理
所有试验均重复进行3 次,结果以平均值±标准差表示。所有的数据使用 SPSS Statistics 18.0 进行ANOVA 差异显著性分析及相关性分析,当P<0.05时表示差异具有显著性。使用Origin 2023 作图。
2 结果与分析
2.1 吸附剂的表征分析
2.1.1 微观形貌与结构观察 为了观察基质纤维素、氧化纤维素和L-赖氨酸功能化纤维素的微观形貌和结构变化,采用扫描电镜对制备的MCC、POCM、L-g-POCM、CNF、TOCF、L-g-TOCF 吸附剂的表面形貌进行了初步探究。如图2A 所示,纯MCC 为表面粗糙的棒状微米结构,表面凹陷多而深,平均粒径约为20 µm。使用NaIO4对MCC 氧化后,其形状维持棒状不变,平均粒径增加到200 µm(图2B),其表面变得光滑,但表面出现联系致密瘦长的“银鱼”结构,初步判定这是由于C2-C3 单键的断裂导致POCM 分子间的作用力变大和团聚现象变强。L-赖氨酸功能化后,平均粒径下降至6 µm,其形状在仍保持棒状结构的基础上同时呈片状发展,瘦长“银鱼”结构发展成了较致密且不规则分布的球状“泡泡”结构(图2C)。初步判定,L-g-POCM 与MCC、POCM 相比,L-赖氨酸的接枝使表面形貌发生了显著变化。如图2D 所示,纯CNF 为表面光滑的丝状纳米结构,团聚缠绕现象严重,平均粒径约为9.1 nm。使用TEMPO 氧化体系对CNF 氧化后,平均粒径降低到7.4 nm(图2E),团聚缠绕现象加剧,非团聚的网状结构更为松散,初步判定这是由于C6 伯羟基的氧化没有改变纤维素的基本骨架结构,但电荷的产生增强了分子间作用力、加重了团聚缠绕现象。但L-赖氨酸功能化后,平均粒径下降至8.5 nm,整体变得透明与肿胀,L-赖氨酸的接枝缓解了团聚缠绕现象(图2F)。L-g-POCM、L-g-TOCF 材料在制备过程的形态和尺寸变化初步验证了引发活化和接枝的成功。

图2 纤维素基材料在不同倍数下的SEM 微观形貌图Fig.2 SEM images at different scales of Cellulose-based materials
2.1.2 元素分布分析 为了进一步观察L-g-POCM、L-g-TOCF 的内部结构,采用SEM-EDS、XPS 进行C、N、O 的元素分析,L-g-POCM、L-g-TOCF 的SEM-EDS 元素分布分别如图3A、图3B 所示,利用面扫得到的元素分布表如表1 所示。L-g-TOCM 中氮元素的原子百分比为8.60%;而L-g-TOCF 中氮元素的原子百分比为6.27%,证明L-g-POCM、L-g-TOCF 中氮元素的存在进一步证明了赖氨酸成功地被接枝在MCC 上,见表1。
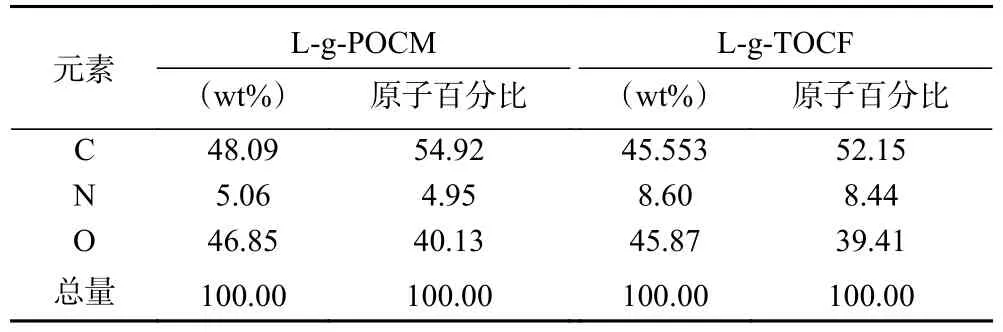
表1 由SEM-EDS 分析得到的L-g-POCM、L-g-TOCF的元素分析Table 1 Elemental analysis of L-g-POCM and L-g-TOCF from SEM-EDS
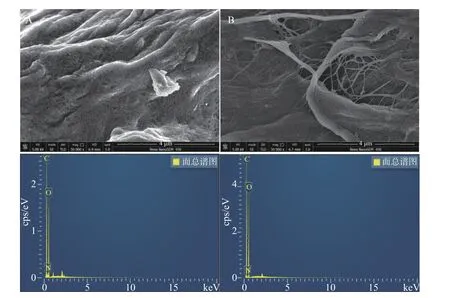
图3 吸附剂的EDS 能谱图Fig.3 EDS spectra of the adsorbents
2.1.3 表面官能团分析 用FT-IR 表征了原纤维素和改性材料的官能团变化。如图4A、图4B 所示,MCC、L-g-POCM、CNF、L-g-TOCF 在3334、1632、1425、1322、1163 和1033 cm-1处具有相同的峰值,分别对应-OH 拉伸振动峰、-OH 弯曲振动吸收峰、H-C-H 面内弯曲振动峰、O-C-H 面内弯曲振动峰、C-O-C 不对称拉伸振动峰和C-O 拉伸振动峰。其中,1163 和1033 cm-1处的拉伸振动峰代表葡萄糖环的骨架振动[39]。证明改性后MCC 和CNF 骨架结构不变,说明L-赖氨酸的接枝并没有破坏纤维素的基本骨架结构。NaIO4选择性地断裂MCC 的C2 和C3 上的C-C 键,将其氧化为醛基,使其在3334 cm-1处的吸收峰变窄,吸光度降低。-NH2的吸收峰在3300~3500 cm-1之间,通常与-OH 的吸收峰重叠[39],而在图4A 中,3334 cm-1处的拉伸振动峰宽度变化不大,证明了N-H 吸收峰的存在,间接证明了L-赖氨酸成功接枝到MCC 表面。每个L-赖氨酸分子有一个羧基和两个氨基,而L-g-POCM 在1406 cm-1处有羧基-OH 的弯曲振动吸收峰[40],证明了L-g-POCM 的接枝是通过L-赖氨酸上的-NH2与POCM上-CHO 的还原胺化反应实现的。
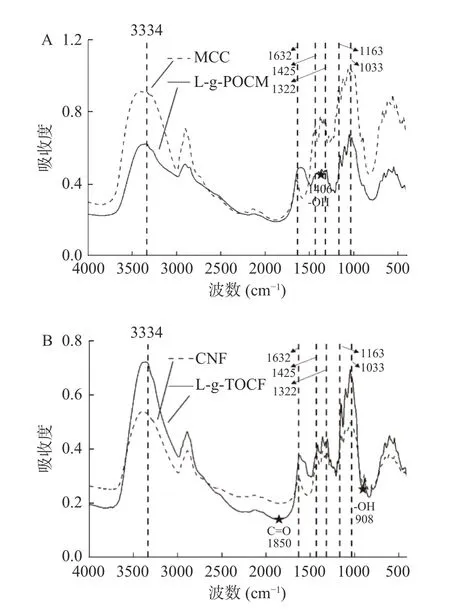
图4 改性前后材料的傅里叶红外谱图Fig.4 Fourier transform infrared spectra of materials before and after modification
CNF 和L-g-TOCF 的FTIR 光谱如图4B 所示。TEMPO 氧化体系成功地将C6 上的羟基氧化为羧基[38]。1850 cm-1处的羧基C=O 弯曲振动峰和908 cm-1处的-OH 平面外弯曲振动峰均证明L-赖氨酸成功接枝CNF,且接枝过程中L-赖氨酸羧基未参与反应。因此,L-赖氨酸的-NH2与TOCF 的-COOH缩合制备了L-g-TOCF。
2.1.4 比表面积及孔径分析 图5 为L-g-POCM和L-g-TOCF 经BET 分析后的氮气吸附-脱附等温曲线。二者都表现出IV 型吸附-脱附等温线,且回滞环均接近H3 型,这表明吸附剂中存在介孔结构,有利于对铅离子吸附过程的进行。MCC、CNF、L-g-POCM 和L-g-TOCF 的比表面积、孔容及孔径参数如表2 所示。与MCC、CNF 相比,改性后材料添加了L-赖氨酸,具有更高的比表面积和孔容,为吸附过程提供了更多的有效吸附位点,更有利于吸附。
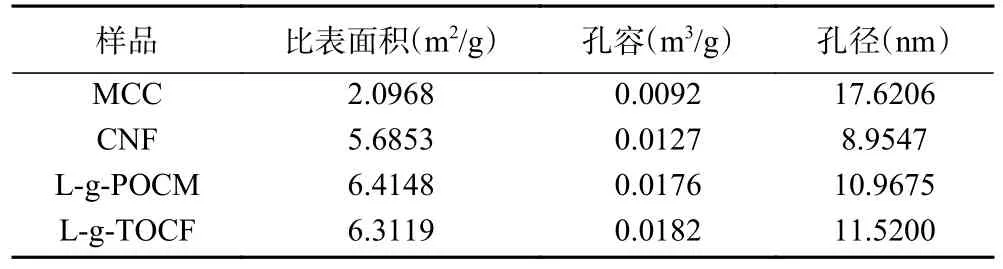
表2 L-g-POCM 和L-g-TOCF 的 BET 拟合参数Table 2 BET fitting parameters of L-g-POCM and L-g-TOCF
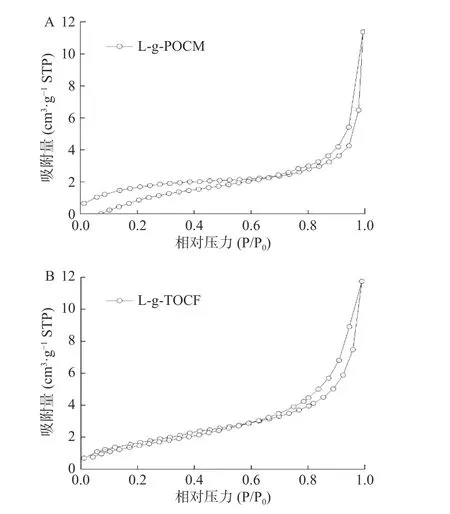
图5 吸附剂的BET 分析图Fig.5 BET analysis of the adsorbents
2.1.5 热稳定性分析 图6 表现了L-g-POCM 和L-g-TOCF 的TG 和DTG 分析曲线。L-g-POCM在28.6 ℃开始缓慢减重损失,一直到333.2 ℃处损失率为39.55%;再经过一段时间的升温,L-g-POCM开始快速分解,直至554 ℃处损失率79.97%,最终在701.6 ℃处达到平衡,此时剩余样品质量28.19%。随着温度的升高,L-g-POCM 的DTG 曲线呈现出三个峰形,峰形的拐点分别为224 ℃、333.2 ℃和381 ℃。L-g-TOCF 在27.41 ℃开始缓慢减重损失,主要是水分蒸发和低分子化合物的分解,一直到312.4 ℃处损失率为16.18%,然后,随着温度的继续升高,试样在进一步快速分解,312.4 ℃同时也是Lg-TOCF 的初始降解温度,直至366.6 ℃处损失率高达63.72%,最终在701.2 ℃处达到平衡,此时剩余样品质量为19.38%。随着温度的升高,L-g-TOCF 的DTG 曲线呈现出一个峰形,峰形的拐点为366.6 ℃。
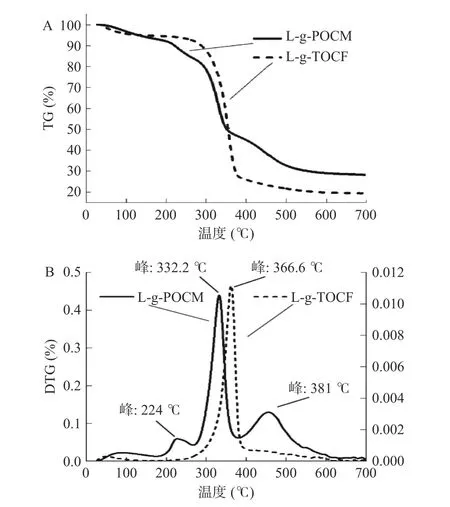
图6 L-g-POCM 和L-g-TOCF 的TG(A)和DTG(B)曲线Fig.6 Thermogravimetric (TG) (A) and derivative thermogravimetric (DTG) (B) curves of L-g-POCM and L-g-TOCF
2.2 吸附实验
2.2.1 L-赖氨酸功能化纤维素与单一铅体系 图7显示了在0.25~5.0 g/L 剂量范围内,L-g-POCM 对Pb2+的吸附效率和吸附容量。当剂量从0.25 g/L 增加到0.5 g/L 时,吸附效率和吸附容量也随之增加,这是因为随着吸附位点的增加,L-g-POCM 逐渐达到了吸附饱和。当L-g-POCM 的剂量为0.5 g/L 时的吸附效率和吸附容量均能达到最高。随着L-g-POCM 的剂量增加到1.0 g/L,吸附效率和吸附容量呈下降趋势,可能是因为剂量的提高加重了L-g-POCM 分子间的团聚现象,导致了吸附位点的隐藏。L-g-POCM 具备“低耗高效”的潜在属性。此时,L-g-POCM 的吸附效率较MCC 增长了19.74 倍,吸附容量增长了22.63 倍。同样的,3.0 g/L 的L-g-TOCF 的吸附效率较CNF 提高了77.35%,吸附容量提高了98.42%。因此,在后续的试验探究中,将选用0.5 g/L 作为L-g-POCM 的优化剂量,3.0 g/L 作为L-g-TOCF 的优化剂量。
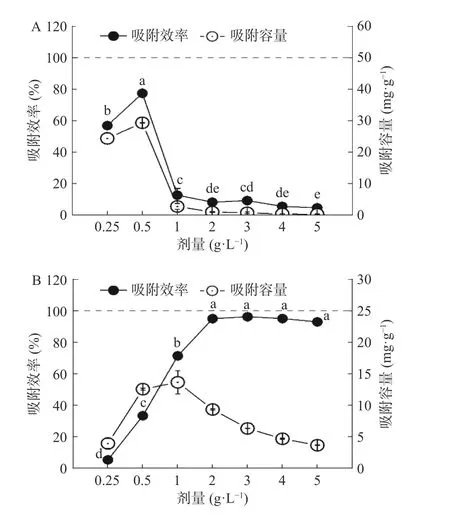
图7 吸附剂剂量对Pb2+吸附性能的影响Fig.7 Influence of adsorbent dosage on the adsorption properties of Pb2+
2.2.2 L-赖氨酸功能化纤维素与单一糖/铅体系
2.2.2.1 单一果糖/铅体系 如图8A 所示,L-g-POCM和L-g-TOCF 在不同浓度的果糖-铅体系下对Pb2+的吸附性能。随着浓度的降低,L-g-POCM 在三个较低浓度下的吸附性能无差异(P>0.05),L-g-TOCF 的吸附效果显著性增强(P<0.05)。在果糖存在的条件下,两种吸附剂的吸附性能被抑制,其中L-g-POCM 在最高浓度时的吸附效率为9.42%±0.62%,抑制率为87.82%,仅为L-g-TOCF 的14.96%,完全不能做到有效吸附。除此以外,L-g-POCM 和L-g-TOCF 均能做到有效吸附。随着糖浓度的逐步降低,L-g-POCM 吸附效率的增加主要体现在1.3 g/L 处和0.13 g/L 间断崖式增长。在0.13、0.013、0.0013 g/L三个糖浓度下,果糖-铅体系对L-g-POCM 吸附性能的抑制相对均一。L-g-TOCF 吸附性能的最大抑制率为34.51%。在各个糖浓度下,果糖-铅体系对L-g-TOCF 吸附性能的抑制相对均一。果糖-铅体系对Lg-POCM 吸附性能的抑制强,对L-g-TOCF 的抑制弱,且抑制效果不均一。
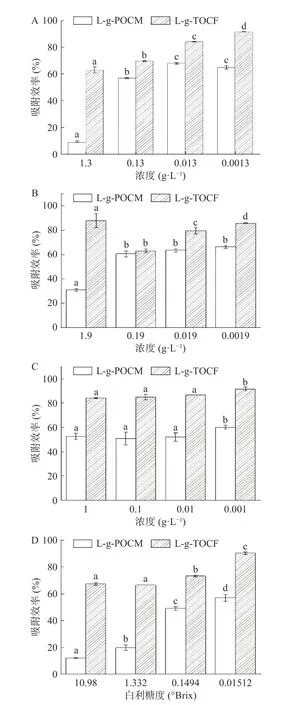
图8 不同条件下的不同糖-铅体系对吸附剂吸附性能的影响Fig.8 Effects of different brix of saccharides-Pb2+ system on adsorbent properties
2.2.2.2 单一葡萄糖/铅体系 如图8B 所示,L-g-POCM 和L-g-TOCF 在不同浓度的葡萄糖-铅体系下对Pb2+的吸附性能,同一吸附剂在各浓度下的吸附性能存在显著性差异(P<0.05)。果糖与葡萄糖互为同分异构体。与果糖-铅体系类似地是,L-g-POCM仅在最高糖浓度条件下依旧未能达到有效吸附,抑制率达到了60.00%,低于果糖-铅体系,同时葡萄糖-铅体系对L-g-POCM 吸附性能的抑制在0.19、0.019和0.0019 g/L 三个糖浓度下相对均一。随着葡萄糖浓度的降低,L-g-POCM 的吸附效率缓慢提高。L-g-TOCF 的吸附效率在最高浓度时达到了最强的吸附效果,此时葡萄糖的抑制率为8.66%。在三个糖浓度下,葡萄糖-铅体系对L-g-POCM 吸附性能的抑制相对均一。葡萄糖-铅体系对L-g-POCM 的抑制较强,对L-g-TOCF 的抑制较弱,且抑制效果不均一。
2.2.2.3 单一蔗糖/铅体系 如图8C 所示,L-g-POCM和L-g-TOCF 在不同浓度下的蔗糖/铅体系的对Pb2+的吸附性能,前三个浓度下的吸附性能不存在显著性差异(P>0.05)。蔗糖/铅体系中,各个糖浓度下两种吸附剂的吸附性能相对均一,L-g-POCM 的吸附效率集中在50.86%~60.06%,最大抑制率为34.26%;L-g-TOCF 的吸附效率集中在84.20%~91.65%,最大抑制率为12.43%。该体系对两种吸附剂的吸附效率影响不大,且L-g-TOCF 更接近于单一铅体系中的效果,最高可达91.65%。蔗糖/铅体系对L-g-POCM的抑制较强,对L-g-TOCF 的抑制较弱。
2.2.2.4 复合糖/铅体系 图8D 为L-g-POCM 和L-g-TOCF 在不同白利糖度的复合糖/铅体系下对Pb2+的吸附性能,L-g-POCM 在前两个浓度下的吸附性能不存在显著性差异(P>0.05),L-g-TOCF 在各浓度下的吸附性能存在显著性差异(P<0.05)。在囊括了三种糖的复合糖铅体系中,L-g-POCM 吸附效果的增幅则相对稳定,分别为62.98%、149.41%、16.15%,吸附效率最高为56.88%,为单一铅体系时的73.52%。与L-g-POCM 一样,含有蔗糖的单一糖-铅体系对Lg-TOCF 的吸附效果影响不大,且接近于单一铅体系中的效果,最高可达91.65%。在复合糖-铅体系中,L-g-TOCF 的吸附效果也相对地稳定增长,分别为1.30%、10.20%、23.34%,吸附效率最高为90.29%,为单一铅体系时的93.89%,在最高白利糖度条件下,L-g-TOCF 对Pb2+的吸附效率为67.30%,为单一铅体系时的69.99%。
低白利糖度(0.01512°Brix~1.332°Brix)的糖对L-g-POCM 吸附效果的影响程度遵循以下规律:总糖>果糖>葡萄糖>蔗糖,高白利糖度(10.98°Brix)的糖对L-g-POCM 吸附效果的影响程度遵循以下规律:总糖>果糖>蔗糖>葡萄糖。糖对L-g-TOCF 吸附效果的影响程度遵循以下规律:总糖>葡萄糖>果糖>蔗糖。
原因主要如下:三种糖的浓度不一,葡萄糖最高,蔗糖最低,葡萄糖浓度约为蔗糖的两倍,但L-g-POCM 在高浓度葡萄糖体系中对Pb2+的去除效果更佳;果糖的甜度与粘度均为最高,相对甜度分别为1.5(果糖)、1.0(蔗糖)和0.7(葡萄糖),在糖-铅体系中与L-g-POCM 发挥着竞争吸附作用,从而降低了吸附效率;葡萄糖与果糖互为同分异构体,同属单糖,蔗糖为一分子葡萄糖和一分子果糖组成的双糖,其结构稳定性多强于单糖,因而不易产生竞争吸附。因此,糖对纤维素基吸附剂吸附效果的影响属于较弱的竞争吸附,且对L-g-POCM 的吸附性能所受影响更大。
2.2.3 L-赖氨酸功能化纤维素与单一酸-铅体系
2.2.3.1 L-苹果酸-铅体系 如图9A 所示,L-g-POCM和L-g-TOCF 在不同浓度的L-苹果酸-铅体系下对Pb2+的吸附性能,同一吸附剂在各浓度下的吸附性能存在显著性差异(P<0.05)。pH<5 时,L-g-POCM 的吸附性能被强烈抑制,吸附效率低于10%,最大抑制率为97.14%;L-g-TOCF 仅在0.26 g/L 时被强烈抑制,抑制率为97.11%。L-苹果酸具有较强的酸性和结合能力,从而导致L-苹果酸对两种吸附剂均有很强的抑制性。
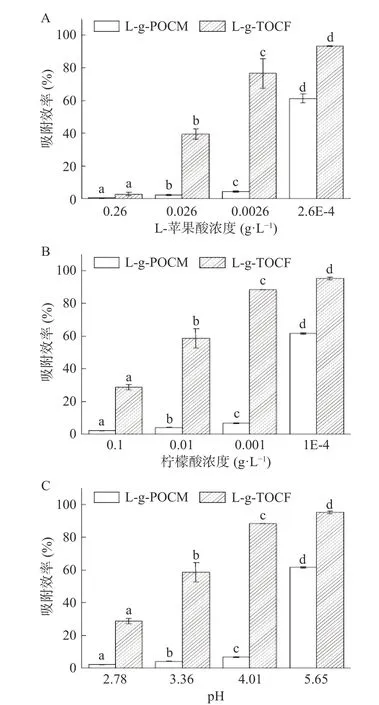
图9 不同条件下的不同有机酸/铅体系对吸附剂吸附性能的影响,Fig.9 Effects of different condition of different organic acid/Pb2+ system on adsorbent properties,
2.2.3.2 柠檬酸-铅体系 如图9B 所示,L-g-POCM和L-g-TOCF 在不同浓度的柠檬酸-铅体系下对Pb2+的吸附性能,同一吸附剂在各浓度下的吸附性能存在显著性差异(P<0.05)。在柠檬酸浓度为0.1 g/L时,L-g-POCM 的抑制率最大,为99.44%;L-g-TOCF的最大抑制率为70.00%,其吸附性能虽被抑制,但可以在柠檬酸浓度为0.01 g/L 条件下时达到有效吸附。柠檬酸对L-g-POCM 的抑制较强,对L-g-TOCF的抑制较弱。
2.2.3.3 有机酸-铅体系 图9C 表现了L-g-POCM和L-g-TOCF 在不同pH 下的有机酸-铅体系下对Pb2+的吸附性能,同一吸附剂在各浓度下的吸附性能存在显著性差异(P<0.05)。在低pH 条件下(pH=3.0),酸-铅体系中L-g-POCM 的吸附效果显著降低(P<0.05),趋近于零,属于极强的竞争吸附作用。L-g-POCM 与Pb2+间的静电吸附作用弱于苹果酸与柠檬酸与Pb2+间的吸引力。有研究表明,苹果酸与柠檬酸也可作为重金属离子吸附剂的基质,其本身对重金属离子便有一定的去除效果。L-g-TOCF 的吸附效果在低pH 条件下也显著降低(P<0.05),但L-g-TOCF 与Pb2+间的静电吸附作用稍弱于苹果酸与柠檬酸与Pb2+间的吸引力,在各有机酸浓度降低时,Lg-TOCF 的吸附性能得到极大的恢复。
酸对L-g-POCM 与L-g-TOCF 吸附性能的影响程度遵循以下规律:总酸>L-苹果酸>柠檬酸。推测L-苹果酸与柠檬酸对吸附剂存在竞争吸附。此外,在低pH 条件下,羧基在高pH(4~6)下脱质子吸附带正电的重金属离子。但当H+的含量过高时,吸附剂难以有效发挥作用[41]。酸-铅体系成酸性,且在高浓度有机酸条件下,pH 为2.78~3.07,酸性较强。在强酸性条件下,H+与吸附剂也存在竞争性吸附。由此可见,H+与吸附位点之间的静电引力高于Pb2+与吸附位点之间的静电引力,吸附剂上的-COOH 结构更加稳定[41]。有机酸对于纤维素基吸附剂吸附效果的影响属于较强的竞争吸附,且L-g-POCM 的吸附效果所受影响更大。
2.2.4 L-赖氨酸功能化纤维素与复合糖-酸-铅体系四个不同条件与上述一致,以TSS 与pH 进行区分,并分别以Ⅰ(TSS:10.98,pH:2.78)、Ⅱ(TSS:1.332,pH:3.36)、Ⅲ(TSS:0.1494,pH:4.01)、Ⅳ(TSS:0.01512,pH:5.65)表示,结果如图10 所示,L-g-POCM 在各浓度下的吸附性能存在显著性差异(P<0.05),L-g-TOCF 在前两个浓度下的吸附性能存在显著性差异(P<0.05)。各条件下的复合糖-酸体系对吸附剂吸附性能的影响程度遵循以下规律:糖/酸>总酸>总糖。在低pH 条件下,L-g-POCM 与L-g-TOCF 对Pb2+的吸附效率分别为0.91%和3.70%,分别仅为单一铅体系最大吸附效率的1.18%和3.85%。主要是因为酸和糖均对吸附剂吸附Pb2+有的竞争作用,复合糖-酸体系强化了竞争作用。但在高pH 条件下,酸性减弱,糖类含量降低,pH 回升至4~5.76,TSS 降低,L-g-TOCF 的表现良好,最高吸附效率为83.71%。
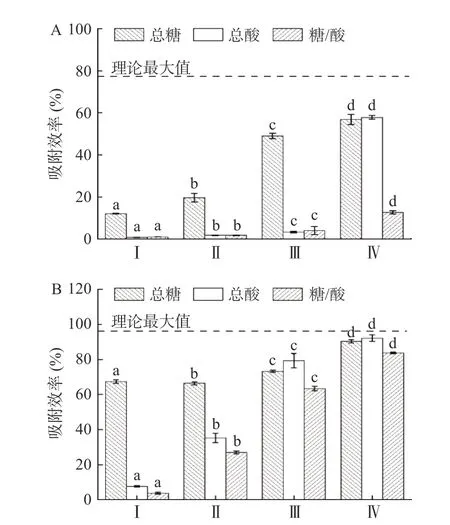
图10 不同条件下的糖-酸-铅体系对吸附剂吸附性能的影响Fig.10 Effects of different dilutions of sugar-acid-Pb2+ system on adsorbent properties of
2.3 模拟苹果汁品质研究
2.3.1 基础指标 为了探究L-g-POCM 和L-g-TOCF在条件Ⅰ、Ⅱ、Ⅲ、Ⅳ下吸附Pb2+后对模拟苹果汁品质的影响,对比了吸附前后模拟果汁的TSS、色值、透光率和pH。由图11 可知,吸附前后,吸附剂的添加对模拟苹果汁的TSS、色值和透光率无显著影响(P>0.05)。
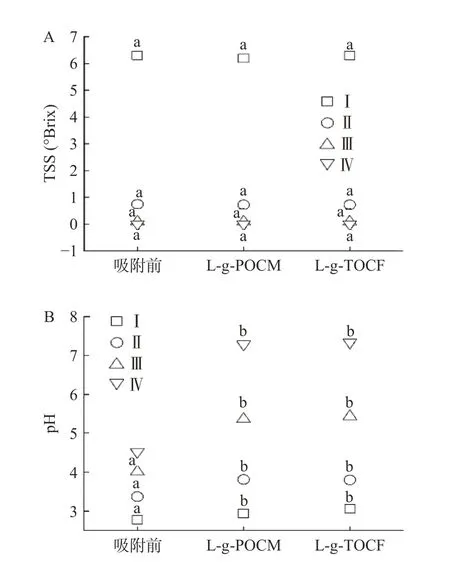
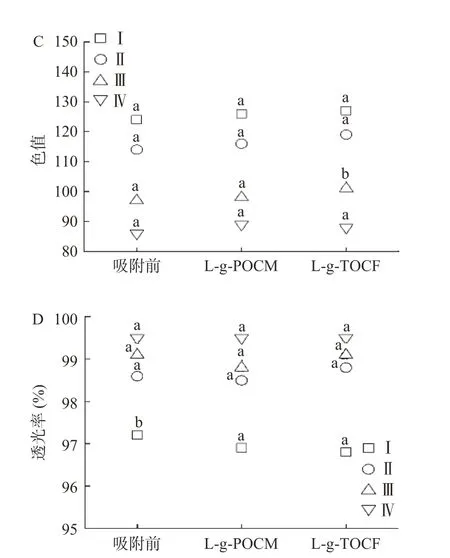
图11 L-g-POCM(0.5 g/L)与L-g-TOCF(3.0 g/L)吸附后对模拟苹果汁中品质的影响,Fig.11 Effect of adsorption of L-g-POCM (0.5 g/L) and L-g-TOCF (3.0 g/L) on quality of simulated apple juice
pH 和TSS 值的变化结果表明吸附前后,在不同条件下,吸附剂的添加对模拟苹果汁的pH 有显著影响(P<0.05)。但对高糖度低pH 的模拟苹果汁种无显著影响(P>0.05),原因如下:a.在高酸性条件下,Lg-POCM 和L-g-TOCF 的吸附性能被抑制;b.L-苹果酸和柠檬酸的在模拟苹果汁体系中较稳定,能够很好的保留在体系中,从而达到不影响苹果汁风味的目的。
2.3.2 吸附稳定性 结果可得,经L-g-POCM 和L-g-TOCF 吸附后的模拟苹果汁中的L-赖氨酸含量分别为4.4 和16.8 mmol L-1,浓度极低,对苹果汁品质的影响较小。图12~图13 分别描述了吸附前后对糖类、有机酸的保留率。
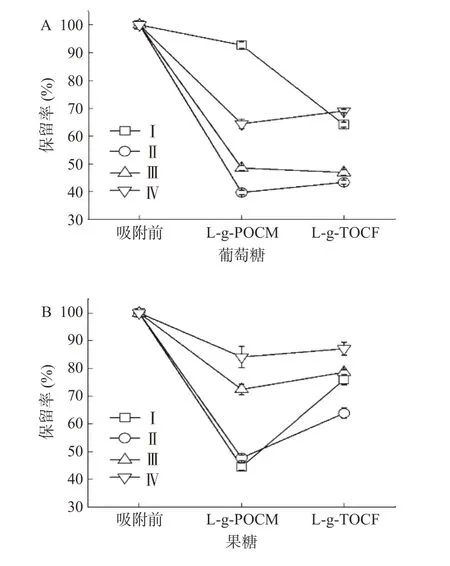
图12 吸附后糖类的保留率Fig.12 Residual rate of sugars after adsorption
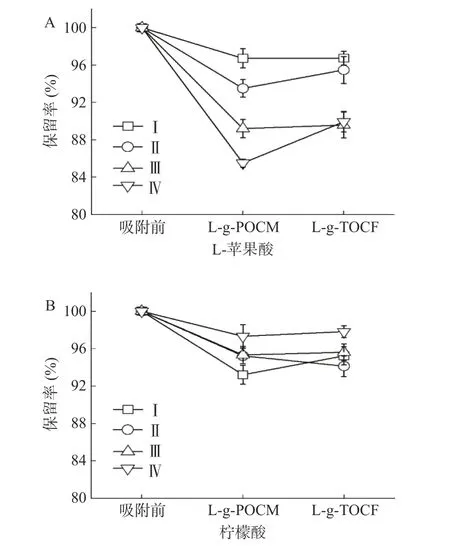
图13 吸附后有机酸的保留率Fig.13 Residual rate of organic acids after adsorption
经L-g-POCM 吸附后,葡萄糖在条件Ⅰ下保留率达92.71%±1.21%,其他条件下保留率减少,说明被吸附到L-g-POCM 表面;蔗糖在各条件下保留率均较高,最高保留率为86.55%±3.15%;果糖在条件Ⅰ和Ⅱ下较易被吸附到L-g-POCM 表面。相比于L-g-POCM,L-g-TOCF 更容易吸附糖类物质,葡萄糖和蔗糖的保留率均低于70%,可能是因为L-g-TOCF 的丝状结构存在对粘性糖类物质的物理吸附作用,因此L-g-POCM 的吸附稳定性强于L-g-TOCF。经L-g-POCM 和L-g-TOCF 吸附后,L-苹果酸在条件Ⅰ、Ⅱ、Ⅲ、Ⅳ下的保留率保持在85.5%~96.74%,柠檬酸的保留率保持在93.21%~97.83%。说明吸附剂本身与有机酸之间没有强的物理或化学吸附作用。
在含糖类和有机酸的体系中L-g-TOCF 的性能远优于L-g-POCM,可以很好地去除低酸类果汁中的Pb2+,比如说香蕉、西瓜、番茄等。两者在高酸类果汁和中酸果汁中的去除仍有所欠缺,在后续的实验中,将关注不同改性纤维素对Pb2+的吸附效果,以期拓宽pH 的适用范围达到更高的吸附效能。
3 结论
以纤维素为基质,绿色、无毒害的赖氨酸为单体,通过自由基聚合反应制成吸附剂,研究了单一铅体系和复合糖/酸/铅体系中吸附剂对Pb2+的吸附效果。在单一铅体系中,不同氧化法制得的L-g-POCM和L-g-TOCF 吸附剂对Pb2+均有良好的吸附效果,L-g-POCM 和L-g-TOCF 分别在含量0.5 和3 g/L 处吸附效率最高。在糖铅体系中,糖对于纤维素基吸附剂吸附效果的影响属于较弱的竞争吸附。在酸铅体系中,有机酸对于纤维素基吸附剂吸附效果的影响属于较强的竞争吸附。糖和酸对L-g-POCM 的吸附性能影响更大。在糖酸铅体系中,糖和有机酸对于纤维素基吸附剂的影响程度遵循以下规律:糖/酸>总酸>总糖。在L-g-POCM 和L-g-TOCF 吸附剂对模拟苹果汁的品质研究中,吸附剂的加入对其TSS、色值和透光率无显著影响。在高浓度条件下,L-g-POCM 和L-g-TOCF 对模拟苹果汁的pH 也没有显著影响,对有机质的影响在可接受范围内。后续实验中,将持续关注吸附剂的安全性和糖类的影响机制研究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

