无功能性胰腺神经内分泌肿瘤临床诊断与手术治疗的研究进展
郭艳,张明,乔建梁,李军,孟兴凯
(1.内蒙古医科大学研究生院,内蒙古 呼和浩特 010050;2.内蒙古医科大学附属医院 肝胆外科,内蒙古 呼和浩特 010050)
胰腺神 经内分 泌肿瘤(pancreatic neuroendocrine neoplasm,pNEN)是一类高异质性的肿瘤,在所有神经内分泌肿瘤(neuroendocrine neoplasm,NEN)占比约为7%,发病率为0.8/10万人[1],在所有胰腺肿瘤中占比更是不到2%。根据肿瘤是否与临床激素高分泌综合征相关可分为有功能性pNEN(functional pancreatic neuroendocrine neoplasm,F-pNEN)和无功能性pNEN(nonfunctional pancreatic neuroendocrine neoplasm,NF-pNEN)两 类,其 中NF-pNEN 占大多数(75%~90%)。不同于F-pNEN 的是,NF-pNEN 临床症状更不典型,起病隐匿且异质性高,在早期即可发生转移,预后随着疾病的分期存在较大差异。近年来随着影像技术的进步其检出率明显增加,但由于其异质性和少见性的原因,仍存在大概率的漏诊和误诊情况,对其进行精确诊断和治疗在目前尤为迫切。为此本文回顾国内外相关文献,就NF-pNEN 的诊治进展中存在的争议性问题进行综述,以期为临床决策提供参考。
1 诊断方法
1.1 分期
诊治疾病应先了解其分期、分级,关于pNEN的分级和分期,世界卫生组织(WHO)2017 年分类系统和美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8 版分期是目前临床医师广泛参考和认可的,同时也出现在各类指南中[2-3]。通过对比发现,最新的WHO 2017 版分类系统在2010 版的基础上,对形态分化良好但增殖指数在G3 范围内的肿瘤引入了“净G3”的定义,强调pNEN 可分为神经内分泌瘤(neuroendocrine tumor,NET)和神经 内分泌 癌(neuroendocrine carcinoma,NEC)两类(表1)。其更加标准、量化地分类为临床评估提供了准则。而在第8 版AJCC分期中,G3 没有被列入其中,这也反映了NEN 与外分泌肿瘤有着不同的肿瘤生物学和预后[4]。但与第7 版AJCC 分期和欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society,ENETS)TNM 分期相比,第8 版AJCC 分期反而具有更好的鉴别力和可靠性,并已在多项研究中得到了验证[5](表2)。因此,在临床分期中可依据以上系统进行评估。不足的是,pNEN 往往不伴有腹腔或肠系膜血管的侵犯,因此采用学者提出的改良分期标准(mENETS)能够更好地适应临床实践[6],因为根据淋巴结转移情况来评估手术治疗范围更为精确,也能更好地评估和改善预后(表3)。除此之外也可根据其他模型对患者的预后进行评估,以促进pNEN 的个体化治疗[7]。
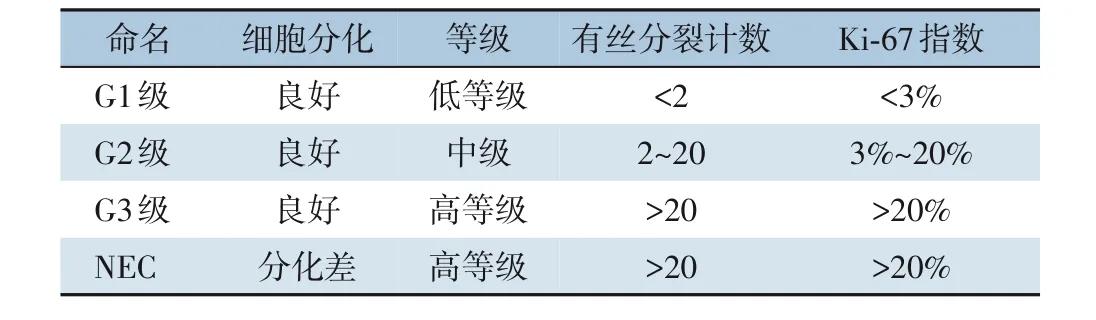
表1 WHO 2017 NEN分类和分级Table 1 WHO 2017 classification and grading criteria for NEN

表2 AJCC(第8版)和ENETS分期系统Table2 Staging criteria of AJCC (8th) and ENETS
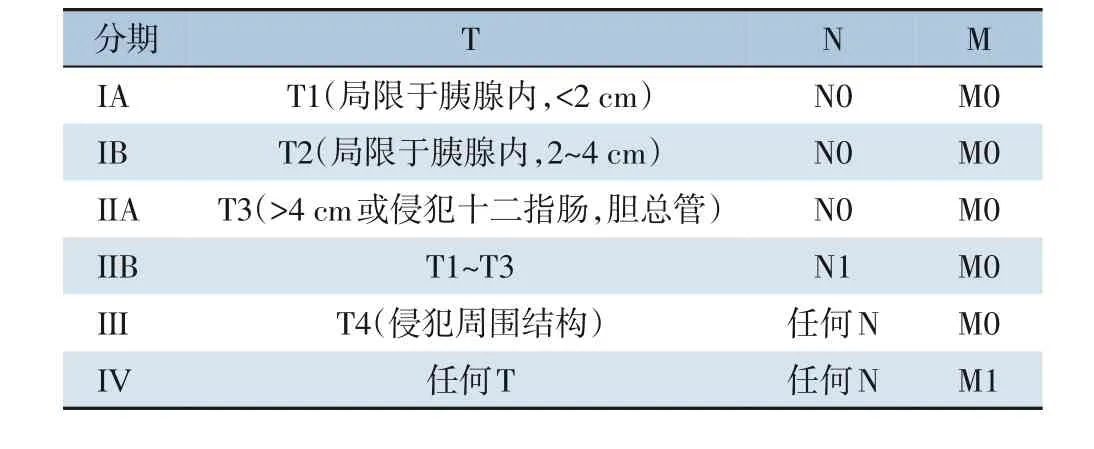
表3 mENETS分期Table 3 mENETS staging
1.2 临床症状
依靠临床症状进行判断是诊断疾病首要且重要的一步。复杂的是不同于F-pNEN,NF-pNEN 虽也可以合成肽,但它们不会产生症状或特定的综合征,因此NF-pNEN 的临床表现多不典型。研究者发现多数患者在达到显著的肿瘤负荷之前通常无症状,只有当肿瘤压迫周围邻近器官时才会出现相应的表现,如非特异性腹痛、早期饱腹感、肠梗阻或梗阻性黄疸等晚期表现,且这通常与群体效应有关。在为数不多的一项前瞻性、多中心的大样本研究中,Zerbi 等[8]通过对297 例患者进行分析后也证实了这一结论,其结果显示约一半的患者在体检中被偶然发现,且恶性形式比F-pNEN更常见。一旦肿瘤发生转移,它们通常又是多灶性的,多位于肝脏,但也可观察到其他转移部位,如肺、骨、腹膜、肾上腺、大脑和脾脏。此时患者会产生相应部位的不适,如肾区疼痛史等,通过询问病史可辅助判断疾病。综上可见,通过临床症状来确诊NF-pNEN 具有一定可行性,但基于疾病本身的性质,其适用性和发现率仍存在明显局限性,需要其他方法配合诊断。
1.3 CT和MRI
在过去数十年的诊疗中,CT 在诊断可疑性pNEN 具有良好的敏感度、特异度和可用性,被认为是pNEN 的首选影像检查。研究发现对比增强CT在检测>2 cm 的pNEN 具有高 敏感度,可 达63%~82%,特异度范围甚至可达83%~100%[9]。然而近年来MRI 越来越多地补充和代替了CT 检查。一项包括30 例NEN 肝转移患者的回顾性研究[10]显示,与传统CT 相比,MRI 在检测NEN 肝转移方面远优于CT,尤其是扩散加权成像可能是监测NEN大小变化的最可靠的MRI 序列。另一项研究[11]也取得了类似的结果,早期全身弥散加权MRI 有助于预测NEN 受放射性核素治疗后的长期结局。但是,这几项实验具有几个局限性:⑴ 样本量有限,因为受实验预算、纳入标准和随访要求限制;⑵ 回顾性数据分析后获得的结果可能无法推广到其他机构的数据中;⑶ 操作由不同经验水平的医师进行,不能代表常规的实际实践。基于这些研究笔者发现,CT 和MRI 在诊断小的pNEN 病变和确诊是否发生肝转移中都存在局限性,尤其对于一些转移较快的患者,二者均不能及时准确地发现病灶。虽然传统的影像检查不能在短时间内被替代,但有必要进行联合检查来提高临床确诊率。
1.4 超声内镜技术(endoscopic ultrasound,EUS)
在提高pNEN 检出率和明确术前分期方面,研究者发现EUS 对诊断pNEN 的敏感度可高达80%[12]。同时对直径≤2 cm 的病变更为敏感,甚至可以发现直径<0.5 cm 的微小病变。在发现可疑病灶时,亦可作进一步的细针活检(endoscopic ultrasoundguided fine-needle aspiration,EUS-FNA)及血管造影强化的内窥镜帮助明确病变性质。此外,在一项前瞻性研究中,Choi 等[13]通过对33 例有40 个病理证实的pNEN(直径<2 cm)的患者进行观察后证实,EUS 在治疗疾病方面亦有重要作用。其结果显示被纳入的40 个肿瘤中有24 个(60%)通过EUS注射乙醇混合物实现了完全消融。笔者认为,在患者接受的情况下进行EUS-FNA 是提高临床确诊率的有效方法。但从胰腺本身的解剖结构来看,EUS-FNA 的操作难度较大,对医师的技术水平具有较高要求,在临床实践中应根据操作团队的习惯和管理经验安全进行。
1.5 PET/CT
由于检测NF-pNEN 时可过度表达生长抑素受体,因此生长抑素受体核素显像酶(somatostatin receptor scintigraphy,SRS)可提供另一种诊断途径[14]。但低分化的pNEN 由于表达低水平的生长抑素受体通常无法被检测到。有学者提出结合PET扫描可以很好地解决此类问题。2020 年,Ghobrial等[15]根据对114 例NEN 患者进行PET/CT 评估来管理病情变化,结果显示,114 例受试者中的54 例(47.37%)没有变化;6 例(5.26%)发生了小幅改变(额外影像学检查);54 例(47.37%)发生了重大管理变更(手术、化疗等)。另一项类似的研究[16]证实,结合镓-68 生长抑素受体的PET 成像更为准确,能够改变1/3 患者的诊断和管理。而Squires 等[17]却发现,与PET 相比SRS 扫描能更好地检测分化良好和1 级的NEN,PET 则对低分化和3 级NEN 的敏感性更为优越。基于以上数据认为,考虑到肿瘤级别的不同,在初期筛查中如何选择扫描方式仍难以定论,日后还需要更多的多中心前瞻性实验来研究验证。
1.6 生物化学检测
除了形态学成像,嗜铬粒蛋白 A(chromogranin A,CgA)和神经元特异性烯醇化酶(neuron-specific enolase,NSE)被认为是诊断pNEN的常用标记物,尤其对无症状的NF-pNEN,这无疑是一种快速、有效的选择。但Yang 等[18]发现,CgA 虽然敏感、高效,但在各种特定条件下会升高,包括神经内分泌、心脏、肾脏和炎症性疾病,以及一些药物质子泵抑制剂,这可能会对整体诊断效率产生影响。反之,也有研究证实NSE 的敏感度低至30%~40%,但特异度几乎为100%,可被用于区分网状肿瘤和NF-pNEN。但二者的具体适用范围目前尚无定论。笔者认为,联合使用CgA 和NSE 可有助于提高NF-pNEN 的检出率,也有必要探索更适用的标志物如胰抑素和生长抑素受体等[19-20]。此外,在评估疾病真实范围和肿瘤分级方面,配合应用术中超声、冷冻和术后病理技术,可帮助临床医师明确病灶性质,助益疾病诊治。之前笔者中心的一项回顾性分析[21]也得出,结合实验室和影像学检查有助于该病的诊断,提高治愈率、改善患者生活质量和预后。
2 手术治疗
2.1 手术时机
如何把握NF-pNEN 的手术指征和时间,一直是外科医师关注的焦点。长期以来大多数专家主张对所有病变进行手术切除[22]。然而由于胰腺手术较高的发病率和病死率的风险,因此需要仔细权衡获益和风险间的关系。在尽可能保留胰腺功能的手术时代,手术指征应与手术策略和手术时机问题相结合。目前手术治疗的争议主要集中在2 cm 以下的NF-pNEN。越来越多的证据支持对于≤2 cm 的散发性NF-pNEN 可暂行随访监测[23-25]。Sallinen 等[26]对210 例NF-pNEN 患者进行了随访分析,结果表明,肿瘤大小≤1 cm 在3 年随访中无疾病发现;>1~2 cm 肿瘤患者的1、3、5 年无病生存率分别为95.1%、91.0%、87.3%,由此认为胆道、胰管扩张或WHO 建议的2~3 级NF-pNEN 患者可行手术治疗,其余患者随访观察。这一结论也在欧洲指南中得到了支持[27]。同年Partelli 等[28]也证明了对选定患者进行监测的安全性。基于以上研究可认为对≤2 cm 的NF-pNEN 进行随访监测是可行的。但对于具体的肿瘤大小还存在诸多争议。Shatveryan 等[29]对21 例NF-pNEN 患者分析后认为阈值肿瘤尺寸应为1.5 cm。但由于研究的基数较少,目前临床医师多采用2 cm 的划分标准。此外,尽管可以随访监测,但这些肿瘤仍存在恶变的可能,支持安全观察的随访时间较短。尤其是年轻的患者,最佳的随访时间尚未得出准确结论。根据肿瘤位置的不同,有学者[30]发现胰体尾部的肿瘤更易发生转移,肿瘤级别更高,发病年龄也更小。据此,笔者综合国内外文献认为,对胰体尾部<2 cm的肿瘤进行活检是十分必要的。胰头部的肿瘤可依据上述研究观察随访。对NF-pNEN 患者的随访时间可以3~6 个月为宜,年轻的患者可缩短至每个月1 次,可暂不行预防性手术。然而,对于手术指征的把握,除肿瘤大小之外,还应考虑肿瘤的数量、胰腺功能的保留、术后并发症的发生情况、肿瘤与主胰管及周围的关系等因素[31],从而实现患者获益最大化。一项荷兰的研究[32]发现除了肿瘤大小,多数病例肿瘤具有侵袭性,因此对于小型pNEN 应考虑其转移能力。
2.2 手术策略
根据肿瘤的大小和位置,术式选择包括胰十二指肠切除术、胰体尾切除术、全胰腺切除术、肿瘤剜除术等。关于选择何种术式多数专家认为,对于那些有症状、局部分化良好、肿瘤距主胰管距离>3 mm 的患者,根据肿瘤位置采取保留胰腺实质的术式如剜除术和胰体尾切除术,以能够尽可能地保留胰腺的分泌功能,降低术后分泌功能不全的发生率[33]。对直径≥2 cm 的NF-pNEN,目前认为超过50%的肿瘤已经发生了淋巴结转移,需选择胰十二指肠切除术或带淋巴结切除术的远端胰腺切除术或全胰腺切除术。如肿瘤位于胰腺体部或尾部,则根据脾血管系统与肺门的关系,行保脾远端胰腺切除术[34]。然而不同术式间的整体获益情况还有待进一步验证。Finkelstein 等[35]分析显示,肿瘤剜除术与标准切除术相比,虽可获得更短的手术时间、更少的失血量,但术后胰瘘的发病率更高。
在超过20%的患者中,pNEN 被诊断为区域淋巴结转移,与局限于胰腺的疾病相比存活率更低。术中是否进行常规淋巴结清扫以及清扫范围和指征目前尚无统一共识。有研究[36]认为,淋巴结受累是可靠的预后不良迹象,淋巴结切除术被认为应执行在所有病例的标准术式中。但也有研究支持<2 cm 的病灶术中难以进行充分的淋巴结清扫,应该根据病理学分级或对淋巴结进行评分综合判断。Alexandra 等[37]通过对695 例pNEN 患者回顾分析,结果显示,只有9%的患者淋巴结阳性,因此可根据术前创建的淋巴结风险评分来指导手术策略。许文彦团队[38]探讨了淋巴结转移在NF-pNEN中的治疗意义发现,肿瘤直径>3 cm 和病理低分化是NF-pNEN 患者淋巴结转移的独立危险因素,此类患者预后差,建议行包含区域淋巴结清扫的根治性切除。总体来看,R0切除并进行淋巴结清扫是有利的。在清扫范围方面,Lopez-Aguiar 等[39]认为至少应切除7 枚淋巴结才能有效识别转移提高无复发生存期。Ding 等[40]则认为对于NF-pNEN 淋巴结清扫范围在20 枚以上才能达到阳性淋巴结识别度。目前关于这一问题仍缺乏高级别证据,笔者认为,不论何种术式都应尽可能地进行详尽的淋巴结清扫来排除复发转移的可能。
综上研究,在临床工作中根据患者疾病情况和获益风险平衡来个性化制定手术方式是行之有效的。在以根治为基础的前提下,对局部浸润和周围的淋巴结进行清扫是改善预后的关键。随着微创技术的进步,该手术也可采用腹腔镜或机器人的方式,在症状控制、去瘤存活的同时也能减小创伤、缩短患者的住院时间。
2.3 肝转移的NF-pNEN的治疗
尽管NEN 具有惰性,但45%~90%的患者在患病过程中会出现肝转移。患者会出现继发于肝脏病变的全身症状,降低其生活质量和预后。虽然手术治疗已被接收为唯一潜在的治愈选择,但关于手术有效性的争议仍然存在。根据ENETS 指南建议,在没有腹外疾病的情况下,如有可能进行根治性切除(肿瘤切除率>90%),建议积极采取手术治疗。Saxena 等[41]也证实了5 年接受肝切除术治疗的患者的存活率可能高达60%。相比之下,对存在肝转移、肿瘤分级为G1~G2、综合状态良好的患者,多数研究[42-43]支持位于胰头的肿瘤引起的并发症(如黄疸)的管理无需手术,位于胰体尾部的患者对原发肿瘤进行姑息性切除会获得更好的生存获益。笔者认为,由于前瞻性随机对照试验的难以进行,手术治疗NEN 肝转移的争议将持续存在。不同治疗之间的选择偏倚如肿瘤负荷、患者的全身情况等,均会使肝切除术对患者长期预后的影响难以评估。
对于转移灶弥漫分布于肝脏两叶、无法切除的Ⅲ型肝转移患者,如果原发灶不能完整切除,单纯切除或减瘤肝脏转移灶可能是无效的。但多数研究[44-45]认为,这部分患者虽然已错过了有效的根治性切除阶段,但手术仍然在他们的治疗中发挥着核心作用。Chawla 等[46]通过对4 038 例合并转移的pNEN 患者进行分析后得出,与不切除肿瘤相比,原发性肿瘤或转移性疾病的切除均显著改善了总生存时间。从疾病分期的角度来看,低级别、G3 期、分化良好的pNEN 患者手术的作用效果仍存在探索。Deng 等[47]分析了150 例接受切除术的胰腺神经内分泌瘤(pancreatic neuroendocrine tumor,pNET)患者的临床资料,发现在没有症状的情况下,根治性切除术可用于表现良好、级别较高(G2 或更高)的患者。在Moris 等[48]的研究中,肝移植可能为弥漫性肝转移患者提供生存益处,但需严格选择患者,把控手术条件。在肿瘤特点的限制下,刘俊等[49]肯定了姑息性切除后加以术后辅助放化疗的效果。对于失去根治性手术治疗的患者,术后积极应用内科药物如生长抑素类似物、分子靶向药物和细胞毒化疗药物治疗尤为重要[50]。
3 总结与展望
综上所述,NF-pNEN 起病隐匿,预后差异大。在无明显临床体征的限制下,初始病情检查应包括全身增强CT,以评估肝脏负荷,根据肝脏浸润模式对患者进行分类,并检测肝外疾病。如考虑对患者进行肝切除术,应进行肝脏MRI 检查。在影像学基础上加以实验室和PET/CT 能够进一步明确诊断和排除全身转移的可能。在治疗方面,外科手术仍是治疗此类肿瘤的首选方法,即使是发生了肝转移,姑息性手术也有一定效果。除非发生了高级别的G3 期转移才采用辅助治疗,个性化治疗尤为重要。当然,手术治疗的前提是对患者的随访时间进行严格把控。针对不同人群制定不同的随访时间,以防止错过最佳的治疗时间。肿瘤分期、分化程度、病理分型、手术切除等都可能是影响生存和预后的重要因素。鉴于NF-pNEN临床发病率低,其规范、有效、及时的诊断和治疗有待于更多病例的积累和长期随访的结果。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:郭艳、张明主要负责文章撰写;乔建梁、李军、孟兴凯主要负责对论文内容的修改和审校。

