胰腺神经内分泌肿瘤诊疗现状
何达,宋彬
(中国人民解放军海军军医大学第一附属医院 肝胆胰脾外科,上海 200433)
神经内分泌肿瘤(neuroendocrine neoplasms,NEN)是一类高异质性肿瘤,起源于肽能神经元和神经内分泌细胞,具有表达神经内分泌标记物的能力。在过去很长时间,NEN 一直被认为是一种罕见病,但随着人们生活方式的改变和健康意识的增强,NEN 的发病率和检出率逐年升高,1973—2012 年,发病率增加了6.4 倍,达到每年6.98/10 万人[1]。由于其高异质性,NEN 可发生在全身多处不同组织器官,包括胃肠道、肺部、支气管等。其中,胰腺是我国NEN 最好发部位,研究也相对更多。鉴于此,笔者结合中国人民解放军海军军医大学第一附属医院胰腺外科多年的诊治经验和国内外最新研究进展对胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNEN)的分级诊断与治疗策略进行介绍。
1 pNEN的分级标准
NEN 的分级系统主要为世界卫生组织(WHO)病理分级与TNM 分级两大类,两者均在经过多次校订后如今已趋于完善。
1.1 病理分级
2000 年,WHO 首次将NEN 分为三类:高分化内分泌肿瘤(类癌)、低分化内分泌癌以及外分泌-内分泌混合性肿瘤。直到2010 年,WHO 取消了“类癌”的描述方式,采用“神经内分泌”以更好地描述该类肿瘤的细胞来源,并引入了更为广泛的 胃肠胰 神经内 分泌肿 瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NEN)分类系统,根据肿瘤的增殖指数Ki-67和有丝分裂计数将其分类为1、2 级:神经内分泌瘤(neuroendocrine tumor,NET),3 级:神经内分泌癌(neuroendocrine cancer,NEC)。此次分级系统综合了原有的组织病理学分级与TNM 分级,肿瘤的转移播散程度也将影响肿瘤的最终评级[2]。
然而之后几年的研究发现该标准中对3 级NEN的定义过于宽泛,有两组预后明显不同的NEN 同时被分到了3 级。2017 年,WHO 再次对该分级系统进行更新,进一步将3 级NEN(Ki-67>20%)划分为分化良好的3 级NET 与分化差的NEC(表1)。另外,此次修订还重新定义了混合性腺神经内分泌癌,将这种具有非内分泌癌(主要是导管腺癌或腺泡细胞癌)和NEN 合并成分的肿瘤称为混合性内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasms,MiNEN)。新概念的提出是因为学者们发现,并非所有MiNEN 都是恶性程度很高的癌,少数MiNEN 可能属于分化良好的肿瘤类别:内分泌成分可能为NET,非内分泌成分也可能不是腺癌,例如鳞状细胞癌或腺泡细胞癌[3]。这些改动首先应用于胰腺NEN 且得到认可,并在2019 年扩展到胃肠、胰腺NEN,并沿用至今。
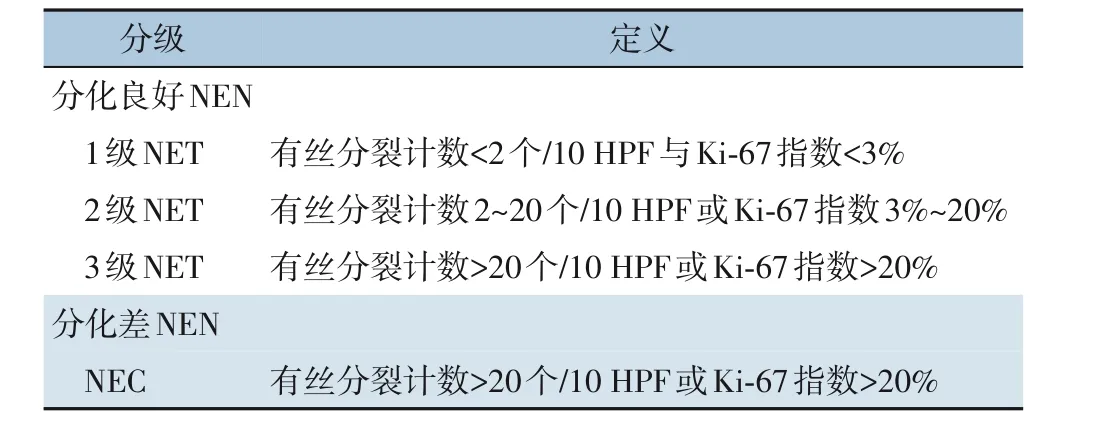
表1 WHO 2017版NEN病理分级系统Table 1 WHO 2017 edition histopathological grading system for NENs
1.2 TNM分级
NEN 的TNM 分级标准由欧洲神经内分泌肿瘤学会(ENETS)于2006 年首次提出。此后,Fischer等[4]对这种新分级标准进行了临床评价相关研究后,肯定了TNM 分级的临床相关性。2007 年,美国联合癌症委员会/国际癌症联盟(UICC/AJCC)指南第7 版也提出了一套与ENETS 分级系统类似的TNM 分级系统。ENETS 与UICC/AJCC 两种分级系统的主要差别在于对T 期的定义。AJCC 第7 版采用胰腺腺癌分期系统,强调肿瘤累及关键血管(T4)而非其他结构和淋巴结来定义Ⅲ期;而ENETS 分期系统将T4 重新定义为累及任何邻近结构,Ⅲ期重新定义为T4(ⅢA)或局部淋巴结累及(ⅢB)。
此后数年,对于ENETS 与AJCC 两种分级系统孰优孰劣的争论一直存在,并最终证明两者都存在缺陷。2017 年,Luo 团队[2]采用SEER 数据库(n=2 529)和多中心研究队列(n=1 143)对ENETS 和AJCC 分期分类的应用进行分析,阐明了两种分级系统中各自的不足之处,并在此基础上提出了一种新的改良ENETS 系统—mENETS,在保持ENETS 系统TNM 定义的情况下,采用了部分AJCC的分期定义。
而在之后公布的AJCC 第8 版中(表2),参考了mENETS 系统,修订了之前的不合理之处,同步了ENETS 系统的分期标准,取消了胰周软组织侵犯的标准,也主要根据大小进行分期,以区分良性NET[3]。新修订的分级系统还推荐增加了一个新的N2 类别,定义为累及≥4 枚局部区域淋巴结[5]。这也是目前推荐使用的TNM 分级系统。
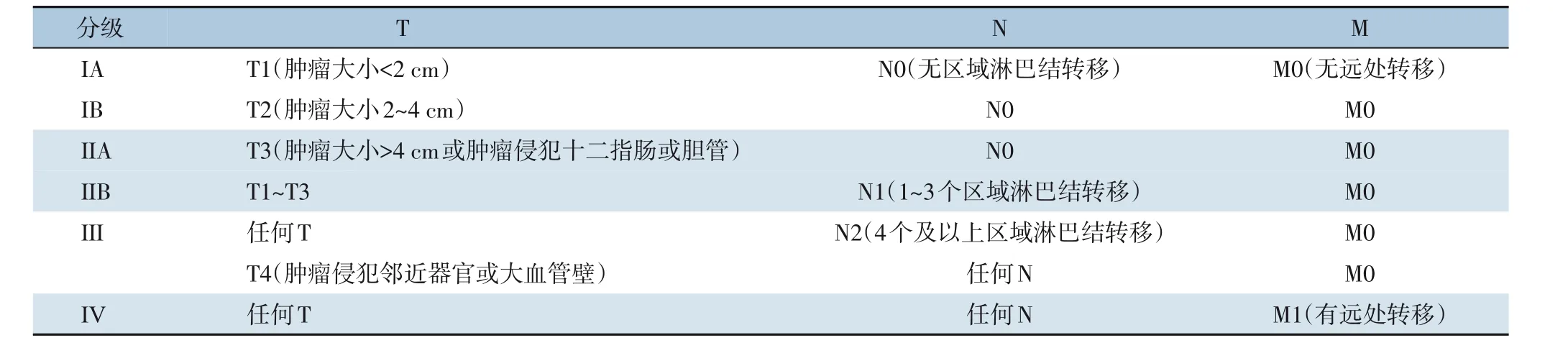
表2 NEN TNM分级系统(AJCC第8版)Table2 TNM grading system for NENs (AJCC 8th)
2 pNEN的诊断
2.1 组织病理诊断
低级别NET(1、2 级)细胞通常表现为类器官结构,有时也可能呈小骨、腺状、管泡状等形态;细胞核圆,胞质细粒状,染色质点缀呈经典的“盐和胡椒”形态。高级别NET(3 级)的形态特征与低级别NET 类似,主要区别在于其有更高的有丝分裂活性和增殖指数Ki-67。极少数情况下高级别NET 不表现经典的“盐和胡椒”染色质,而表现出明显的核多形性、弥漫性浸润和坏死,与NEC 难以区分,这就是为什么在具有高级特征的NEN 中可能需要辅助鉴别的原因。
2.2 生物标志物
2.2.1 嗜铬粒蛋白A(chromogranin A,CgA)CgA 是目前NEN 最常用的生物标志物,是一种在神经内分泌细胞中发现的糖蛋白,早在30 年前作为生物标志物被引入,特异度为10%~35%,敏感度为32%~92%。CgA 在萎缩性胃炎、肾功能不全、动脉高压、应用质子泵抑制剂等多种情况下可能出现假阳性升高,不建议作为筛查工具,而可用于治疗反应和诊断后的监测。先前研究[6]表明,CgA 与肿瘤大小和预后相关,但现在认为这一观点存在争议。
2.2.2 5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)5-HIAA 是一种血清素代谢的产物,可在血浆和尿液中检出。该类标志物对类癌综合征患者尤其敏感,尿5-HIAA 升高对存在类癌综合征的NEN 的敏感度为70%,特异度为90%~100%;然而,在没有类癌综合征的情况下,该生物标志物的敏感度低至35%[6]。
2.2.3 胰岛素瘤相关蛋白1(insulinoma associated protein 1,INSM1)INSM1 是一种新发现的神经内分泌标志物,与传统神经内分泌标志物突触素、嗜铬蛋白A 和CD56 相比,特异度更高(95.7%vs.86.0%、87.3%、86.0%),但敏感度较低(80.9%vs.99.1%、88.0%、95.3%)[7]。
鉴于传统单分析物标志物的各种局限性,近年来学者研究了多分析物的方法来提高生物标志物的准确性并与组织表达相关,其中以神经内分泌基因转录分析(NETest)技术最为成熟。NETest利用聚合酶链反应(PCR)检测了51 个NEN 的转录组特征,是首个NEN 液体活检。目前已有多项研究[8-10]证明,NETest 相比传统单分析物标志物更具优势,具有较高的敏感度(>95%)和特异度(>90%)[11],且不受质子泵抑制剂影响。尽管如此,NETest 仍不推荐用作筛查工具,有研究[12]将诊断为GEP-NEN 的患者与健康人群进行比较,发现NETest 的特异度低于CgA(56%~72%vs.83%),且与肿瘤分级无关。而除此之外,NETest 在识别早期疾病进展、评估治疗反应和评估手术切除是否完全方面的应用还是大有前景[13]。
2.3 常规影像诊断
常规影像主要是计算机断层扫描(CT)和磁共振成像(MRI),对于GEP-NEN 的定位、表征和分期诊断十分重要。其中多期CT 静脉造影有助于提高诊断率,因为NEN 原发灶与转移灶都表现为血管增生,于动脉晚期强化明显;而MRI 对肝脏、胰腺等部位的病变更为敏感,因此在诊断pNEN 与肝转移时更为适用。
此方向较新的进展是关于利用钆塞酸二钠(一种肝胆排泄造影剂)增强MRI 评估GEP-NEN 肝转移[14-16],其在增强MRI 弥散加权期和肝胆期对NEN 肝转移的诊断率最高,敏感度为86%,特异度为94%[16]。这些研究表明这类肝脏靶向造影剂增强MRI 在评估肝转移的NEN 时具有优势。
2.4 分子影像诊断
生长抑素受体闪烁成像自20 世纪以来就已被用于评估GEP-NEN,早期人们使用111In-pentetreotide与68Ga-DOTA-TOC 放射性标记生长抑素类似物(somatostatin analogue,SSA),而近年来开发了更多诸 如68Ga-DOTA-NOC 和68Ga-DOTA-TATE 的GEP-NEN示踪剂。2016 年的两项研究[17-18]证明了68Ga-DOTATATE 相比111In-penteotide 在原发灶与转移灶的鉴别上都更具优势,并改变了33%~36%的GEP-NEN 患者的治疗方法。除此之外,2021 年一项针对GEP-NEN 的研究[19]还前瞻性地比较了PET/MRI 采用68Ga-DOTA-TOC和PET/CT 采用68Ga-DOTA-TOC的效果,证明了前者在对所有病变的检测中均优于后者。
除了SSA 外,18F-FDG 这类葡萄糖类似物成像同样重要。18F-FDG 能显示肿瘤中葡萄糖转运体的水平,与肿瘤分级直接相关,相关研究[20-22]表明,18F-FDG 摄取程度可用于区分1 级/2 级和3 级肿瘤,且与预后密切相关。
与生长抑素受体闪烁成像相比,低级别NEN(1、2 级)表达 高水 平的生 长抑 素受 体(somatostatin receptor,SSTR),代谢活性较低,因此,SSA 在低级别NEN 的功能成像方面优于18F-FDG。高级别NEN(3 级)和NEC 倾向于具有更高的葡萄糖代谢率和较低的SSTR 表达。因此,18F-FDG 在高级别NEN 的功能成像方面优于SSA。
2.5 内镜诊断
内镜超 声(endoscopic ultrasonography,EUS)用于评估胃肠道肿瘤,包括GEP-NEN 已有几十年的历史。EUS 的优势在于能清晰显示胃肠道与邻近组织器官的结构层次与组织学特征,是食管、胃、十二指肠、胰腺和直肠NEN 局部期的首选诊断方法,尤其对于pNEN 的检出率可达86%,准确率高达98%。除此之外,EUS 还能通过细针抽吸抽取组织进行细胞学和分子分析,并为不适合手术的患者放置射频消融探头。2021 年的一项研究[23]比较了EUS-FNA(细针抽吸)和EUS-FNB(细针穿刺活检)的诊断准确性,发现EUS-FNB 对胰腺NEN 的诊断可能优于EUS-FNA,与手术标本中增殖指数Ki-67 有更好的相关性。
3 pNEN的治疗方案
pNEN 患者具有临床表现多样化、个体差异大的特点,其治疗策略也因肿瘤的病理分级、临床分期、肿瘤负荷、有无功能等而不同。
3.1 药物治疗
3.1.1 SAA超过90%的高分化pNEN 表达SSTR,因此使用SSA 治疗对pNEN 足够有效。SSA 是目前控制激素症状的一线药,临床上主要使用两种长效SSA:长效奥曲肽和兰瑞肽。两种药物对SSTR 2 型和SSTR 5 型均有较强的亲和力,其半衰期比皮下给药的标准奥曲肽长,且无反弹性高分泌[24]。相关研究已证明SSA 对控制症状的有效性[兰瑞肽治疗后74.2%(61.9%~92.8%)GEP-NET 患者症状缓解[24]],且对pNEN 的增殖也有抑制作用[奥曲肽组比对照组中位无进展生存期(progression free survival,PFS):14.3 个 月vs.6.0 个 月,HR=0.3,P<0.000 1[25]]。另有一项前瞻性Ⅱ期研究[26]表示,中肠和胰腺NEN 在标准剂量兰瑞肽治疗进展后将兰瑞肽增量,可以分别再获得8.3 个月和5.6 个月的中位PFS,Ki-67≤10%者获益最大,且增量后的不良反应与标准治疗类似。
以往认为,SSA仅适用于低级别NET(1、2级),然而,近年来多项研究[27-28]支持将SSA 应用于SSTR阳性3 级NET(中位PFS:4~8 个月)。北美神经内分泌肿瘤学会(NANETS)[29]认为,在生物学良好的3 级NET 患者中,SSA 治疗作为肿瘤控制的初始一线治疗是合理的。
3.1.2 干扰素(interferon,IFN)IFN 的作用与SSA 类似,但激素症状控制效果更差,耐受性有限,副作用也更严重,包括流感样症状、疲劳、抑郁、骨髓抑制、甲状腺功能减退和肝毒性。因此IFN 目前仅作为二线药物,在针对难治性类癌综合征时可与SSA 联合用药。
3.1.3 靶向药物GEP-NEN 的靶向药物主要是针对胃肠道产生的各种生长因子,以及这些因子和其他因子的表达受体。目前常用的靶向药物包括:血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)抑制剂、哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)抑制剂、酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)等。
VEGF 抑制剂代表药物为贝伐珠单抗。目前资料[30]表明,VEGF 抑制剂在各种恶性肿瘤中高表达是一个负面的预后因素,表现在与微血管密度增加、转移发生率增加、肿瘤进展以及中位PFS 缩短有关,因此这类药物对恶性肿瘤普遍可用,包括NEN。
mTOR 抑制剂代表药物为依维莫司,可抑制mTOR 在pNEN 细胞中受到胰岛素样生长因子-1 刺激后发挥的增殖作用。在RADIANT-3 试验[31]中,依维莫司组晚期胰腺NET 患者中位PFS 明显延长(11.0 个 月vs.4.6 个月,HR=0.35);RADIANT-4 试验[32]中,与对照组相比,依维莫司组晚期无功能胃肠道和肺部NET 患者的中位PFS 同样延长(3.9 个月vs.11 个月,HR=0.48)。
TKI 代表药物为舒尼替尼与索凡替尼,其中舒尼替尼为经典药物,而索凡替尼为新型药物。多项研究证明了TKl 的抗肿瘤作用,其中一项Ⅲ期临床试验[33]中显示,舒尼替尼显著延长中位PFS(11.4 个月vs.5.5 个月,HR=0.42,P<0.001);另一项针对索凡替尼的Ⅲ期临床试验[34]显示,索凡替尼组PFS 同样延长(13.9 个月vs.4.6 个月,HR=0.34,P<0.000 1)且客观缓解率(objective remission rate,ORR)显著提升(19%vs.2%,P=0.002 1),并在大部分亚组中都表现出优势,证明了索凡替尼的良好疗效,并取得靶向药物里最高ORR 达19%。
靶向药物目前仅用于分期较晚,病程较晚的患者,由于尚缺乏有效的生物标志物来指导用药原则,故临床上主要结合患者的基础疾病以及药物的不良反应来反向选择个体化用药。
3.1.4 化疗对于低级别NET,大多数化疗方案的治疗效果有限,不推荐优先选择,仅在肿瘤负荷大,快速进展,Ki-67 指数水平较高(>15%),SSTR 阴性且其他方案均失败情况下才谨慎考虑。以链脲霉素(STZ)为基础的化疗方案被认为是目前最有效的选择,其次可选择CAPTEM(卡培他滨联合替莫唑胺)或FOLFOX(氟尿嘧啶、亚叶酸钙和奥沙利铂)。
而对于3 级NET,目前尚无统一标准,铂类药物的疗效受到肿瘤分化程度的影响,对Ki-67<55%的NET 敏感度较低(ORR 为15%),而对Ki-67≥55%的NET 敏感度更高(ORR 为42%)[35-37]。因此,对Ki-67<55%的3 级NET 患者,铂类为主的传统化疗不做优先考虑,可参考1/2 级NET,推荐替莫唑胺为主的化疗方案;而对Ki-67≥55%的3 级NET,可参考NEC 的化疗方案。研究[29]表明,对于发生转移的3 级NET,以铂为基础的化疗药物有适度的活性,有效率0~38% 不 等,PFS 2.6~8.9 个月不 等;CAPTEM 被证明同样有效,缓解率为12%~38%,PFS 为6.7~15 个月。
NEC 患者预后极差,仅有少部分可以行手术局部切除者,ENETS 认为可以考虑辅助化疗[38];其余不可切除的NEC 患者,强烈考虑进行全身化疗。以铂类药物为主的联合用药被认为是一线化疗方案[24],顺铂或卡铂联合依泊苷治疗晚期NEC 的ORR 为30.8%~63.2%,中位总生存期为8.9~12.5 个月[39-40]。有相关临床试验[41]显示CAPTEM对NEC 也有效果,该试验将铂类联合依托泊苷与CAPTEM 在3 级NET 与NEC 患者中的疗效进 行比较,显示两者间没有显著差异。
3.2 肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)
PRRT 是一种专门针对表达SSTR 肿瘤细胞的全身放疗,选用放射性标记SSA[42]。近几年的研究[43-46]显示,PRRT 对3 级NET 有一定疗效,有效率为35%~42%,PFS 为9~14 个月。基于共识,在影像学显示高SSTR 表达的3 级NET 患者中考虑PRRT 是合理的[29]。PRRT 的主要作用是缓解症状与抑制肿瘤进展,但效果有限,所以PRRT 治疗一般只作为二线或三线治疗方案,或者作为其他药物无效或不适合手术者的备选方案。
3.3 免疫治疗
近年来,各类免疫治疗已在多种癌症亚型上取得显著成功,但对GEP-NEN 的应用尚处于探索阶段,现有的研究[47-49]结果得出的有效率都整体偏低,尚未被推荐为首选方案。
免疫检查点抑制剂(immune checkpoint inhibitors,ICI)的单药治疗在多项研究中普遍反映出很低的有效率,相比而言,双重ICI 治疗在面对高级别GEP-NEN 时表现出更好的疗效,多项关于伊匹单抗联合纳武单抗的研究试验显示,其ORR在9.1%~31%[50-55],且可能对化疗后进展的侵袭性NEC 具有治疗作用[51],但其抗肿瘤活性有待进一步验证[56]。
ICI 联合靶向抗血管生成药物对化疗不耐受或难治性肿瘤患者来说是一个全新的选择,两者之间的协同作用可促进健康组织血管生成并增强抗肿瘤免疫[57],并且还可通过VEGF 的负调控支持ICI 的疗效。MD 安德森癌症中心公布的试验结果显示,该治疗方案对pNEN 的ORR 为20%,PFS 为14.9 个月[58]。
ICI 联合化疗的治疗方案也正在研究中,NICE-NEC 研究[59-60]首次评估了一线化疗加ICI 治疗3 级NEN 的疗效,具体为纳武单抗联合顺铂或卡铂治疗,初步研究结果显示这两种组合具有相对有希望的治疗作用,ORR 为54.1%,中位PFS 为5.7 个月。
恶性肿瘤表现出显著的肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes,TIL)浸润、高PD-L1表达、潜在的遗传易感性和活跃的抗肿瘤免疫反应,通常被视为“热肿瘤”的标志,更容易接受免疫治疗[61]。而有临床试验结果显示,包括pNEC在内的多种NEC 均表现TIL 高度浸润[62],且可能与NEN 分级呈正相关[63],表明低分化的NEC 更容易从免疫治疗获益。将“冷肿瘤”(中低水平TIL 浸润和PD-L1 表达的NEN)转化为“热肿瘤”从而提高免疫治疗疗效,可能成为免疫治疗新的突破口。目前关于改变“冷肿瘤”低免疫状态的机制包括刺激T 细胞启动(注射新表位癌症疫苗)、加速T 细胞扩增(应用白细胞介素15)以及诱导T 细胞募集(通过使用表观遗传调节剂和趋化因子)等[64],其对于治疗GEP-NEN 的可行性有待进一步研究。
3.4 手术治疗
手术切除一直以来都是pNEN 的首选治疗方案,尤其对于低级别与良性的肿瘤,在没有远处转移或广泛侵犯的情况下,通常是可以手术切除并治愈的。
3.4.1 对于功能性pNEN(functional pNEN,F-pNEN)除了肿瘤引起的一般临床症状外,F-pNEN 导致的激素分泌失调还会引起相应的内分泌综合征。同时考虑到部分F-pNEN 仍存在较大的恶性潜能,因此ENETS 和NANETS 的指南建议,如果可能的话,所有局限性F-pNEN 患者,无论肿瘤大小,都应优先考虑手术切除。
3.4.2 非功能性 pNEN(nonfunctional pNEN,NF-pNEN)需要对肿瘤进行综合评估以判断是否可手术切除,包括肿瘤分期、原发灶可切除性评估、转移灶可切除性评估,以及肿瘤大小分级等。⑴ 局限期NF-pNEN 的手术治疗:肿瘤>2 cm 者,通常建议采取积极手术方法。由于现有资料支持其具有较高的淋巴结转移风险(22%~50%),且分化普遍较差,所以手术方式应为标准的根治性切除术加淋巴结清扫。对于肿瘤<1 cm 者,很少发生转移且一般生长缓慢,通常建议随访观察。对于1~2 cm大小的肿瘤,如果为局限性高级别NF-pNEN(3 级),可积极考虑根治性切除。个别Ki-67 中等分级、转移风险高,或者在观察期间变大的肿瘤,可以选择手术切除。但大多数情况来说,这种大小的肿瘤通常是低级别的,且淋巴结转移的风险较低(<2 cm 的1 级pNET 中有3%、2 级pNET 中有16%发生淋巴结转移[65]),再考虑到胰腺手术本身的风险和切除后内外分泌功能不全的风险,随访观察可能是更合理的选择。一项系统性综述对5 项回顾性研究[66](共540 例患者)的结果做出整理,表明对于<2 cm 的NF-pNET,观察是一种可接受的替代手术切除的方法。另一项来自荷兰胰腺癌研究小组的前瞻性队列研究[67]中,89%≤2 cm 的NF-pNET 患者在中位随访期17 个月内没有肿瘤进展。但也有部分研究者支持切除<2 cm 的肿瘤,因为即使肿瘤<2 cm,其恶变的风险也会随着肿瘤增大而增加:与肿瘤尺寸<1.5 cm 的患者相比,尺寸为1.5~2 cm的患者有更高的淋巴结转移发生率(17.9%vs.8.7%),更高的Ki-67 指数(Ki-67>3%:35.9%vs.18.8%),更差的肿瘤分级(2 级: 29.2%vs.13.9%),和更高的复发风险(8.0%vs.4.5%)[68]。综上,NANETS 指南建议,1~2 cm 大小的NF-pNET 的治疗应根据多种因素进行个体化选择,包括年龄、并发症、肿瘤的Ki-67 与分级、解剖位置等,并进行长期随访。⑵ 进展期/转移性NF-pNEN 的手术治疗:对1、2 级NF-pNET,若原发灶评估可切除,应力争根治性手术。若肿瘤累及邻近器官或组织,在评估通过的情况下可行原发灶联合受累器官或组织的扩大切除,否则可考虑减瘤手术。若肿瘤伴发肝转移,则应视原发灶的可切除性及肝转移灶的分型制定手术方案,考虑肝减瘤术或联合介入治疗。少数进展期的3 级NF-pNET 生物学行为相对良好,存在根治性手术的可能,应力争手术切除。但大多数情况下,这种高级别病变通常会快速进展转移(中位PFS 仅为2~4 个月),这时需根据病变具体情况与综合评估手术价值以决定最终治疗方案。NCCN 指南2021.3 版中新提出了两个概念,将3 级pNET 分为了良好的生物学的肿瘤(Ki-67<55%、生长缓慢、基于SSR 的PET 成像阳性)与不利的生物学的肿瘤(Ki-67≥55%、生长较快、基于SSR 的PET 成像阴性),并据此提供了不同的治疗方案:对于良好的生物学的3 级pNET,部分情况下有切除的可能,可根据情况切除原发灶与转移灶,并在术后定期监测;如评估不可切除,首选SSA 药物治疗与临床试验,或靶向药物与化疗等全身治疗,并定期监测;对于不可切除但相关症状与肿瘤负荷较轻者,可通过短间隔随访扫描进行观察。对于不利的生物学的3 级pNET,这类肿瘤一般不可切除,首选临床试验,其次可选择全身治疗(靶向药物+化疗)或局部治疗[经动脉化疗栓塞(transarterial chemoembolization,TACE)、消融、立体定向放疗(stereotactic body radiotherapy,SBRT)等],并进行定期监测。而对于pNEC,若评估可切除,则可在手术切除后行辅助化疗或单独化疗;若不可切除则选择化疗,发生转移者可在化疗后尝试免疫治疗。
3.5 pNEN肝转移的治疗
pNEN 诊断时超过60%的患者存在肝转移,同时大部分pNEN 患者的死因都为广泛肝转移引起的肝功能衰竭。对于评估可切除的pNEN 原发灶和肝转移灶,应力争手术切除;当原发灶不可切除时,应避免手术切除转移灶;而当肝转移灶无法切除时,对于原发灶是否切除仍存在争议[69]。
3.5.1 肝减瘤术由于pNEN 生长较为缓慢,即使发生广泛转移,也可采用肝脏减瘤术以降低手术风险并维持肝脏功能[25]。一般来说,只有当能切除90%肝转移灶时,才建议尝试减瘤手术。但最近的研究数据显示,如果能够实现至少70%的肝转移灶切除,临床也是获益的,包括延长生存期和提高生化反应率等[24]。
3.5.2 介入治疗对于因合并症或自身疾病等因素无法进行减瘤手术的患者,可以选择经动脉介入治疗。常用的肝动脉栓塞治疗包括:经动脉栓塞(transarterial embolization,TAE)、TACE,以及经动脉放射栓塞(transarterial radioembolization,TARE)。一般情况下,TAE 被认为是三者中的首选方案。但如果存在播散性肝转移的情况,则选择TACE 或TARE 更为合适。
3.5.3 消融治疗消融治疗越来越多地用于肝转移的pNEN 患者,无论是单独治疗还是与其他治疗联合使用。目前常用的治疗方式包括射频消融、微波消融和冷冻消融等。消融治疗虽然不能延长生存期,但它能有效控制局部转移且复发率低,因此对小范围肝转移的F-pNEN 非常有效。由于消融作用范围有限,只有在应对少量、小个体的转移灶时,消融治疗才具有优势。目前推荐的标准是肿瘤大小≤3 cm,肝内转移灶≤4 个的患者。
综上所述,pNEN 的诊疗受到越来越多的关注与重视,临床诊疗也趋于规范,疗效也大幅提升。但在pNEN 的早期诊断以及与临床治疗预后相关性更强的诊断分级分期方面仍存在困惑。尽管现有治疗手段不少,但如何科学地进行“排兵布阵”,实现更为精准的个体化治疗,仍需进一步研究探索。相信随着精准医疗时代的到来,pNEN 的诊疗会有更大的突破。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:何达、宋彬负责论文构思;何达负责文献收集与初稿撰写;宋彬负责论文审阅与修订。

