胰十二指肠切除术后临床相关胰瘘风险预测模型构建及验证
张丹阳,雷鹏,张宇波,杨刚,张伟
(宁夏医科大学总医院 肝胆外科,宁夏 银川 750004)
胰十二指肠切除术(pancreaticoduodenectomy,PD)广泛应用于治疗胰头部、十二指肠、胆总管下端及壶腹周围相关疾病。随着外科技术的进步以及临床医师不断完善手术方式,已经形成了标准化的手术方式,手术量较大的医疗中心PD 的死亡发生率可控制在0.6%~2%[1],但术后并发症发生率仍居高不下,常见的PD 术后并发症有:术后胰瘘(post-operative pancreatic fistula,POPF)、胆 汁漏、术后出血、胃排空延迟、腹腔感染、脓毒血症等,其中最主要和最严重的并发症仍是POPF,发生率仍保持在3%~30%的高位水平[2-3],POPF 是PD 术后死亡最主要的原因。2005 年国际胰瘘研究小组(International Study Group on Pancreatic Fistula,ISGPF)系统地提出POPF 的诊断标准,即术后第3 天,引流液淀粉酶浓度超过血浆淀粉酶正常值上限3 倍,并且根据胰瘘造成的临床症状的严重程度将POPF 分为A、B、C 三级[4],这一标准在当时得到广泛认可并且指导临床治疗方案的制订。但是这一诊断标准也存在一定的缺陷,POPF 诊断标准划定的范围比较宽泛,许多无明显临床症状并且不需要特殊治疗手段干预的患者也被定义为发生了POPF。为解决这一问题2016 年国际胰腺外科研究组(International Study Group on Pancreatic Surgery,ISFPS)对这一诊断标准进行了修订,新的标准取消了A 级胰瘘的概念,将单纯淀粉酶升高但是不改变临床治疗方案的情况定义为生化漏,不再属于胰瘘;B 级胰瘘指患者有相应症状且需要调整治疗方案;C 级胰瘘仅仅是指发生器官衰竭、二次手术或患者死亡[5]。根据新的诊断标准各种胰瘘风险预测评分系统被开发出来,但是仍面临预测价值均较低、受试者工作特征(ROC)曲线下面积(AUC)、特异度、阳性预测值、准确性等指标均较低等一系列问题[6]。
本文通过回顾性研究,对POPF 的危险因素进行分析并且建立一种快速、简单、有效的POPF 风险预测列线图模型并进行验证,帮助医生筛选胰瘘的高危患者,较早对其实施临床干预,更好地加强围手术期管理,降低POPF 的发生率,提高PD手术的安全性和疗效。
1 资料与方法
1.1 一般资料
回顾性收集2015 年1 月—2021 年7 月宁夏医科大学总医院肝胆外科收治的365 例因胰头、十二指肠、胆总管及壶腹周围恶性肿瘤行PD 手术患者的术前实验室检查、术前腹部增强CT 以及术后30 min 内血气分析乳酸值。均由同一团队完成手术。本研究经过宁夏医科大学总医院伦理委员会审批通过(伦理号:KYLL-2020-16)。
1.2 纳入与排除标准
纳入标准:⑴ 所有患者均在全麻下行PD;⑵ 术前进行腹部增强CT 检查;⑶ 术前检查无远处转移和大血管侵犯现象;⑷ 术中无大血管切除重建记录。排除标准:⑴ 临床资料不完整或数据缺失;⑵ 合并严重心脑血管疾病或肺、肾功能不全,不能耐受手术;⑶ 术中联合其他实质脏器切除;⑷ CT图像质量欠佳影响数据测量和分析。
1.3 胰瘘的诊断及分级标准
根据最新版2016 年ISGPF 的专家共识[5]及2017 年胰腺术后外科常见并发症诊治及预防的专家共识[7]的诊断标准,若PD 术后第3 天或3 d 以上引流液中的淀粉酶含量超过血清淀粉酶正常值3 倍或3 倍以上,且同时伴有相应的临床表现,诊断为POPF。将其分为3 个等级:⑴ 生化漏(A 级):不伴有临床症状;⑵ B 级:需要改变和调整治疗措施(持续性腹腔引流≥3 周、由于胰瘘导致相关临床治疗改变、经皮或者内镜下穿刺引流、胰瘘相关性出血性行血管造影);⑶ C 级:在B 级胰瘘的基础上伴随严重的并发症,需行手术处理或出现1 个或者多个器官功能衰竭甚至导致死亡。按照术后是否发生临床相关性胰瘘(clinically relevant postoperative pancreatic fistula,CR-POPF),将 未发生胰瘘和生化漏归为非临床相关胰瘘组(非CR-POPF 组),B、C 级胰瘘归为临床相关胰瘘组(CR-POPF 组)[8]。
1.4 治疗过程
所有患者术前1 周内所有患者完成影像学检查。入院后第2 天抽血送检,获得各项实验室检查结果,如存在重度黄疸则进行经皮穿刺胆道置管引流术(percutaneous transhepatic biliary drainage,PTBD)行减黄治疗,术前再次复查总胆红素,若浮动在150 μmol/L 则按计划行PD 治疗。术前进行胃肠道准备,留置胃管、空肠营养管、尿管,行中心静脉穿刺置管术;手术结束后由麻醉医师抽取动脉血行血气分析获得术后乳酸值;术后患者均送入ICU 过渡治疗,待脱离呼吸机、拔除气管插管后转入普通病房。
1.5 手术方式
所有患者均行开放PD、Child 消化道重建。切除30%的胃及其网膜和幽门区的淋巴结及7、8、9、11、16 组淋巴结。胰肠吻合口为胰管、胰腺对空肠黏膜端侧吻合,5-0 PDS 线连续缝合后壁,以适宜口径的软质的硅胶管支撑胰管全长,并经吻合口进入空肠襻3~5 cm,5-0 薇乔线固定胰管支架,5-0 PDS 并将胰腺胰管开口与空肠黏膜开口间断全层缝合,使用4-0 滑线U 形缝合胰肠吻合口予以加固。距左右肝胆管汇合处1~2 cm 离断胆总管,据胰空肠吻合口10 cm 做胆管空肠吻合,前后壁分别由5-0 PDS 缝线做全层连续缝合。于胆管空肠吻合口下方50 cm 处做胃空肠侧端吻合,用4-0 薇乔线连续缝合做胃肠吻合,吻合口浆膜间断缝合加固。在胃肠吻合口下方10 cm 处行空肠侧侧吻合,用4-0 薇乔线连续缝合,吻合口间断缝合予以加固。胰肠吻合口及胆肠吻合口前后各留置1 根腹腔引流管。
1.6 观察指标
收集患者的一般资料包括性别、年龄、BMI、有无糖尿病、高血压、冠心病病史,有无腹部手术史;术前1 周内的检验、检查指标,包括血小板(platelet count,PLT)、中性粒细胞计数(neutrophil,NEUT)、淋巴细胞计数(lymphocyte,LYM)、单核细胞计数(monocytosis,MONO)、血清白蛋白(albumin,ALB)、中性粒细胞计数与淋巴细胞计数比值(neutrophil-to-lymphocyte ratio,NLR)、纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,FAR)、淋巴细胞计数与单核细胞计数比值(lymphocyte to monocytosis ratio,LMR)、主胰管直径是否>3 mm(以腹部增强CT 显示肠系膜上静脉与门静脉汇合的层面测量主胰管直径)(图1),腹部增强CT 阅片由2 位工作时间超过10 年的影像科医生分开读片,并由第3 位影像科主任医师审核得出结果;手术相关指标:胰腺质地、手术时间、术中出血量、术后乳酸值。

图1 主胰管扩张的CT表现 A:胰头部胰管明显扩张;B:胰体部胰管扩张;C:胰尾部胰管扩张并呈串珠样改变Figure 1 CT manifestations of main pancreatic duct dilation A: Significant dilation of the pancreatic duct in the pancreatic head;B: Dilation of the pancreatic duct in the pancreatic body;C: Dilation of the pancreatic duct in the pancreatic tail with bead-like changes
1.7 统计学处理
采用SPSS 27.0 和R 4.2.1 软件完成统计分析。符合正态分布的计量资料用均数± 标准差(±s)表 示,进行t检 验;偏态分 布的计量资料用中位数(四分位间距)[M(IQR)]表示,进行Wilcoxon 秩和检验;计数资料采用绝对值和百分比表示,采用χ2检验。首先对建模组进行单因素分析,筛选出胰瘘影响因素后再进行多因素Logistics 回归分析,并利用筛选出的独立危险因素构建预测患者POPF 风险列线图。将P<0.05为差异有统计学意义。评价列线图模型的预测效能指标使用AUC 进行模型的区分度检验,通过Bootstrap 重复自抽样法对列线图进行内部验证,经过重复1 000 次Bootstrap 自抽样获得校准曲线,以两条曲线走势轨迹一致,平均绝对误差(mean absolute error,MAE)越小表示模型质量好,预测越准确。
2 结果
2.1 患者一般情况
最终收集符合纳入标准的样本共365 例,所有患者术后发生CR-POPF 的患者109 例,非CR-POPF的患者256 例。总数据<10 000 时,一般分配比例为训练集和测试集的比例为7∶3 或是8∶2[9-10],本研究将所有样本利用计算机产生随机数的方法按7∶3 比例随机拆分为建模组(n=257)和验证组(n=108),两组间的既往病史资料、术前1 周内检验、检查指标及手术相关指标差异均无统计学意义(均P>0.05)(表1)。
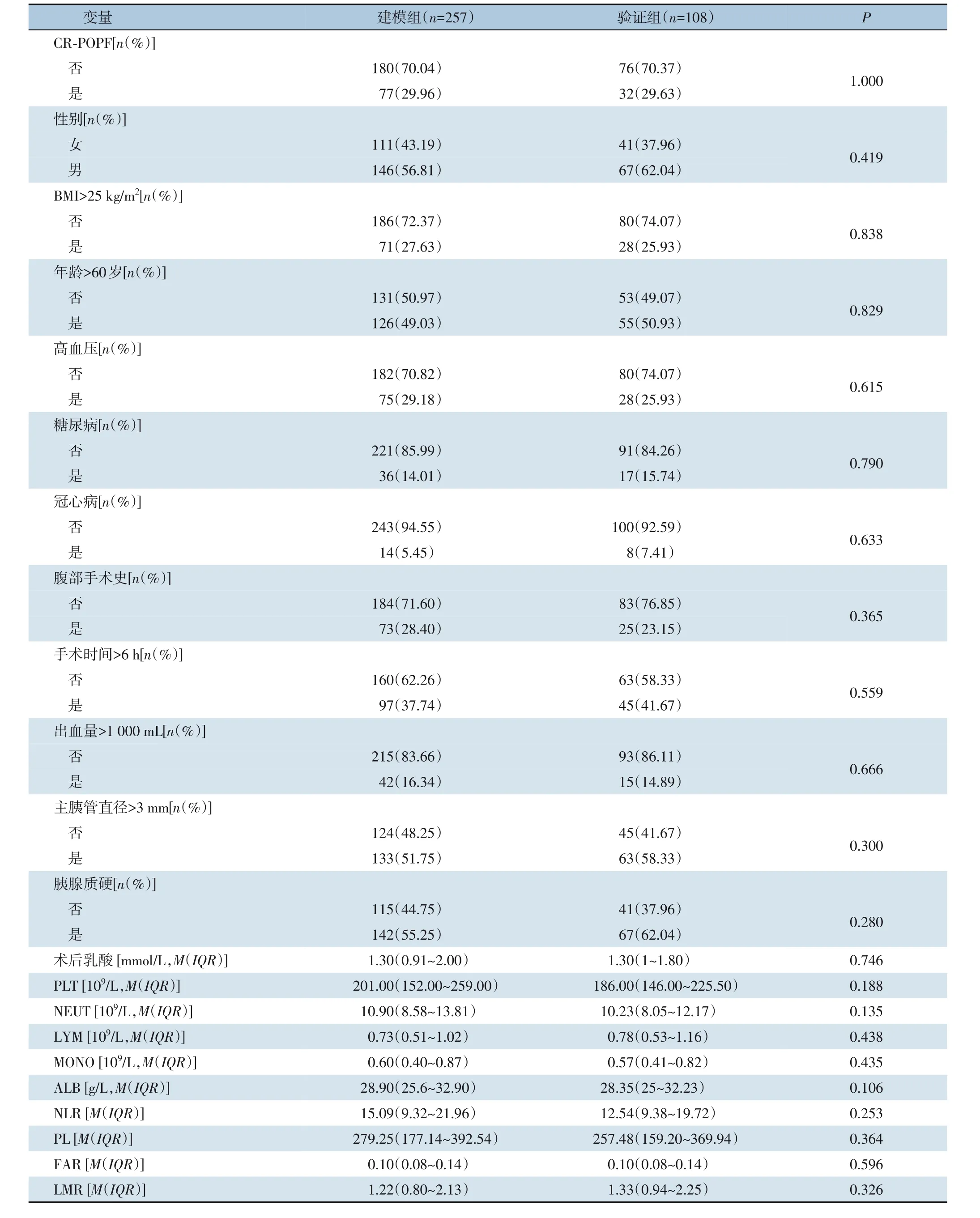
表1 建模组与验证组基线资料比较Table 1 Comparison of baseline data between the modeling group and the validation group
2.2 单因素与多因素Logistic 回归分析及CRPOPF风险预测模型构建
将建模组中的257 例患者分为CR-POPF 与非CR-POPF,两组比较结果显示有9 项指标差异有统计学意义:性别(P=0.003),BMI(P=0.005),腹部手术史(P=0.045),主胰管直径(P<0.001),胰腺质硬(P<0.001),NEUT(P=0.027),MONO(P=0.001),LMR(P=0.003),术后乳酸(P<0.001)(表2)。将有统计学差异的指标纳入多因素Logistic 回归分析,并筛选出独立危险因素进行模型的构建,结果显示术后高乳酸、胰腺质软、主胰管直径≤3 mm、男性是PD术后POPF的独立危险因素(表3)。结合回归系数建立数学模型:Logit(P)=-2.154+1.279×(术后乳酸)-1.414×(主胰管直径>3 mm)-1.922×(胰腺质硬)+1.063(男性)。
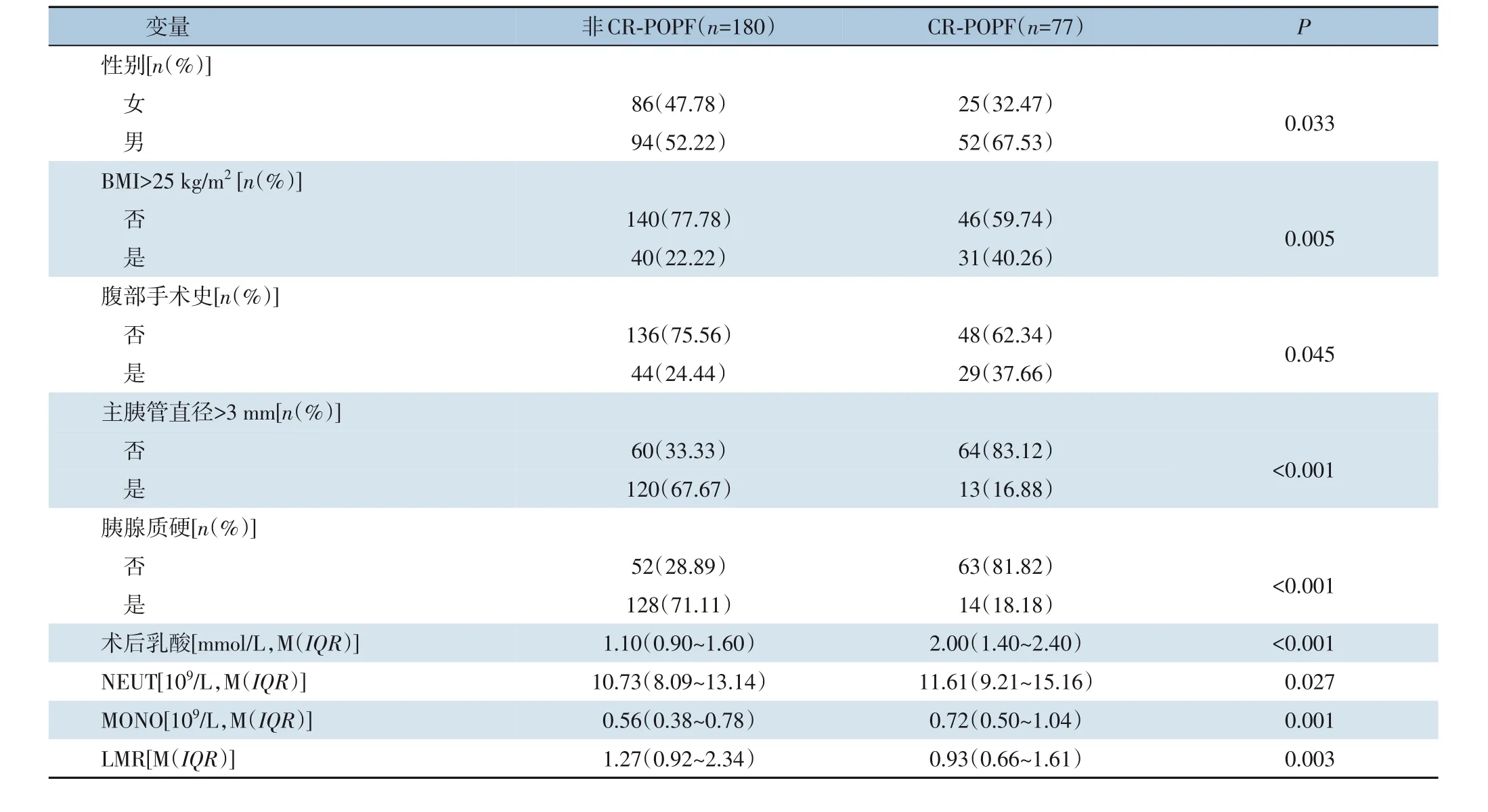
表2 建模组单因素分析Table 2 Multivariate analysis of the modeling group
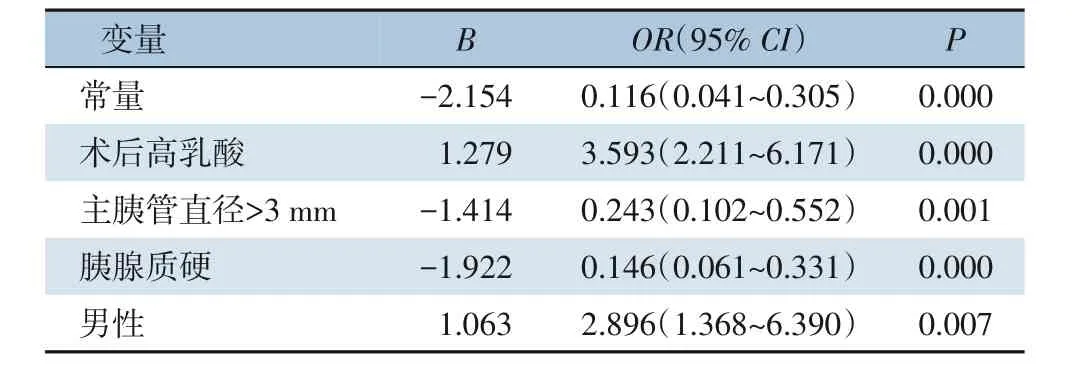
表3 建模组Logistic单因素分析Table 3 Logistic univariate analysis of the modeling group
2.3 列线图构建
利用R 4.2.1 软件绘制临床预测模型列线图,实现模型可视化(图2),将每个预测指标的得分项相加得到总分,依据总得分读取相应的预测概率。
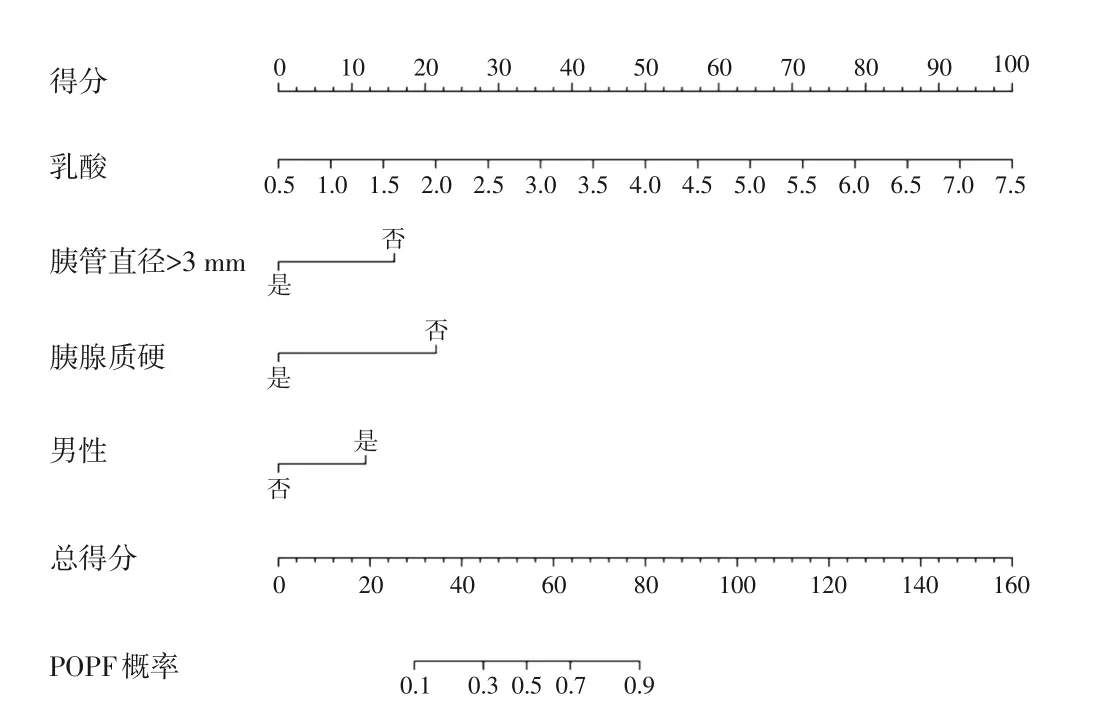
图2 预测模型列线图Figure 2 Nomogram predictive model
2.4 建模组POPF风险预测模型的区分度及校准度评估
模型的区分度检验结果显示,模型预测POPF的AUC 为0.897(95%CI=0.857~0.936);校准度评估结果显示,模拟曲线和实际曲线走势轨迹基本一致(MAE=0.014)(图3)。
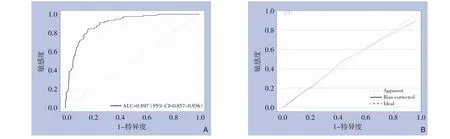
图3 模型效能评估 A:建模组ROC曲线;B:建模组校准曲线Figure 3 Model performance evaluation A: ROC curve of the modeling group;B: Calibration curve of the modeling group
2.5 模型验证
应用验证组数据对构建的临床预测模型进行验证,绘制ROC 曲线,AUC 结果显示:AUC 为0.901(95%CI=0.844~0.959);模拟曲线和实际曲线走势轨迹基本一致(MAE=0.019)(图4)。
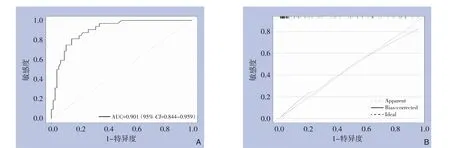
图4 模型效能验证 A:验证组ROC曲线;B:验证组校准曲线Figure 4 Model performance validation A: ROC curve of the validation group;B: Calibration curve of the validation group
3 讨论
3.1 POPF风险预测研究现状
由于PD 手术复杂且术后并发症发生率高,一直都是国内外研究的热点,外科手术技术的改进以及临床治疗方案的改善极大降低了POPF 的病死率,但POPF 的发病率仍居高不下。POPF 是PD 术后出现严重性并发症之一以及围手术期间威胁患者生命的主要原因。PD 发生POPF 多见于胰管空肠黏膜吻合口,胰肠吻合口出胰液漏通常伴随小肠液漏出,导致胰液中胰蛋白酶原更容易活化,对周围组织器官的腐蚀加强。因此,PD 发生POPF 患者更容易出现腹腔感染、出血等严重并发症[11],从而延长住院时间,增加患者的住院费用。目前公认主胰管的直径、胰腺质地显著影响POPF 的发生[12],Callery 等[13]就利用胰腺质地、病理类型、主胰管的直径、术中出血量构建了原始胰腺风险评分系统FRS,2019 年Mungroop 等[14]引入BMI 改进FRS,2021 年Mungroop 等[15]再次纳入了吻合方式和性别两个因素,更新了胰腺风险评分系统,并且在开放手术和微创PD 两种情况下对新的胰瘘评分系统做了评价。也有研究[16]表明现存的评分系统预测价值均较低、AUC、特异度、阳性预测值、准确性等指标均较低,因此仍有进一步探索的空间。
3.2 性别及脂肪对POPF的影响
性别对于POPF 的影响不可忽视,受激素影响,男性的脂肪主要沉积在内脏器官周围,而女性的脂肪主要沉积在皮下,有研究[17-18]认为,性别影响了腹部脂肪分布不同,从而影响POPF 的发生。既往研究[19]表明,胰腺质地的软硬程度与胰腺小叶纤维化程度相关,胰腺小叶纤维化程度越高,胰腺质地越硬,POPF 的风险越低。这可能与纤维化程度高的胰腺质地硬,胰管扩张、吻合更容易操作有关。胰腺质地软的患者往往因其胰腺外分泌功能较强而增加其发生POPF 的风险[20]。并且胰腺质地较软的患者其内脏脂肪含量较高,主胰管直径往往较小,使得吻合难度加大、容易发生撕裂。
3.3 影像学在预测POPF中的作用
已有研究利用胰腺CT 值[21]、声辐射力脉冲(acoustic radiation force,ARFI)[22]测定胰腺剪切波速(shear wave velocity,SWV)来表示胰腺质地从而预测胰瘘,但这些指标仍然缺乏大样本量的验证,其预测价值还有待进一步研究。主胰管直径又是一公认的影响POPF 的危险因素,研究[23]表明,当主胰管直径<3 mm 时,POPF 发生率升高,胰管直径主要影响术中胰肠吻合的难度。另一方面,如前所述,胰管扩张通常因既往慢性胰腺炎所致,胰腺质地较硬,易于缝合。本文中引入腹部增强CT 显示肠系膜上静脉与门静脉汇合的层面测量主胰管直径,使得在术前就能获得客观准确的MPD 数据。
3.4 乳酸对预测POPF
本研究发现,乳酸对预测POPF 也有一定价值。既往研究[24]证实,高乳酸血症是POPF 发生的一个独立危险因素。乳酸水平通常反映整体或局部微循环情况,胰管空肠吻合处微循环障碍导致局部乳酸堆积从而影响吻合口的愈合情况,乳酸水平明显升高,提示微循环障碍。胰腺小叶由1 条小叶间动脉供血,小叶间动脉发出若干树状分支的小叶内动脉,小叶内动脉的起始部为小叶内动脉括约肌,小叶内动脉与小叶间动脉或者相邻的小叶内动脉没有吻合。胰腺组织的血供大多数由单独的小叶内动脉供应,而小叶内动脉属于终末动脉,易受缺血的影响[25]。乳酸、组胺及氧自由基等炎症介质的作用下,胰腺小叶间动脉痉挛,不可避免地导致缺血、缺氧甚至坏死。坏死的细胞丧失功能而加重组织水肿,不利于伤口愈合,POPF 正是由于胰肠吻合口愈合不良,造成部分或完全按吻合口裂开所致。
3.5 本研究的优点局限性
相较于以往常规采用的胰瘘风险评分系统,本研究的CR-POPF 列线图预测模型更具有优势,性别指标极易收集;腹部增强CT 是常规术前检查,选取肠系膜上静脉与门静脉汇合的左侧缘层面测定的主胰管直径相较于术中外科医生判断胰管有无扩张更为客观;乳酸是通过术后血气分析测定的客观准确的数值。本预测模型中包含的指标通过术前CT、术后血气分析以及简单的判断就可获得,没有测算过程复杂的指标,因此该模型临床应用的前景广泛。
本研究中纳入了因胰头、十二指肠、胆总管及壶腹周围恶性肿瘤行PD 患者,但考虑到针对肿瘤病理类型如何分类,不同病理分型之间POPF 是否存在统计学意义目前存在较大的争议[26-27],而且并不是所有的病例在术前都进行细针穿刺标本送检病理,得到准确的病理分型,而术后正式病理报告一般需要等待5 个工作日。本研究旨在术后早期识别发生B、C 级胰瘘高危人群,所以详细的肿瘤病理分型未纳入本研究中。既往研究[28]表明,胃排空延迟(delayed gastric emptying,DGE)和POPF 同为DP 术后常见的并发症;有研究[29]表明,DGE 和胃肠功能恢复缓慢是造成POPF 的原因之一。目前DGE 的分级标准主要基于术后胃管留置时间[30-31],但由于本研究中医师对拔除胃管态度谨慎造成DGE 分级并不准确,故未纳入本次研究。胰腺质地的判断主要依靠术中主刀医生触摸判断,可能存在一定的主观性,为本研究的局限性。
综上所述,男性、胰腺质地、主胰管直径以及术后乳酸是CR-POPF 的预测危险因素,基于这些指标建立的POPF 列线图预测模型,具有良好的预测性能,该模型在临床上具有良好的应用前景,可帮助医生早期筛选出胰瘘高危患者,制定个体化管理方案,但是本研究结果仍需要大样本的前瞻性研究进一步验证。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:张丹阳负责数据的分析、实验结果可视化、初稿撰写;张宇波负责实验监督和领导;杨刚负责数据整理;张伟负责数据整理;雷鹏负责初稿的审阅和修改、资金支持。

