肠道菌群代谢产物与血管内皮功能的研究进展
呼瑞 刘富强 王军奎
【摘要】血管内皮功能对维持心血管系统稳态至关重要,其功能障碍是心血管疾病的重要原因。近年来,许多研究表明肠道菌群参与了血管内皮功能的改变,可能通过直接影响肠道菌群或间接影响肠道菌群代谢产物,如短链脂肪酸、次级胆汁酸、吲哚-3-甲醛、三甲胺-N-氧化物、苯乙酰谷氨酰胺、脂多糖、尿毒症毒素等对血管内皮功能产生影响。现综述近年来发现的肠道菌群代谢产物,为探索肠道菌群对血管内皮功能的影响提供理论基础和新思路。
【关键词】血管内皮功能;肠道菌群;代谢产物
【DOI】10.16806/j.cnki.issn.1004-3934.2024.02.000
Metabolites of Intestinal Flora and Vascular Endothelial Function
HU Rui1,LIU Fuqiang2,WANG Junkui2
Xian Medical University,Xian 710021,Shaanxi,China;2.Department of Cardiology,Shaanxi Provincial Peoples Hospital,Xian 710068,Shaanxi,China)
【Abstract】Vascular endothelial function is critical for maintaining homeostasis of the cardiovascular system,and its dysfunction is an important cause of cardiovascular disease. In recent years,many studies have shown that intestinal flora are involved in the alteration of vascular endothelial function,which may affect vascular endothelial function by directly influencing intestinal flora or indirectly influencing intestinal flora metabolites,such as short-chain fatty acids,secondary bile acids,indole-3-carboxaldehyde,trimethylamine-N-oxides,phenylacetylglutamine,lipopolysaccharides,and uremic toxins. The metabolites of intestinal flora discovered in recent years are reviewed to provide a theoretical basis and new ideas for exploring the effects of intestinal flora on vascular endothelial function.
【Keywords】Vascular endothelial function;Intestinal flora;Metabolite
健康的血管内皮是维系心血管系统稳态的基石,当血管内皮由生理状态转为功能障碍状态被称为血管内皮功能障碍。血管内皮功能障碍机制尚不完全明确,可能涉及到氧化应激、炎症因子、低密度脂蛋白等多种因素[1]。近年来,大量研究发现,肠道菌群失调可能是导致血管内皮功能障碍的一个新机制,可通过肠道菌群和微生物代谢产物从肠道环境迁移至心血管系统代谢的相关组织中引起炎症和氧化应激,导致血管内皮功能障碍[2]。因此,现综述近年来新发现的肠道菌群代谢产物对血管内皮功能的影响,提出对肠道菌群代谢产物进行靶向干预可为血管内皮功能障碍的防治带来希望。
1 血管内皮功能
血管内皮细胞是血浆和血管组织之间形成的一种特化上皮细胞,它不仅完成血浆和组织液的代谢交换,还能合成和分泌多种生物活性物质,保证血管的正常收缩和舒张功能,维持血管张力,调节血压,平衡凝血和抗凝[3]。血管内皮功能障碍是一种以血管收缩和舒张机制失衡为特征的病理状态,是动脉粥样硬化、高血压、肺动脉高压、糖尿病、与神经退行性疾病相关的微血管病变、败血症等心血管疾病风险的标志[4-5]。已知的血管內皮细胞分泌的血管收缩因子包括内皮素-1、血栓素A2等,血管舒张因子包括一氧化氮(nitric oxide,NO)、前列环素、内皮衍生超级化因子等,其中作用最重要的是NO。NO是一种可溶性气体,具有重要的血管舒张功能,内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)利用烟酰胺腺嘌呤二核苷酸提供的电子催化L-精氨酸和O2,生成NO和L-瓜氨酸,NO主要由内皮细胞受剪切应力作用而释放,当NO释放到血管平滑肌细胞,可激活鸟苷酸环化酶直接导致血管扩张。除此之外,NO在血管中还具有多种作用,如通过抑制血小板聚集和黏附、纤溶酶原激活物抑制物-1发挥抗血栓作用,抑制白细胞的聚集发挥抗炎作用[6-7]。血管内皮功能障碍与NO产生不足和将生物可利用的NO转化为其他物质的消耗过多密切相关,最终导致血管稳态失衡,导致促炎状态和血栓形成[7]。
2 肠道菌群的概述
肠道微生物是由细菌、古细菌、真菌、原生动物和病毒组成的生态群落[8],其中细菌占99%以上,故以肠道菌群代指肠道微生物[9]。肠道菌群大约是由1014个细菌组成的高度多样化的群落[10],其中最主要的6大门是厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭杆菌门和疣微球菌门,在健康菌群中,厚壁菌门和拟杆菌门是主要优势菌群,占总数的80%~90%[11]。肠道菌群产生大量具有生物学效应的代谢产物,如三甲胺N-氧化物(trimethylamine-N-oxide,TMAO)、苯乙酰谷氨酰胺(phenylacetylglutamine,PAGln)、尿毒症毒素、NO、脂多糖(lipopolysaccharide,LPS)、短链脂肪酸(short-chain fatty acid,SCFA)、胆汁酸、维生素K、维生素B复合物、肠道激素及神经递质等[12],参与人体各种功能的调节,包括为宿主提供营养,参与生长代谢和免疫调节,清除致病微生物,维持肠道上皮的完整性和稳态。当不合理的饮食模式、环境因素、肠道感染或抗生素的使用导致肠道微生物的种类和数量发生改变时,就会发生肠道菌群失调,引起炎症和代谢的紊乱[13]。研究[5]发现,肠道菌群失调不仅会导致炎症性肠病和结肠癌等肠道相关性疾病,还可导致肥胖、糖尿病、过敏,尤其是心血管疾病。Cui等[14]纳入29例冠心病患者和35例健康人作为对照组,从粪便中提取肠道菌群DNA,行高通量测序发现冠心病患者拟杆菌门和变形菌门减少,厚壁菌门和梭杆菌门相对丰度增加,厚壁菌门/拟杆菌门比例显著上升,且两组间的肠道菌群组成存在显著差异,提示肠道菌群改变可能与冠心病发生有关。
3 肠道菌群与血管内皮功能
3.1 肠道菌群改变对血管内皮功能的直接影响
当肠道益生菌数量减少或致病菌数量增加时就会发生肠道菌群失调,使得肠道菌群与宿主之间的相互作用受到影响,肠道菌群失调可通过直接影响机体糖脂代谢或间接改变肠道通透性影响机体循环中炎症反应和氧化应激水平,从而导致血管内皮功能障碍的发生发展[15]。血管内皮功能障碍是心血管疾病发病的关键环节,与冠状动脉疾病、高血压、慢性心力衰竭等心血管疾病密切相关。在一项临床研究中,Tsutsumi等[16]招募60例健康受试者,随机分配到长链单不饱和脂肪酸(刀鱼油)组和对照(橄榄油)组,每日摄入4.2 g油(12粒胶囊),持续干预4周后肠道菌群组成发生改变,结果表明刀鱼油组受试者血流介导的血管扩张(flow-mediated dilation,FMD)显著增加4.2%,血管内皮功能得到改善。在动物研究[16]中,将ApoE-/-小鼠随机分为3组,分别是烯油酸(C20∶1)组、鲸油酸(C22∶1)组、对照(橄榄油)组,持续喂养12周,收集小鼠粪便样本,行16S rRNA基因测序发现,经过C20∶1、C22∶1处理后的小鼠,阿克曼氏菌的丰度增加、拟杆菌门比例增加、厚壁菌门比例显著降低、厚壁菌门/拟杆菌门的比例降低,小鼠血管内皮功能改善,减轻了动脉粥样硬化。Malik等[17]研究发现冠心病患者每天服用植物乳杆菌299v,6周后可改善心脏血管内皮功能。以上研究表明,当肠道菌群组成及比例发生改变,益生菌比例增多时可使血管内皮功能得到改善。
3.2 肠道菌群代谢产物对血管内皮功能的影响
3.2.1 SCFA
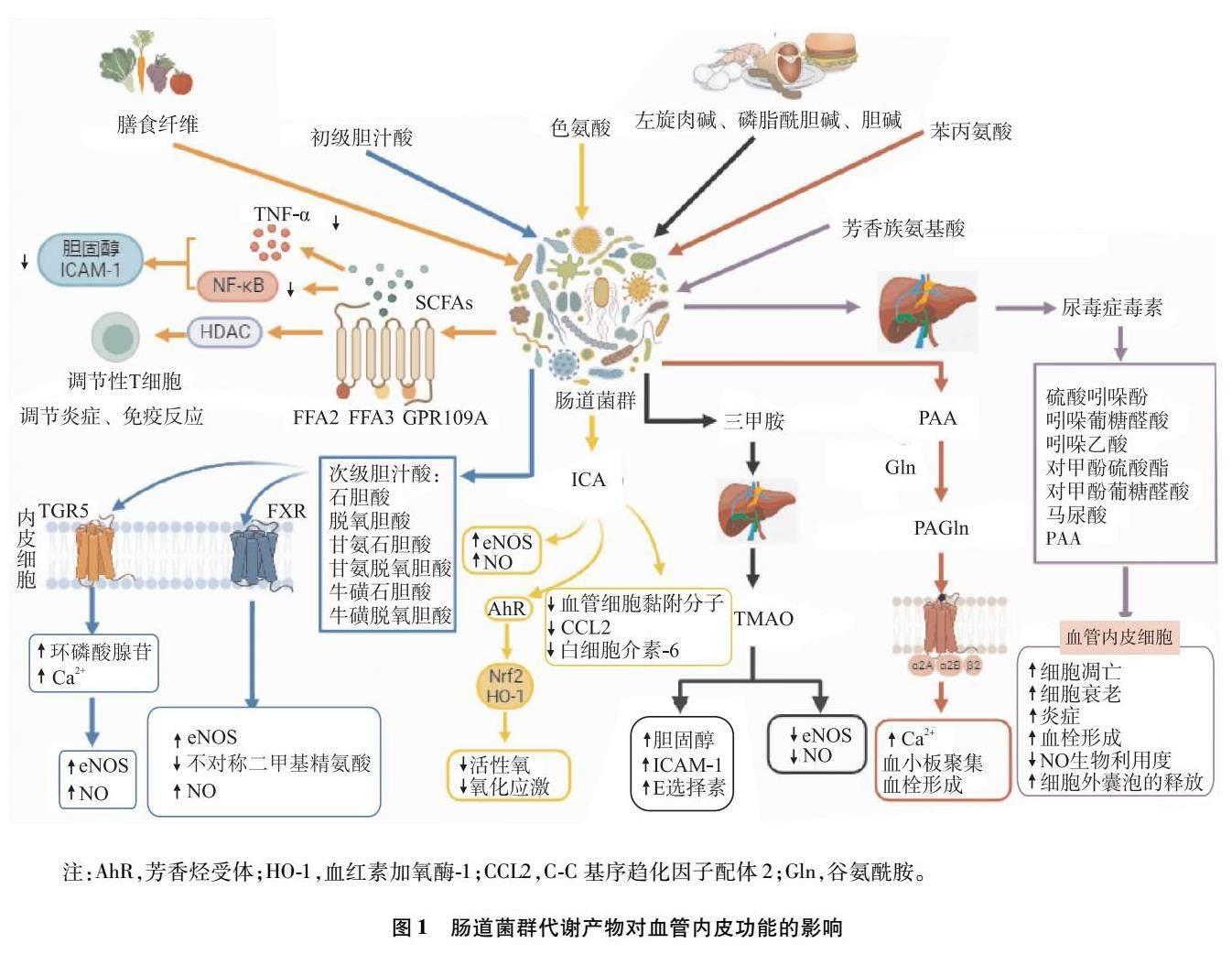
SCFA是由结肠内的肠道厌氧菌通过发酵难以消化的膳食纤维而产生的碳原子少于6个的脂肪酸,包括含量丰富的乙酸、丙酸和丁酸,以及含量较少的戊酸、己酸,拟杆菌门、厚壁菌门、毛螺菌科、乳酸杆菌、粪杆菌和瘤胃球菌主要参与SCFA的生成[5,18]。SCFA通过维持肠道稳态、减少炎症、调节血管功能在人体健康中发挥重要作用。研究[18-20]表明,SCFA不仅可通过激活G蛋白偶联受体(G-protein coupled receptor,GPR)[如游离脂肪酸(free fatty acid,FFA)2、FFA3、GPR109A]和抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)来诱导调节T细胞的分化,调节炎症及免疫反应,通过与FFA2受体、FFA3受体及嗅觉受体结合参与血压的调节,还可通过抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、核因子κB(nuclear factor-κB,NF-κB)信号通路来降低胆固醇水平和细胞间黏附分子(intercellular adhesion molecule,ICAM)表达,调节免疫应答,改善血管内皮功能,以此减缓动脉粥样硬化的发展。Li等[19]研究发现,SCFA,特别是丁酸作为HDAC的抑制剂具有调节血管内皮功能、抑制炎症因子和氧化应激的作用,可保护血管内皮和改善动脉粥样硬化。结合上述证据,外源性补充SCFA物质可能成为改善血管内皮功能和动脉粥硬化的新靶点。
3.2.2 次级胆汁酸
肝细胞合成胆汁酸,通过胆道系统释放入肠道中,在肠道菌群酶的催化下转化为次级胆汁酸,游离的次级胆汁酸具有激素活性和多效性,它们通过激活武田G蛋白偶联受体(Takeda G-protein coupled receptor 5,TGR5)、法尼醇X受体(farnesoid X receptor,FXR)发挥多种作用,如调节糖脂代谢、维持肠道屏障的完整性、抑制炎症因子的释放[21]。研究[22]发现,次级胆汁酸与TGR5结合触发肝窦内皮细胞中环磷酸腺苷表达,细胞内Ca2+水平升高,导致eNOS磷酸化的激活和NO的释放,NO不仅可舒张血管和增加血流,还具有抗炎、减少血管内皮细胞黏附的作用,从而改善血管内皮功能。有研究[15]报道,牛磺酸熊去氧胆酸(taurine deoxycholic acid,TUDCA)通过激活FXR可增加eNOS表达,并可能减少不对称二甲基精氨酸形成;通过激活TGR5可增加内皮细胞内Ca2+水平、eNOS和丝氨酸/苏氨酸激酶磷酸化;通过促进硫化氢的生成来调控NO的合成和活性,从而促进血管舒张,改善血管内皮功能。Walsh等[23]纳入12例健康的年轻受试者,随机分为TUDCA组和安慰剂组,分别给予TUDCA(1 500 mg)和安慰剂(1 500 mg),8 h后测量肱动脉FMD作为基线,均给予75 g葡萄糖刺激后60 min和120 min重复测量肱动脉FMD,发现安慰剂组FMD较基线水平明显降低,而TUDCA组变化不明显,由此可得,短期内口服TUDCA(15 00 mg)可改善高血糖诱导的血管内皮功能障礙。
3.2.3 吲哚-3-甲醛
吲哚-3-甲醛(indole-3-carboxaldehyde,ICA)是一种肠道微生物来源的色氨酸代谢产物[24],Lu等[25]通过宏基因组学研究发现,高脂肪饮食组拟杆菌科和乳酸杆菌科的丰度低于对照组,而这些细菌已被证实可产生色氨酸酶,从而将色氨酸代谢成ICA。既往研究[26]证实ICA具有增强肠道上皮屏障和抗炎活性的作用。但最新研究发现了ICA对内皮细胞的作用。Lu等[25]研究发现,ICA虽不影响ICAM和内皮素的RNA水平,但却增加了eNOS的转录水平,从而增加了NO的生成。ICA还降低了血管细胞黏附分子、C-C基序趋化因子配体2以及白细胞介素-6的基因表达。此外,ICA含有芳香烃结构,通过芳香烃受体激活后,芳香烃受体进入细胞核与核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)启动子区域结合从而上调Nrf2-血红素加氧酶-1表达,降低细胞内氧化应激和低密度脂蛋白诱导的活性氧水平[25,27]。总之,最新研究表明ICA通过增加eNOS转录,降低炎症因子和活性氧水平,保护血管内皮细胞,缓解动脉粥样硬化的发展。
3.2.4 TMAO
富含左旋肉碱、磷脂酰胆碱(卵磷脂)、甜菜碱和胆碱等动物性食品通过肠道菌群代谢产生三甲胺,三甲胺被肝脏中的黄素单氧化酶迅速氧化为TMAO[13,28],TMAO是一种具有生物活性的分子。研究[4]发现,无论是在人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)还是牛主动脉内皮细胞,TMAO均可减少eNOS的合成,减少NO生成,从而导致血管内皮功能改变,但其机制可能不尽相同。在HUVEC模型中,TMAO通过氧化应激和硫氧还蛋白相互作用蛋白、NOD样受体热蛋白结构域相关蛋白3炎性小体活化来抑制eNOS的合成和NO释放,而在牛主动脉内皮细胞模型中,TMAO影响嘌呤诱导的细胞内Ca2+增加、eNOS磷酸化和NO释放。活化的内皮细胞上表达了不同的黏附分子,这些黏附分子可直接诱导血管内皮功能障碍和动脉粥样硬化。研究[4]发现,用TMAO处理的人主动脉内皮细胞表达更高水平的ICAM-1和E选择素,诱导血管内皮功能障碍。TMAO亦可使胆固醇7α-羟化酶的表达降低,抑制胆固醇转运,从而使细胞中胆固醇水平升高、泡沫细胞增多[29]。Brunt等[29]研究发现,在健康人群中,中老年人的TMAO水平高于年轻人,且与肱动脉FMD呈负相关(P<0.000 01),TMAO水平的升高是血管内皮功能障碍的上游驱动因素,且TMAO与心血管疾病风险预测成正相关。
3.2.5 PAGln
PAGln是肠道菌群分解必需氨基酸苯丙氨酸的代谢产物,苯丙氨酸存在于多种植物和动物来源的蛋白中,未被吸收的苯丙氨酸可被肠道微生物代谢形成苯丙酮酸和苯乙酸(phenylacetic acid,PAA),PAA可与谷氨酰胺结合生成PAGln,PAA与甘氨酸结合生成苯乙酰甘氨酸。在人血、分离的血小板及颈动脉损伤小鼠模型中发现,PAGln可通过GPR(包括α2A、α2B和β2肾上腺素能受体)导致血小板活性和聚集增强,促进Ca2+水平升高,加速了血小板的聚集和血栓形成,损伤血管内皮功能,最终促进动脉粥样硬化发生发展[30]。Nemet等[30]对临床队列人群(n=1 162)的血浆进行靶向和非靶向代谢组学分析后发现,PAGln在机制和临床方面与主要不良心血管事件(major adverse cardiovascular event,MACE)相关,利用液相质谱靶向检测方法评估了4 000例择期进行心脏评估的稳定受试者血浆,发现患有MACE的患者血浆PAGln水平较非MACE患者水平高(P<0.000 1),且高PAGln水平的患者具有更大患MACE的風险(P<0.000 1)。目前体内外试验证实PAGln可增强血小板活化和血栓形成,损伤血管内皮功能,导致MACE风险增加。
3.2.6 LPS
LPS也称内毒素,是由脂质和多糖合成的复合物,是革兰氏阴性菌细胞壁的一种特有成分,肠道菌群失调可导致肠道通透性增加,促进LPS从肠腔易位进入循环,可诱导全身炎症和细胞凋亡[15]。研究[31]表明,LPS可通过Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88/NF-κB通路诱导白细胞介素-1、白细胞介素-6和TNF-α的释放,引发慢性炎症,损害血管内皮功能,促进心血管疾病的发生发展。Zhao等[32]用不同浓度的LPS(0、0.5、1、2和4 μg/mL)处理HUVEC 24 h后发现,乳酸脱氢酶、白细胞介素-1β、TLR4、NOD样受体热蛋白结构域相关蛋白3的表达呈浓度依赖性增加,诱导HUVEC焦亡,并发现LPS可通过激活特异性蛋白1/网钙结合蛋白-2 /eNOS信号通路诱导血管内皮焦亡,影响其功能。研究[15]发现,当肠道屏障受损时,LPS进入血液,与TLR4结合后,LPS促进血小板中P选择素、白细胞介素-1β的表达,这会引起肺血管周围炎症反应的发生及原位血栓的形成,从而导致肺动脉高压的形成。上述证据表明,肠道菌群失调使LPS进入循环,从各个机制导致全身炎症和细胞凋亡,从而使血管内皮功能受损,导致心血管疾病的发生发展。
3.2.7 尿毒症毒素
尿毒症毒素是由肠道菌群代谢氨基酸衍生的代谢产物,蛋白质中的芳香族氨基酸(酪氨酸、苯丙氨酸和色氨酸)可被肠道菌群及肝脏代谢为毒素,如硫酸吲哚酚、吲哚葡萄糖醛酸、吲哚乙酸、对甲酚硫酸酯、对甲酚葡萄糖醛酸、马尿酸和PAA。研究[33]发现,硫酸吲哚酚可通过诱导血管内皮细胞凋亡、衰老、炎症、血栓形成以及降低NO生物利用度、减少细胞外囊泡的释放来损伤血管内皮。在内皮细胞中,硫酸吲哚酚、对甲酚葡糖醛酸可激活NF-κB信号通路,上调ICAM-1和单核细胞趋化蛋白-1表达,从而促进血管内皮功能障碍和动脉粥样硬化[5,34]。研究[33]表明,将硫酸吲哚酚作用于正常小鼠和大鼠的胸主动脉,发现硫酸吲哚酚可降低乙酰胆碱诱导的内皮依赖性血管舒张,这种作用可能归因于NO生物利用度降低。Omori等[35]纳入176例从未发生过心血管疾病的2型糖尿病患者和40例冠状动脉疾病患者,通过对患者的血浆进行非靶向代谢组学分析发现硫酸吲哚酚与颈动脉最大内膜中层厚度呈正相关,与FMD成负相关(P<0.05)。上述证据表明,尿毒症毒素可通过多种途径促进血管内皮功能障碍,调控尿毒症毒素可能是一种潜在的防治血管内皮功能障碍及动脉粥样硬化的方法。见图1。

注:AhR,芳香烃受体;HO-1,血红素加氧酶-1;CCL2,C-C基序趋化因子配体2;Gln,谷氨酰胺。
圖1 肠道菌群代谢产物对血管内皮功能的影响
4 结论与展望
近年来,肠道菌群代谢产物被发现参与多种人类疾病的发生发展,根据目前所有研究,可认为肠道菌群代谢产物是血管内皮功能障碍发生发展的重要环节。值得关注的是,由于肠道菌群数量大、种类多、长期动态变化且易受各种饮食习惯及环境因素的影响,导致建模困难,临床前研究远远不够,肠道菌群在分子水平上影响血管内皮功能的具体作用机制还无法明确阐述。因此,接下来要对肠道菌群及其代谢产物与血管内皮功能障碍的关系深入探索,并对肠道菌群及其代谢产物进行精准的靶向干预,这将为血管内皮功能障碍的预防及治疗带来新希望。
参考文献
[1] Xu S,Ilyas I,Little PJ,et al. Endothelial dysfunction in atherosclerotic cardiovascular diseases and beyond:from mechanism to pharmacotherapies[J]. Pharmacol Rev,2021,73(3):924-967.
[2] Battson ML,Lee DM,Jarrell DK,et al. Suppression of gut dysbiosis reverses Western diet-induced vascular dysfunction[J]. Am J Physiol Endocrinol Metab,2018,314(5):E468-E477.
[3] Zhang Q,Liu J,Duan H,et al. Activation of Nrf2/HO-1 signaling:an important molecular mechanism of herbal medicine in the treatment of atherosclerosis via the protection of vascular endothelial cells from oxidative stress[J]. J Adv Res,2021,34:43-63.
[4] Querio G,Antoniotti S,Geddo F,et al. Modulation of endothelial function by TMAO,a gut microbiota-derived metabolite[J]. Int J Mol Sci,2023,24(6):5806.
[5] Amedei A,Morbidelli L. Circulating metabolites originating from gut microbiota control endothelial cell function[J]. Molecules,2019,24(21):3992.
[6] Vanhoutte PM,Shimokawa H,Feletou M,et al. Endothelial dysfunction and vascular disease—A 30th anniversary update[J]. Acta Physiol (Oxf),2017,219(1):22-96.
[7] Tenopoulou M,Doulias P-T. Endothelial nitric oxide synthase-derived nitric oxide in the regulation of metabolism[J]. F1000Res,2020,9:F1000 Faculty Rev-1190.
[8] Barko PC,Mcmichael MA,Swanson KS,et al. The gastrointestinal microbiome:a review[J]. J Vet Intern Med,2018,32(1):9-25.
[9] Eckburg PB,Bik EM,Bernstein CN,et al. Diversity of the human intestinal microbial flora[J]. Science,2005,308(5728):1635-1638.
[10] Maiuolo J,Carresi C,Gliozzi M,et al. The contribution of gut microbiota and endothelial dysfunction in the development of arterial hypertension in animal models and in humans[J]. Int J Mol Sci,2022,23(7):3698.
[11] Cortés-Martín A,Iglesias-Aguirre CE,Meoro A,et al. There is no distinctive gut microbiota signature in the metabolic syndrome:contribution of cardiovascular disease risk factors and associated medication[J]. Microorganisms,2020,8(3):416.
[12] Kazemian N,Mahmoudi M,Halperin F,et al. Gut microbiota and cardiovascular disease:opportunities and challenges[J]. Microbiome,2020,8(1):36.
[13] Jin M,Qian Z,Yin J,et al. The role of intestinal microbiota in cardiovascular disease[J]. J Cell Mol Med,2019,23(4):2343-2350.
[14] Cui L,Zhao T,Hu H,et al. Association study of gut flora in coronary heart disease through high-throughput sequencing[J]. Biomed Res Int,2017,2017:3796359.
[15] Chen YH,Yuan W,Meng LK,et al. The role and mechanism of gut microbiota in pulmonary arterial hypertension[J]. Nutrients,2022,14(20):4278.
[16] Tsutsumi R,Yamasaki Y,Takeo J,et al. Long-chain monounsaturated fatty acids improve endothelial function with altering microbial flora[J]. Transl Res,2021,237:16-30.
[17] Malik M,Suboc TM,Tyagi S,et al. Lactobacillus plantarum 299v supplementation improves vascular endothelial function and reduces inflammatory biomarkers in men with stable coronary artery disease[J]. Circ Res,2018,123(9):1091-1102.
[18] Hemmati M,Kashanipoor S,Mazaheri P,et al. Importance of gut microbiota metabolites in the development of cardiovascular diseases (CVD)[J]. Life Sci,2023,329:121947.
[19] Li M,van Esch BCAM,Wagenaar GTM,et al. Pro- and anti-inflammatory effects of short chain fatty acids on immune and endothelial cells[J]. Eur J Pharmacol,2018,831:52-59.
[20] Brown JM,Hazen SL. Microbial modulation of cardiovascular disease[J]. Nat Rev Microbiol,2018,16(3):171-181.
[21] Gou X,Qin L,Wu D,et al. Research progress of Takeda G protein-coupled receptor 5 in metabolic syndrome[J]. Molecules,2023,28(15):5870.
[22] Guizoni DM,Vettorazzi JF,Carneiro EM,et al. Modulation of endothelium-derived nitric oxide production and activity by taurine and taurine-conjugated bile acids[J]. Nitric Oxide,2020,94:48-53.
[23] Walsh LK,Restaino RM,Neuringer M,et al. Administration of tauroursodeoxycholic acid prevents endothelial dysfunction caused by an oral glucose load[J]. Clin Sci (Lond),2016,130(21):1881-1888.
[24] Paeslack N,Mimmler M,Becker S,et al. Microbiota-derived tryptophan metabolites in vascular inflammation and cardiovascular disease[J]. Amino Acids,2022,54(10):1339-1356.
[25] Lu Y,Yang W,Qi Z,et al. Gut microbe-derived metabolite indole-3-carboxaldehyde alleviates atherosclerosis[J]. Signal Transduct Target Ther,2023,8(1):378.
[26] Scott SA,Fu J,Chang PV,et al. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J]. Proc Natl Acad Sci U S A,2020,117(32):19376-19387.
[27] Nguyen C,Edgley AJ,Kelly DJ,et al. Aryl hydrocarbon receptor inhibition restores indoxyl sulfate-mediated endothelial dysfunction in rat aortic rings[J]. Toxins (Basel),2022,14(2):100.
[28] Liu Y,Dai M. Trimethylamine N-oxide generated by the gut microbiota is associated with vascular inflammation:new insights into atherosclerosis[J]. Mediators Inflamm,2020,2020:4634172.
[29] Brunt VE,Gioscia-Ryan RA,Casso AG,et al. Trimethylamine-N-oxide promotes age-related vascular oxidative stress and endothelial dysfunction in mice and healthy humans[J]. Hypertension,2020,76(1):101-112.
[30] Nemet I,Saha PP,Gupta N,et al. A cardiovascular disease-linked gut microbial metabolite acts via adrenergic receptors[J]. Cell,2020,180(5):862-877.
[31] Chistiakov DA,Bobryshev YV,Kozarov E,et al. Role of gut microbiota in the modulation of atherosclerosis-associated immune response[J]. Front Microbiol,2015,6:671.
[32] Zhao J,Liu Z,Chang Z. Lipopolysaccharide induces vascular endothelial cell pyroptosis via the SP1/RCN2/ROS signaling pathway[J]. Eur J Cell Biol,2021,100(4):151164.
[33] Matsumoto T,Kojima M,Takayanagi K,et al. Role of S-equol,indoxyl sulfate,and trimethylamine N-oxide on vascular function[J]. Am J Hypertens,2020,33(9):793-803.
[34] Kumar T,Dutta RR,Velagala VR,et al. Analyzing the complicated connection between intestinal microbiota and cardiovascular diseases[J]. Cureus,2022,14(8):e28165.
[35] Omori K,Katakami N,Arakawa S,et al. Identification of plasma inositol and indoxyl sulfate as novel biomarker candidates for atherosclerosis in patients with type 2 diabetes—Findings from metabolome analysis using GC/MS[J]. J Atheroscler Thromb, 2020, 27(10) :1053-1067.
收稿日期:2023-09-24