反应后溶液中溶质成分的探究
丁新花


一、一个反应的成分判断
关于1个反应后溶质成分类探究猜想方向有2种:1.只含生成物;2.含生成物和其中1种过量的反应物。
例题1 (2023年潮州模拟)某兴趣小组用氢氧化钾溶液和稀硫酸进行中和反应实验。
(1)甲将约5mL氢氧化钾溶液放人烧杯中,然后滴加几滴无色酚酞溶液,此时溶液呈____色,接着用滴管滴入一定量的稀硫酸,再用玻璃棒搅拌,发现溶液变为无色,该反应的化学方程式为____。
(2)乙对反应后溶液中的溶质成分进行探究。
[提出问题]反应后溶液中的溶质是什么?
[猜想与假设]
猜想一:K2SO4
猜想二:K2SO4和KOH
猜想三:____
上述猜想,可直接排除的是____,原因是____。
[实验探究]为验证另2种猜想,乙设计表1实验方案。
[评价与反思]①丙针对上述方案提出质疑,认为方案1不合理,其原因____。
②经过反思与讨论,最后学生们认为方案2的Cu0粉末可用下列的某些物质代替,也能得到一样的实验结论,请选出可用药品的字母序号____。
A.Fe2O3 B.NaCl C.CaCO3 D.Cu
③在反应后所得溶液中溶质的成分分析时,不仅需想到生成物,还需考虑____。
解析 (1)甲将约5mL氢氧化钾溶液加入到烧杯中,再滴入几滴无色酚酞溶液,氢氧化钾溶液显碱性,这时溶液为红色;氢氧化钾和稀硫酸反应生成硫酸钾和水,该反应的化学方程式为:
2KOH+H2SO4=K2SO4+2H2O
(2)[猜想与假设]猜想一:恰好完全反应时只有K2SO4;猜想二:氢氧化钾过量时K2SO4和KOH;猜想三:稀硫酸过量时有K2SO4和H2SO4。以上猜想中,可以直接排除的是猜想二,原因是含有氢氧化钾的溶液能使酚酞溶液变红色,而实验中反应后的溶液为无色;[实验探究]若猜想三成立,则溶液中存在硫酸,硫酸能与氧化铜反应生成硫酸铜和水,反应产生的现象是固体粉末减少(或消失),溶液由无色变成蓝色;[评价与反思]①丙同学针对上述方案提出疑问,认为方案l是不合理的,原因是溶液中含有的K2SO4也能和BaCl2反应生成白色沉淀;②A.Fe2O3能与硫酸反应生成硫酸铁和水,将Fe2O3加入溶液中实验现象是固体粉末减少(或消失),溶液由无色变成黄色,现象明显,符合题意;B.NaCl不能与硫酸反应,加入NaCl无明显变化,不符合题意;C.CaCO3能与硫酸反应生成硫酸钙、二氧化碳和水,将CaCO3加入溶液中实验现象是产生气泡,现象明显,符合题意;D.Cu不能与硫酸反应,加入Cu无明显变化,不符合题意。故选AC。③在反应后所得溶液中溶质的成分的分析时,不仅需想到生成物,还需考虑到反应物之用量。
二、多个反应的成分判断
以混合后的现象为突破口,分析现象产生的原因,进一步分析判断,得出结论。生成物一定有(不需要验证),反应物可能有(需进一步验证)。
例题2 (2023年广西节选)化学兴趣小组进行稀硫酸化学性质的探究。回答下列问题:
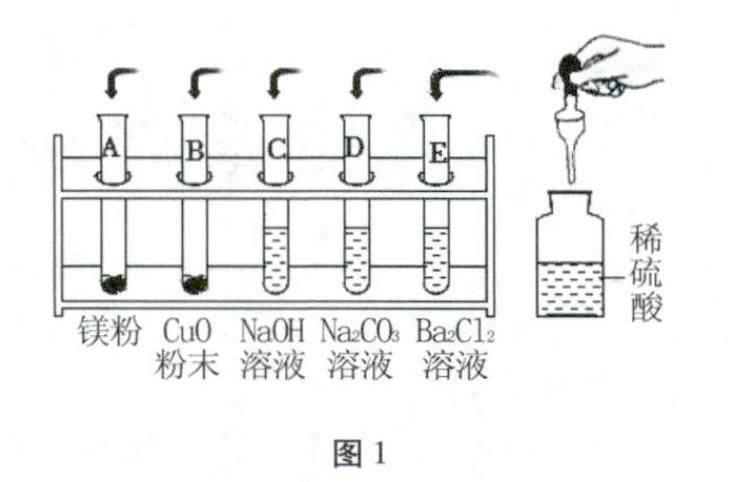
(1)将稀硫酸分别加入图1中的试管中,……
(2)上述实验结束后,化学兴趣小组继续探究(见表2)。
①步骤2滤液中,溶质的所有可能组合是____(填化学式)。
②步骤3中,产生白色沉淀之前,一定会发生反应的化学方程式是____。
解析 (2)①试管A中镁粉与稀硫酸反应生成硫酸镁和氢气,试管E中稀硫酸与BaCl2溶液反应生成硫酸钡沉淀和鹽酸,将试管A中物质全部倒入试管E中,产生气泡且白色沉淀增加,说明A试管中镁粉过量,E试管中氯化钡过量,试管A中的物质是镁和硫酸镁,试管E中的溶质是盐酸和氯化钡,硫酸镁与氯化钡溶液反应生成氯化镁和硫酸钡沉淀,镁与盐酸反应生成氯化镁和氢气,向滤液中逐滴滴加氢氧化钠溶液,开始无明显现象,一段时间后出现白色沉淀,说明滤液中含有HCl,则步骤2滤液中,一定含有MgCl2和HCI,可能含有BaCl2或MgSO4,故溶质的所有可能组合是MgCl2、HCl;MgCl2、HCl、BaCl2;MgCl2、HCl、MgSO4;②产生白色沉淀之前是盐酸与氢氧化钠溶液反应生成氯化钠和水,反应的化学方程式是:
NaOH+HCl=NaCl+H2O
(收稿日期:2024-01-08)

