丙泊酚减弱CCL4诱导脑微血管内皮细胞促炎和细胞毒作用机制研究
赵 娟,龚葛松
南通大学附属启东医院:1.麻醉科;2.神经内科,江苏南通 226200
脑卒中为常见急性脑血管疾病,致死率高,且近50%生存患者长期致残,预后差[1-2]。有研究表明,大脑缺血损伤后,中枢系统免疫细胞如巨噬细胞等被大量活化,释放细胞因子,而这些细胞因子及其招募活化的免疫细胞又可至损伤部位,造成二次损伤[3-5]。近年研究发现,趋化因子配体4(CCL4)在大脑缺血损伤后上调[6-8],其功能可能与破坏血脑屏障、促进T细胞招募至损伤部位有关[9]。有研究显示,脑微血管内皮细胞在炎症过程中可通过自分泌形式产生大量CCL4[10],但其作用机制尚不清楚。丙泊酚为临床手术常用麻醉剂,近年研究发现,丙泊酚除了具有麻醉效果外,还具备抗焦虑、神经保护、抗氧化、免疫调节活性[11-13],在大脑缺血损伤后的抗炎作用也有广泛报道[14],但丙泊酚对脑微血管内皮细胞保护作用报导较少。
本研究拟将CCL4与永生化人脑微血管内皮细胞hCMEC/D3体外孵育,观察CCL4对hCMEC/D3细胞增殖及凋亡的影响,同时分析炎症及促血栓形成相关基因表达情况。本研究将丙泊酚与CCL4联合处理,分析丙泊酚是否拮抗CCL4对脑微血管内皮细胞作用,以期为丙泊酚作为减少脑卒中患者二次损伤保护剂提供依据。
1 材料与方法
1.1材料来源 hCMEC/D3 人脑微血管内皮细胞购自中国科学院昆明细胞库。丙泊酚、人重组CCL4细胞因子购自北京科昕生物科技有限公司,凋亡试剂盒购自BD公司,环氧化酶-2(COX-2)活性测定试剂盒和凝血酶活性测定试剂盒购自英国Abcam公司。
1.2方法
1.2.1细胞培养及分组 采用hCMEC/D3细胞专用培养基(XY-h070-0016,上海信裕公司)置于37 ℃、5% CO2且湿度饱和的培养箱中培养。细胞分组如下:(1)对照组,采用生理盐水处理;(2)CCL4组,CCL4处理,质量浓度为500 pg/mL;(3)CCL4+丙泊酚组,CCL4及丙泊酚处理,质量浓度分别为500 pg/mL和10 μg/mL。
1.2.2CCK-8试验检测细胞增殖能力 将hCMEC/D3细胞制成单细胞悬液,分别接种于96孔板,每孔1 000个细胞,将接种好的 96孔板放入培养箱中。待24 h细胞贴壁后,对照组、CCL4组和CCL4+丙泊酚组各孔内分别更换为生理盐水(对照)、含CCL4及含CCL4和丙泊酚的培养液,并于加药时,以及加药24、48和72 h将10%的 CCK-8试剂加入待检测孔中,37 ℃孵育 4 h,每个时间点设置 6个复孔。采用酶标仪检测各时间点各孔的吸光度(A450)。
1.2.3Annexin V/PI双染检测细胞凋亡情况 将对数期生长的hCMEC/D3细胞,按3×105个/孔接种于6孔板中,分3组,每组设置3个复孔,各组分别加入等体积含0、500 pg/mL CCL4、10 μg/mL丙泊酚+500 pg/mL CCL4的培养液。置于培养箱中培养48 h,收集各孔培养液,磷酸盐缓冲液(PBS)清洗,收集所有细胞。各加入5 μL Annexin V和PI避光染色15 min。上机,采用流式细胞仪检测细胞凋亡情况,实验重复3次。
1.2.4实时荧光定量PCR(qPCR) 总RNA提取、逆转录及qPCR均按说明书操作。PCR反应条件:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 1 min,共40 循环。qPCR使用ABI 7500仪器进行。根据待测标本的Ct值,以β-actin作为内参,采用2-ΔΔCt法计算相对表达水平。引物序列见表1。

表1 PCR引物序列
1.2.5酶活性检测 将对数期生长的hCMEC/D3细胞,按3×105个/孔接种于6孔板中,分3组,每组设置3个复孔,各组分别加入等体积生理盐水或含500 pg/mL CCL4、10 μg/mL丙泊酚+500 pg/mL CCL4的培养液。按照说明书分别使用COX-2活性测定试剂盒和凝血酶活性测定试剂盒检测各组细胞COX-2活性和凝血酶活性。

2 结 果
2.1丙泊酚对CCL4诱导脑微血管内皮细胞细胞毒作用的影响 CCK-8试验结果显示:CCL4组与对照组比较,细胞增殖活力明显减弱(P<0.01);CCL4+丙泊酚组与CCL4组比较,CCL4+丙泊酚组细胞增殖活力显著增强(P<0.01);结果提示,丙泊酚对血管内皮细胞有保护作用。与此相符,细胞克隆试验结果表明,CCL4组细胞克隆形成数量显著低于对照组(P<0.01),丙泊酚+CCL4组可减弱CCL4对血管内皮细胞克隆形成的抑制作用(P<0.01)。见表2和图1。

注:A为3组细胞克隆形成试验结果;B为3组细胞形成克隆数量比较;**P<0.01。
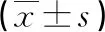
表2 3组细胞增殖能力及克隆形成能力比较
2.2丙泊酚对CCL4诱导血管内皮细胞凋亡作用的影响 流式细胞术检测结果显示,CCL4组细胞较对照组细胞凋亡率显著增加(P<0.01),CCL4+丙泊酚组较CCL4组细胞凋亡率显著降低(P<0.01)。见图2。

注:A为3组细胞凋亡流式图;B为3组细胞凋亡率比较;**P<0.01。
2.3丙泊酚对CCL4诱导血管内皮细胞相关炎症基因表达的影响 利用qPCR检测各处理组血管内皮细胞相关炎症基因的表达,结果发现,CCL4组细胞较对照组表达倍数显著升高(P<0.01),提示丙泊酚可明显抑制CCL4对血管内皮细胞炎症基因表达促进作用。COX-2活性测定结果显示,CCL4组细胞COX-2活性较对照组明显升高(P<0.01),提示丙泊酚可明显抑制CCL4对血管内皮细胞COX-2活性促进作用。见表3。
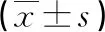
表3 3组细胞炎症基因相对表达倍数及COX-2相对活性比较
2.4丙泊酚对CCL4诱导血管内皮细胞细胞血栓形成相关基因的影响 qPCR检测结果显示,CCL4组细胞Thrombin、Factor 8、VWF、TXA较对照组基因的表达倍数显著升高(P<0.01),提示丙泊酚可明显抑制CCL4对血管内皮细胞血栓形成表达促进作用。凝血酶活性测定结果发现,CCL4组细胞凝血酶活性较对照组明显升高(P<0.01),而丙泊酚可明显抑制CCL4对血管内皮细胞凝血酶活性促进作用。见表4。
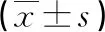
表4 3组细胞血栓形成相关基因相对表达水平及凝血酶活性比较
3 讨 论
CCL4又称为巨噬细胞炎性蛋白1β(MIP-1β),可选择性与穿膜受体CCR5结合,在炎症处招募单核细胞、T细胞等免疫细胞[15-16]。体外实验表明,CCL4可显著促进血管内皮细胞ROS形成,促进单核细胞THP-1与内皮细胞结合,从而发挥炎症效应[17]。然而,关于CCL4对脑微血管内皮细胞的直接作用的报道较少。本研究用重组CCL4因子处理脑微血管内皮细胞,培养24 h即出现增殖活力显著下降现象,培养72 h后CCL4处理组细胞增殖活力为对照组的60%,表明CCL4对脑微血管内皮细胞增殖有显著抑制作用。与此相符,本研究还发现,CCL4处理组细胞较对照组细胞的细胞克隆形成能力减弱,并且诱导细胞凋亡率增加,表明CCL4对血管内皮细胞有直接的毒性作用。
脑缺血可促进炎症环境形成,除巨噬细胞、淋巴细胞外,血管内皮细胞本身在脑部受损后可释放细胞因子[18-20]。本研究利用qPCR检测CCL4诱导后内皮细胞释放细胞因子表达变化,结果发现CCL4诱导后,血管内皮细胞表达相关炎症因子IL1-β、IL-6、IL-8及TNF-α水平显著上调,同时炎症通路核心转录因子NF-κB水平上调;COX-2水平及体外酶活性在CCL4刺激下显著升高,表明CCL4不仅对脑微血管细胞有细胞毒作用,还能激活内皮细胞表达炎症因子及COX-2,促进受损环境的炎症反应。除炎症外,内皮细胞可表达血栓形成相关基因,参与凝血级联反应,在脑卒中缺血损伤起到重要作用[21]。本研究结果显示,CCL4可明显诱导细胞凝血酶活性、Factor 8、VWF及TXA的表达,表明CCCL4可通过刺激脑微血管内皮细胞炎症反应影响血栓形成。
丙泊酚作为静脉麻醉剂有诸多优点,如镇静、催眠、遗忘效应、作用时间短、起效快、易于控制、清醒时间快、不易引起药物蓄积等[22-23],因此广泛用于肿瘤切除手术中。丙泊酚除麻醉效应外,还具有抗炎、神经保护作用,但其药理机制不明确。本研究发现,丙泊酚可缓解CCL4对脑微血管内皮细胞增殖、克隆形成的抑制,减弱CCL4对内皮细胞凋亡诱导作用。在抗炎方面,丙泊酚可CCL4对内皮细胞诱导炎症基因表达作用。此外,丙泊酚也能拮抗CCL4对内皮细胞促血栓基因表达的作用。目前,丙泊酚调控细胞内重要分子的研究报导较多,包括信号通路、非编码RNA及表观遗传调控[24-26]。丙泊酚拮抗CCL4细胞毒作用、拮抗CCL4诱导细胞炎症反应和促血栓形成反映可能与丙泊酚调控分子网络有关,有待进一步研究。
综上所述,CCL4可对脑微血管内皮细胞有细胞毒作用,细胞增殖活力及细胞克隆形成能力下降、细胞凋亡率增加;CCL4还能促进脑微血管内皮细胞炎症反应及促血栓形成相关基因表达上调,而丙泊酚可抑制CCL4上述作用,可为丙泊酚作为减少脑卒中患者二次损伤保护剂提供实验依据。

