多发性骨髓瘤累及胰腺患者的临床分析
应双伟,虞义建,张杰,沈健,杨艳,朱夏吟,邵燕萍,郭群依
台州医院 血液肿瘤内科,浙江 台州 317000
髓外受累(extramedullary disease, EMD)是多发性骨髓瘤(multiple myeloma, MM)的一种侵袭性形式,以一个克隆和/或亚克隆独立于骨髓微环境而生长为主要特征[1]。目前公认的EMD定义仅限于由血行扩散引起的软组织浆细胞瘤且与骨结构没有接触,其在新诊断和复发/难治的MM患者中的发病率分别占0.5%~4.8%和3.4~14%,前者EMD通常累及皮肤和软组织;而后者可累及肝、淋巴结、中枢神经系统和胸膜等部位[2]。而胰腺受累(以下简称胰腺EMD)极为罕见,目前英文文献仅近40例报道[3],本研究回顾分析浙江省台州医院近10年于血液肿瘤内科收治的4例MM合并胰腺EMD患者的临床表现、治疗及转归。
1 对象和方法
1.1 入组患者
回顾性分析2011年10月至2021年10月入住浙江省台州医院住院的MM患者。常规检测血常规、超敏C反应蛋白、生化、血清免疫球蛋白、血尿轻链及免疫固定电泳、β微球蛋白、肿瘤系列;骨髓检测形态学、免疫分型、染色体、荧光原位杂交 (fluorescence in situ hybridization, FISH);影像学评估全身骨质破坏及EMD;MM诊断依据中国多发性骨髓瘤指南[4];分期按照国际分期系统(international staging system, ISS)及Durie-Salmon分期系统进行分期[4]。
1.2 胰腺累及前MM患者的治疗和疗效评估
治疗方案选择参考当时中国多发性骨髓瘤指南[4],主要采取蛋白酶体抑制剂为基础的联合化疗 方案,1 例采取自体干细胞移植巩固。疗效评价参照国际骨髓瘤工作组(international myeloma working group, IMWG)的疗效标准。
1.3 胰腺累及时的临床表现、影像学和病理学特征
考虑MM累及胰腺时,通过完善生化、淀粉酶、肿瘤系列、MM相关指标以及腹部B超、腹部平扫+增强CT或全身PET/CT等手段全面评估MM,同时采用经皮超声引导下穿刺活检术或超声内镜下细针穿刺术(endo-scopic ultrasonography guided fine needle aspiration, EUS-FNA)获取病理组织,常规石蜡包埋、切片、HE染色及二步法SP免疫组织化学检测,在显微镜下观察胰腺肿物组织中的细胞的成分及分布。
1.4 胰腺累及后MM患者的治疗转归
治疗主要分为局部和全身,局部予经皮肝穿刺胆道引流术(percutaneous transhepatic cholangiography and drainage, PTCD)或内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)+胆道塑料支架置入术;全身予联合化疗,退黄护肝,以及抗感染、营养等对症支持治疗。通过症状体征、实验室指标以及影像学评价疗效。
2 结果
2.1 基本特征
4 例患者,男3 例,女1 例,年龄53~64 岁;3例IgG/λ,1例IgG/κ;DS分期IA期2例、IIIA期2例;ISS分期II期2例、III期2例;2例正常核型、2例存在复杂核型,1例存在1q21扩增;病例4初诊时存在全身多发骨质破坏,而其余3例无;4例在初诊时均不存在EMD,而胰腺EMD发生前或发生时均存在1个部位或以上的胸膜、腹膜、软组织、肝脏、淋巴结或硬脑膜的累及(表1)。分析骨髓及EMD中CD56的表达情况(表2),其中病例2和病例3中的胸腹水流式分析和胰腺EMD免疫组织化学的CD56均提示(-)。

表1 4例MM累及胰腺EMD患者的临床特征

表2 骨髓和EMD中CD56的表达情况
2.2 胰腺累及前治疗和疗效评估
以下4个病例的时间均从确诊日开始计算。
病例1:予PAD(硼替佐米+表柔比星+地塞米松)×4疗程,达完全缓解(complete remission, CR),未维持治疗,92.2 个月后出现贫血、肾功能不全,骨髓示原始浆细胞14%,PET/CT示:胸腹腔淋巴结肿大、胸膜、胰腺浸润。
病例2:予PCD(硼替佐米+环磷酰胺+地塞米松)×4疗程,疗效达CR,未维持治疗,12个月后出现胸闷,胸水证实骨髓瘤性胸腔积液,但骨髓形态缓解(bone marrow remisson, BMR)及流式微小残留病变(minimal residual disease, MRD)阴性,再次行PCD×3疗程,期间出现间质性肺炎,治疗后好转,17.4个月后出现左脸颊浆细胞瘤,予DECP(顺铂+依托泊苷+环磷酰胺+泼尼松)×4疗程,肿物消退,未随访,31个月后眼黄乏力就诊,CT示胰腺肿物。
病例3:予PAD×4疗程,疗效达CR,未维持治疗;67.8个月后出现腰背部疼痛,CT示胸腰椎多发骨质破坏,骨髓示复发,予PCD×4疗程;72个月后PET/CT提示:全身骨弥漫不均匀骨质密度异常,左肝结节、左侧肾上腺占位,糖代谢增高,考虑MM浸润,予DECP×4疗程;75.3个月后出现眼黄、尿黄,腹部CT提示胰腺占位。
病例4:予RVD(来那度胺+硼替佐米+地塞米松)×4 疗程,疗效达非常好的部分缓解(very good partial response, VGPR),采集自体干细胞后继续巩固RVD×2 疗程,8.8 个月后行自体干细胞移植,移植2 个月后行PD(硼替佐米+地塞米松)方案维持,15.6 个月后血清游离轻链λ轻链288.2 mg/L, κ/λ 0.035(0.26~1.65),骨髓BMR,流式MRD 0.03%,考虑进展,给予VRD方案治疗2 周后出现头痛伴腹泻、伸舌右歪,颅脑MRI增强示“颅骨及硬脑膜多发结节”,脑脊液形态及流式细胞学未见异常。16.3个月后骨髓示原幼浆细胞占34.5%,完善PET/CT示:胰腺肿大,弥漫性糖代谢增高; 全身多发骨质破坏。腹部增强CT示:胰腺多发占位,伴胰管局限性扩张、胰腺炎,结合病史考虑胰腺浆细胞瘤。
2.3 胰腺累及的临床表现、影像学及病理表现
2.3.1 临床特征 3例乏力,2例腰酸,2例眼黄,1 例无不适;3 例表现为血淀粉酶升高(另1 例未检测),2 例胆红素升高,分别达150.5 μmol/L和 165.5 μmol/L;4例CEA均正常,2例CA199升高(其中病例3达2 250.3 U/mL)。
2.3.2 影像学特征 4例均累及胰头,病例1累及胰尾、病例4累及胰体尾;经腹B超对于早期胰腺EMD不敏感(如病例1和2未探及胰腺异常回声),超声内镜有更高的敏感性(如病例3);CT多提示稍低密度,增强后轻度强化,伴或不伴胰胆管扩张;早期胰腺EMD,PET/CT的标准摄取值(standard uptake value, SUV)可轻度升高,如病例1(胰头及胰尾部局部肿大,FDG摄取异常,最大SUV约5.8,胰管轻度扩张)和病例4(胰腺肿大,FDG弥漫性摄取异常,最大SUV约4.9);而后期的胰腺EMD,SUV常明显升高,如病例3(肝门部、胰头区见软组织密度团块影,最大SUV约20.2,见图1);病例4曾怀疑过自身免疫性胰腺炎,增强CT见占位性病变,提示增强CT和PET/CT存在互补。
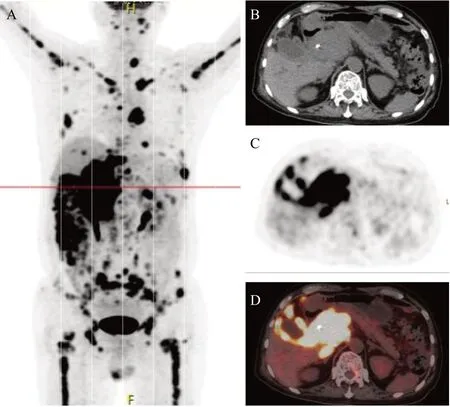
图1 多发性骨髓瘤累及胰腺的PET/CT表现
2.3.3 病理特征 病例2: (经皮超声引导下穿刺)镜下异型细胞显示浆细胞样外观,核圆形,偏心核,丰富的深嗜碱性细胞质,弥漫片状排列。免疫组化结果:CD38(+),CD138(+),Kappa(+),Lambda(-),CD56(-),Ki-67(40%+)。
病例3: (经EUS-FNA)镜下见少量固缩及退变坏死的异型细胞,核偏位,胞浆红染,大部分细胞挤压明显,间质疏松。免疫组化:CD38(少量细胞+),CD138(少量细胞+),CD56(-),Ki-67(高表达>90%+),Kappa(-),Lambda(++)。
2.4 胰腺累及后MM患者的治疗转归
以下4个病例的时间均从确诊日开始计算。
病例1:PDD(硼替佐米+脂质体多柔比星+地塞米松)×1疗程后贫血、肾功能不全、恶性胸水改善,继续巩固PDD×2疗程,后因周围神经病,改予IDD(伊莎佐米+脂质体多柔比星+地塞米松)×1疗程,复查胰腺占位较前增大,予IRD(伊莎佐米+来那度胺+地塞米松)×2 疗程,胰腺肿物较前缩小,但短期再次进展,予PTCD术,后因合并感染性休克,100个月后死亡。胰腺EMD后总生存期(overall survival, OS)为7.8个月。
病例2:经皮超声引导下穿刺活检证实胰腺EMD,予DECP×2 疗程,总胆红素下降至27.7 μmol/L, 但同时继发严重肺部感染,后于当地继续对照支持治疗,于35个月后死亡。胰腺EMD后OS仅4个月。
病例3:通过EUS-FNA证实胰腺EMD,75.9个月后行ERCP下胆管支架置入术,76.4 个月复查PET/CT示:肝门部、胰头区见软组织密度团块影,边界不清,累及邻近门脉左右支、下腔静脉、右肾静脉, FDG摄取异常,最大SUV约20.2;原左肝结节及左侧肾上腺占位未见显示。考虑到患者体能状况差,病变广泛,胆红素异常升高,难以耐受强化疗,予IRD方案,期间出现肿瘤溶解综合征、败血症,于77个月后死亡。胰腺EMD后OS仅1.7个月。
病例4:拒绝胰腺穿刺和强化疗方案,予RD(来那度胺+地塞米松)方案治疗,17.9 个月后复查CA 199降至13.3 U/mL,19个月后复查示胰腺体尾部占位较前缩小,但胰周出现新发病灶,拒绝住院,20.9个月后末次门诊随访总胆红素达299 μmol/L,后1周死亡。胰腺EMD后OS仅4.9个月。
3 讨论
MM累及胰腺相当罕见,已报道的35例病例中,中位年龄为60岁,男女比例约2:1,本文4例,年龄53~64岁,男3例,女1例,跟文献报道相仿[3,5]。胰腺EMD与MM的诊断时间间隔为3 d到15 年不等,可发生于骨髓缓解期或进展期,也可以发生于自体移植后[3,6-7]。本中心4例胰腺EMD确诊距离MM最短时间为16.3个月,最长为92.2个月;3例同期存在髓内复发,1例发生在自体移植后。胰腺EMD以IgG和IgA两种亚型为主[8],与MM的亚型特点一致,本中心4例均为IgG型,跟文献报道相仿。
EMD的发病机制尚未完全明确,有文献报道CD56表达的下调参与了EMD的发生[9],本文病例2和病例3存在复杂染色体核型的同时,骨髓和胰腺EMD中CD56的表达明显下调可能起到一定的促进作用。
74%胰腺EMD累及胰头部(其中30%同时累及尾部),14%仅累及胰体部,12%表现为胰腺弥漫性肿 大[3],本中心4例均累及胰头,病例1累及胰尾,而病例4的PET/CT示胰腺弥漫性肿大,SUV轻度升高,起初误诊为自身免疫性胰腺炎,完善增强CT示头体尾占位,与上述报道相仿,也提示增强CT与PET/CT有互补作用。此外,近半数胰腺EMD同时存在临 近脏器的受累,最常见的部位是胃、十二指肠和肝脏[3],本文病例3同时累及肝脏、胆囊、腹腔淋巴 结。
胰腺EMD的临床症状与肿块的位置和大小密切有关。由于胰头最易累及,梗阻性黄疸和腹痛较为常见[3]。本文2例表现存在梗阻性黄疸表现,但4例均无明显腹痛,3例存在乏力,2例存在腰酸,1例无上述不适提示其发生比较隐匿。虽4例患者均未表现出腹痛,但3例经检患者的血淀粉酶均升高,因此仍需警惕急性胰腺炎的发生。
对于胰腺占位而言,胰腺癌需要着重鉴别,临床主要依赖肿瘤标志物、影像学和病理。胰腺癌多伴随血清CA199的升高,而既往报道的大多数胰腺EMD中,大多数血清CA199水平正常,而部分血清CEA水平明显升高[3],而本中心患者的CEA均处在正常水平,血清CA199在2例中明显升高,尤其是病例3中CA199水平达到2 250.3 U/mL,后在病理中证实为胰腺EMD,而病例4虽未经病理证实但经过治疗后CA199曾降至正常,结合病史考虑胰腺EMD。胰腺癌和胰腺EMD在CT平扫中多表现为低密度或等密度,增强后多呈现轻度或者不强化,PET/CT可提高诊断敏感性[10],但单独依靠CT和PET/CT来鉴别两者存在一定困难。目前可通过EUS-FNA、经皮超声引导下的活检术、CT引导下细针抽吸、手术四种措施获取胰腺肿物病理,本文病例2经皮超声引导下穿刺活检、病例3通过EUS-FNA获取病理且较为安全。
EMD作为MM的一种侵袭性形式,平均OS约36个月[5]。胰腺EMD出现时多伴随周边或者远处部位累及,常提示疾病终末期,在现有文献报道中,胰腺EMD确诊后最长的无症状随访期为2年,但随后出现复发[11],而最短的生存时间仅为诊断后数天,感染是其主要的死因[3,12]。本中心4例确诊胰腺EMD时或之前均存在其他部位EMD的累及,确诊胰腺EMD后OS仅1.7~7.8个月,本文3例患者终末期合并了严重的感染,以上与文献报道相仿。
胰腺EMD由于部位的特殊性,往往需要局部联合系统治疗,局部治疗包括手术、放疗、PTCD引流、胆道支架置入等措施[3],本文3例患者局部采取了PTCD和ERCP下胆管支架置入术。系统化疗尚未达成共识,含硼替佐米、来那度胺、铂类、蒽环类方案,如VRD、DT-PACE(地塞米松/沙利度胺/顺铂/阿霉素/环磷酰胺/依托泊苷)等可能会取得一定疗 效[12],但是体能状态、肝功能不全和严重感染风险等限制了强化疗的广泛应用,本中心病例1和2采取了含蒽环类和铂类的化疗药物,病例3和4接受了含来那度胺的方案,虽早期获得部分缓解,但短期进展。而新型药物联合治疗(例如含CD38单抗、卡非佐米、塞利尼索等)或CAR-T等[2]是否能给该类患者带来更好的预后值得进一步探索。
综上,MM继发胰腺累及极为罕见,可在MM的不同阶段出现,常伴随或者晚于其他部位的EMD出现,一旦出现往往意味着疾病终末期,CD56表达下调可能参与其发生发展,目前尚无有效的治疗手段,新型药物的联合治疗或可改善疗效。

