基质血管片段通过ANG-1/Tie-2信号通路促进移植脂肪血管再生和存活
倪彬婷,何玉仓,李磊,徐金钰,柳朝阳,李力群
1.温州医科大学附属第一医院 整形外科,浙江 温州 325015;2.温州医科大学 第二临床医学院,浙江 温州 325035
近年来,自体脂肪移植技术在整形修复重建中有着广泛的应用,因其良好的生物相容性,被认为是一种很好的软组织填充材料[1]。然而,移植物液化坏死等原因,导致移植后的脂肪存活率不高[2-3],因此提高脂肪移植成活率是目前研究的热点之一。移植脂肪的存活主要与早期新生血管形成有关。基质血管片段(stromal vascular fraction, SVF)可促进自体脂肪移植后新生微血管的数量和发育[4]。前期进行的研究中,采用SVFs加缓释血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管生成素-1(angiopoietin-1, ANG-1)-PLGA微球改善小鼠脂肪移植存活的研究[5]证实了其在改善自体脂肪移植后的血管生成和移植物存活的应用。ANG-1是血管生成素家族的重要成员,在血管生成中起重要作用[6-7]。在内皮-周细胞共培养实验中,Dickkopf-2介导的近胞素通过血管生成素-1/酪氨酸激酶受体-2(angiopoietin-1,ANG-1/tyrosine kinase receptors-2, Tie-2)信号通路改善血管生成[8]。因此,为了进一步探究SVFs促进脂肪移植后血管生成的机制,引入ANG-1/Tie-2信号通路,来探讨其是否在SVFs促进脂肪移植后血管生成中发挥重要作用。
1 材料和方法
1.1 材料
1.1.1 实验动物 4周龄雌性BALB/c-nu无胸腺裸鼠16只,购自浙江维通利华实验动物技术有限公司桐乡分公司,动物许可证号:SCXK(浙)2020-0002。所有动物被安置12 h/12 h的明暗圈中,并提供充足食物和水。动物实验均经温州医科大学附属第一医院实验动物伦理委员会批准(伦理审查号:WYYYIACUC-AEC-2023-001)。
1.1.2 试剂 兔多克隆抗体CD31(28083-1-AP)、兔多克隆抗ANG-1(23302-1-ap)、小鼠单克隆抗体GAPDH(60004-1-Ig)、辣根过氧化物酶HRP标记亲和纯山羊抗鼠IgG(H+L,sa000001-1)和酶标亲和纯山羊抗兔抗体IgG(H+L,SA00001-2)购自美国Proteintech公司;兔亲和分离磷酸化Tie-2 抗体
(SAB4503999)购自于美国Sigma-Aldrich公司;兔多克隆抗B淋巴细胞癌基因2(B-cell lymphoma-2,BCL-2)抗体(ab196495)、小鼠单克隆抗CD29抗体(ab30394)、小鼠单克隆抗CD31抗体(ab9498)、小鼠单克隆抗CD44抗体(ab6124)、小鼠单克隆抗CD45抗体(ab40763)、小鼠单克隆抗CD90抗体(ab23894)和647 标记的驴抗IgG二兔抗(H+L,ab150075)购自美国Abcam公司;兔源性抗BAX一抗(2772)购自美国Cell Signaling Technology公司;酪氨酸激酶抑制剂1(tyrosine kinase inhibitor 1, TKI1)(HY-100556)购自美国MedChemExpress公司。
1.2 方法
1.2.1 脂肪组织的获取和SVFs分离 选取2023年2月温州医科大学附属第一医院整形外科需接受抽脂手术的1例患者,在签署知情同意书后,应用真空负压吸脂术从无潜在疾病的腹部吸脂手术患者体内获得废弃的脂肪组织。将人体脂肪组织分成两部分,一部分用于提取SVFs,其中部分SVFs传代至第三代进行鉴定。脂肪组织的另一部分留存加工成微颗粒脂肪,根据所设计的体内动物实验模型,将微颗粒脂肪分组经皮下注射到裸鼠体内,见图1。分离SVFs详细步骤如下:取脂肪组织在37 ℃下用0.125%的胶原酶I消化45 min,之后在DMEM培养基中添加10%胎牛血清和0.1%青霉素终止消化。随后使用100 μm细胞滤器去除结缔组织。细胞悬液在25 ℃下通过1 200 r/min离心5 min后以获得SVFs,最后加入红细胞裂解缓冲液以裂解细胞悬液中的红细胞后离心重悬,使用自动细胞计数器确保细胞密度为1×106/mL。本研究获我院伦理委员会批准[批件号:临床研究伦审Issuing Number(2022)第(R207)号]。
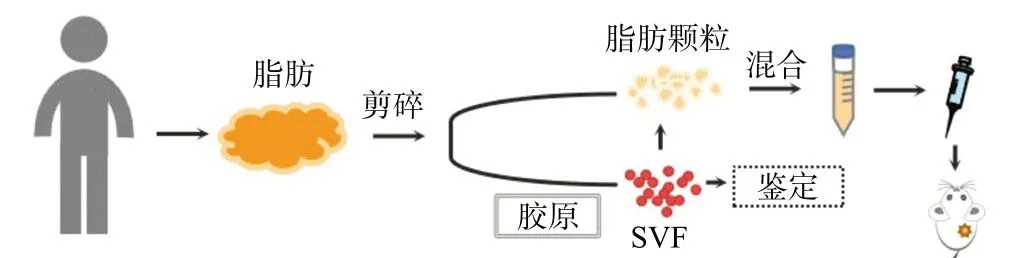
图1 脂肪提取和加工成微颗粒脂肪和SVFs的过程示意图
1.2.2 SVFs的培养和鉴定 在37 ℃含5% CO2的培育箱中孵育SVFs,每3 d更换一次培养基。当生长达到适当的密度时进行传代,收集第三代SVFs作进一步鉴定。具体鉴定方法:使用人分化集群CD29 (10 μg/mL)、CD31(1:20)、CD44(1×106细胞/μg)、 CD45(1:20)、CD90(1×106细胞/μg)的抗体对细胞进行标记,使用流式细胞术对细胞进行鉴定。
1.2.3 建立脂肪移植裸鼠模型 为了探讨SVFs对血管生成和脂肪存活情况的影响,设置3组脂肪移植裸鼠模型。对照组移植物为0.3 mL微量脂肪混合0.2 mL DMEM;SVFs组移植物为0.3 mL微量脂肪混合0.2 mL SVFs;TKI组移植物为0.3 mL微量脂肪混合0.2 mL SVFs和1.79 μg TKI1。确认各裸鼠健康状况良好后,所有小鼠均采用1.5%的异氟醚面罩吸入麻醉,接着对裸鼠进行脂肪移植。在每只裸鼠背部随机选择3个不同位置使用14G针头皮下注射不同的混合物(每个部位0.5 mL),见图2。麻醉清醒 后,在同等环境下饲养裸鼠,定时定量供给食物和水,每只裸鼠在术后8周的实验观察期间健康状况良好。记录观察后称体质量,采用Western blot法进行蛋白检测,组织切片后进行组织学观察。

图2 移植脂肪的处理和移植物存活情况的检测过程
1.2.4 标本收集 饲养至第8周,所有裸鼠用戊巴比妥钠麻醉后处死。通过大体观察、组织学观察和Western blot法对获得的脂肪组织移植物进行评估,见图2。称量各组每个脂肪组织团块的重量,以进一步统计分析。随后将脂肪组织在-80 ℃保存,以便进一步进行Western blot检测。用裂解缓冲液从脂肪组织中提取总蛋白,使用放射免疫沉淀法(radioimmunoprecipitation assay, RIPA)进行进一步分析。其中裂解缓冲液中包含有匀浆缓冲液、1%蛋白酶抑制剂和1%磷酸酶抑制剂。部分脂肪组织用4%多聚甲醛固定24 h,石蜡包埋切片,切片为5 μm厚度,用于后续免疫荧光染色和病理染色。
1.2.5 HE染色和Masson染色 HE染色为各组脂肪组织切片使用95%乙醇固定20 min,PBS洗涤2次,每次1 min。苏木素染液染色2~3 min,自来水洗涤。浸入伊红染液染色1 min,自来水洗涤。吹干后中性树胶封片。然后在光学显微镜下观察。 Masson染色为各组脂肪组织切片依次浸泡二甲苯I 5 min,二甲苯II 5 min,二甲苯III 5 min,无水乙醇1 min,95%乙醇1 min,75%乙醇1 min,自来水冲洗数秒;用配置好的铁苏木素(Weigert)染色液染色8 min;酸性乙醇分化液分化15 s后水洗; Masson蓝化液返蓝5 min后水洗。蒸馏水洗1 min;丽春红品红染色液染色5 min;弱酸工作液洗1 min; 磷钼酸溶液洗1 min,弱酸工作液洗1 min;苯胺蓝染色液染2 min,弱酸洗1 min;最后95%乙醇快速脱水2~3 s,无水乙醇脱水3次,每次5~10 s,二甲苯透明3次,每次1~2 min,中性树胶封固。然后在光学显微镜下观察。
1.2.6 免疫荧光染色 各组切片经脱蜡、梯度水化后,进行高压抗原回收,恢复抗原活性。在磷酸盐缓冲液中用5%牛血清白蛋白制备组织切片,在37 ℃ 下阻断1 h。接着在4 ℃下用CD31(1:1 000稀释)孵育过夜。组织切片用647 标记的驴抗兔IgG二抗(H+L)在37 ℃孵育2 h,然后用DAPI染色。染色后用共聚焦显微镜观察组织切片,检测指标。
1.2.7 Western blot分析 脂肪组织切片用RIPA裂解缓冲液裂解。用考马斯亮兰(Bradford)法定量测定脂肪组织中的蛋白质浓度。将每个蛋白样品稀释至40 μg/10 μL的浓度后,将样品中的蛋白质用10%~12%的SDS-PAGE分离,将分离的蛋白质转移到0.22 μm的聚偏氟乙烯膜上,在室温下用5%的脱脂牛奶溶液封闭膜,之后用一抗在4 ℃下孵育过夜,前述中使用的一抗包括:GAPDH(1:1 000稀释)、ANG-1(1:1 000稀释)、磷酸化酪氨酸激酶受体-2(p-tyrosine kinase receptors-2, p-Tie-2)(1:1 000 稀释)、CD31(1:1 000 稀释)、凋亡相关蛋白BCL-2(1:1 000稀释)、BCL-2相关蛋白X(BCL-2-associated X, BAX)(1:1 000稀释)。用Tris缓冲盐水和Tween®20缓冲液洗涤3次后,将膜与相应的酶标二抗在室温下孵育2 h。使用ChemiDoc XRS成像系统(Bio-Rad)检测蛋白条带信号,使用ImageJ软件定量条带密度。
1.3 统计学处理方法
采用GraphPad Prism 9统计软件进行分析。计量资料以±s表示,多组间比较用单因素方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 人类脂肪组织中SVFs的鉴定
人体脂肪组织中提取的SVFs,传代至第三代进行鉴定。SVFs表现出典型的纺锤形(梭形),见图3A1。将SVFs诱导分化为脂肪和软骨,结果显示SVFs具有优异的分化能力,见图3A2和图3A3。流式细胞仪检测分析结果显示,细胞强烈表达干细胞标记物CD29、CD44和CD90,而CD31和CD45标记物为阴性,符合SVFs的特征,见图3B。这提示分离所得的SVFs具有良好的干细胞特性。
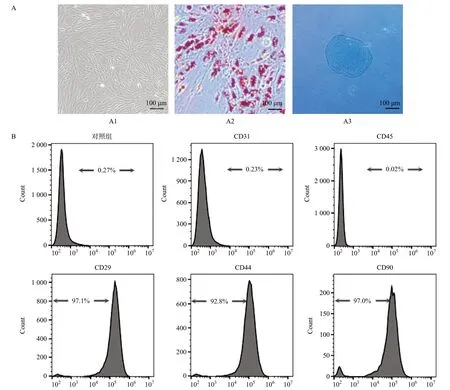
图3 SVFs的分离、鉴定及成脂、成软骨分化
2.2 SVFs对脂肪移植物大体形态的影响
裸鼠脂肪移植8 周后观察脂肪移植体形态。SVFs组脂肪移植物略大于对照组和TKI组,见图4A。SVFs组的移植物质量明显大于其他两组,差异有统计学意义(P<0.001),提示SVFs可促进脂肪移植物的存活。在给予TKI1后,SVFs对移植物脂肪大小和质量这一改善的过程被逆转,TKI组脂肪移植物大小及质量均小于SVFs组,差异有统计学意义(P<0.001),见图4B。这表明Tie-2可能是SVFs改善脂肪移植后血管生成和移植物存活的关键靶点。
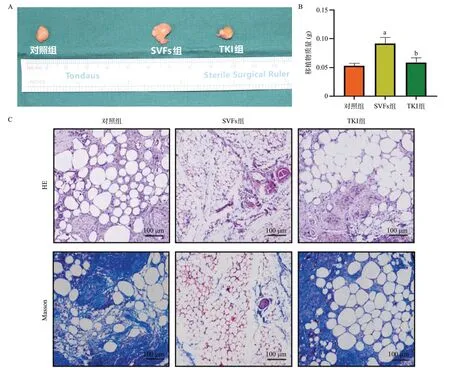
图4 各组移植脂肪组织大体形态、脂肪细胞形态及纤维化程度
2.3 SVFs对脂肪移植物组织形态的影响
HE染色显示SVFs组的脂肪细胞比对照组更致密、更饱满,见图4C,说明SVFs维持了脂肪细胞的完整性,提高了脂肪移植的存活率。Masson染色显示,与对照组比,SVFs组脂肪细胞周围胶原沉积明显减少,见图4C,表明SVFs抑制了脂肪组织纤维化。在SVFs组观察到更好的毛细血管网络,见图4C,表明SVFs具有巨大的血管生成潜力。对于TKI 组,Tie-2 受抑制后脂肪组织变得更加碎片化和不完整,脂肪组织纤维化程度增强。因此,SVFs组移植脂肪组织比TKI组更加饱满,纤维化程度减低。
2.4 SVFs通过ANG-1/Tie-2信号通路改善移植脂肪的存活
Western blot结果显示,SVFs组移植物较对照组ANG-1和p-Tie-2蛋白表达水平升高,差异有统计学意义(P<0.05);TKI组较SVFs组ANG-1表达增加,但p-Tie-2表达减少,差异有统计学意义(P<0.05),说明TKI对Tie-2产生了有效抑制,见图5A-C。SVFs组CD31表达较对照组显著增加,差异有统计学意义(P<0.05);TKI组较SVFs组CD31蛋白表达水平下降,差异有统计学意义(P<0.05),见图5A和图5D。CD31免疫荧光显示了类似的趋势,见图5G。
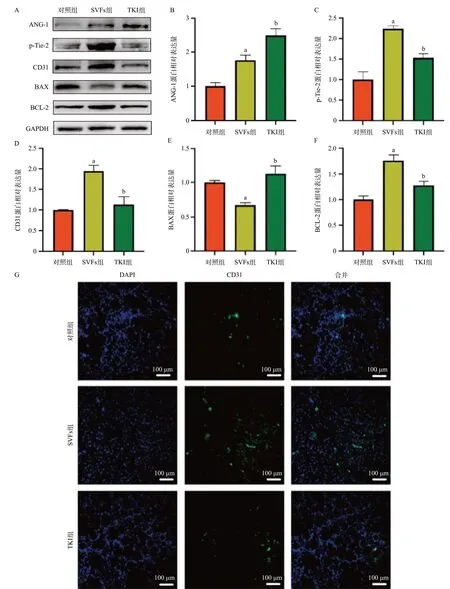
图5 SVFs通过ANG-1/Tie-2途径调节脂肪移植物存活并减少细胞凋亡
2.5 SVFs抑制脂肪移植后细胞凋亡
SVFs组较对照组BAX蛋白表达降低,BCL-2蛋白表达升高,差异有统计学意义(P<0.05);TKI组较SVFs组BAX蛋白表达升高,BCL-2蛋白表达降低,差异有统计学意义(P<0.05),见图5A、5E、5F。这提示SVFs可能通过抑制细胞凋亡来提高脂肪移植的存活率。
3 讨论
自体脂肪移植自1893年首次提出以来,其在整形和重建修复手术中展现出了巨大的潜力,临床应用包括再生医学、瘢痕修复、面部年轻化以及缺损组织体积修复[9]。近年来,研究人员和临床医师采用各种制备方法,制备如富血小板血浆(plateletrich plasma, PRP),减少免疫和炎症反应,制备SVFs、脂肪干细胞、微脂肪和纳米脂肪等促进血管生成和组织修复以提高移植脂肪的成活率[10]。
脂肪组织中包含两种主要成分,一种是成熟的脂肪细胞,另一种就是SVFs[11]。SVFs由多种细胞组成,包括ADSCs、血管平滑肌细胞、间充质干细胞(mesenchymal stem cells, MSCs)、周细胞、成纤维细胞、内皮细胞等。SVFs具有与MSCs相似的特性,能够分化为血管内皮细胞,并产生各种血管生成因子,包括VEGF、ANG-1、纤维母细胞生长因子(fibroblast growth factor, FGF)及肝细胞生长因子(hepatocyte growth factor, HGF)等,从而促进血管生成[4]。本研究中,通过Western blot分析和免疫荧光染色结果证实了SVFs可促进脂肪移植物的血管生成,SVFs组的血管网络比对照组更加完整。SVFs增加了移植脂肪移植物的体积和体质量,其脂肪细胞比对照组更饱满、密度更大。SVFs还减少了胶原的沉积,改善脂肪组织的纤维化程度。这些结果均表明SVFs对脂肪移植存活有积极的影响。
脂肪移植后早期丰富的新生血管和血液再灌注对脂肪移植的预后有着重要的作用。但新生血管的形成是一个复杂的过程,受多种血管生成因子的调控,如VEGF、ANG-1和FGF等,都可以促进新生血管形成,从而提高移植物的存活率。血管的完整性和重塑是由内皮生长因子和炎症细胞因子共同调节形成的[12]。SVFs细胞诱导新生血管改善微循环的确切机制尚不清楚。
在生理和病理条件下,ANG/Tie通路在调节血管稳定性和血管生成中起着至关重要的作用。ANG-1主要由周细胞和血小板产生,具有多种生理功能,包括促进新生血管形成,促进血管成熟,维持血管网络的稳定性和完整性[13-14]。Tie-2是一种重要的膜酪氨酸激酶受体,在内皮细胞和造血干细胞中表达,并与所有4种ANG结合,在血管发育和体内平衡中起着重要作用。在胚胎发育过程中,ANG/Tie-2信号通路参与了血管和淋巴管的重塑和成熟[15]。在生理条件下,ANG-1通过结合和磷酸化Tie-2受体激活下游信号,促进细胞间连接,增强内皮细胞存活,从而维持血管稳定和正常血管功能[16-17]。在血管生成过程中,ANG-1激活Tie-2,促进内皮细胞的迁移,促进血管缺失区域的血管发育,从而恢复缺血区域的脑灌注[18]。过表达ANG-1的人骨髓MSCs可改善脑缺血后的血管结构和功能[19]。这些研究表明ANG-1可能是SVFs和血管生成之间的关键靶点[20]。 在本研究中,通过Western blot检测结果发现,SVFs组移植物较对照组上调了ANG-1和p-Tie-2蛋白的表达水平,血管生成相关蛋白CD31表达较对照组显著增加,且SVFs组脂肪移植物中也有更好的毛细血管网络,这些证据表明SVFs通过上调ANG-1/Tie-2的表达进一步促进移植物脂肪的血管生成。
Tie-2 是ANG家族的经典受体,它是一种酪氨酸激酶受体。ANG-1磷酸化Tie-2,导致磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositide 3-kinases, PI3K/protein kinase B, PKB)依赖性转录因子FOXO1的磷酸化,触发其核排斥和降解,增加促进血管稳定的基因表达[21]。利用TKI作为抑制剂抑制Tie-2的活性,下调Tie-2的磷酸化水平。发现SVFs对脂肪移植物的保护作用在抑制Tie-2活性后被逆转。TKI组脂肪移植物体积和质量减小。HE染色见脂肪细胞肥厚且分散。Masson染色见胶原沉积加重,纤维化水平增强。同时,对相关蛋白指标的表达水平进行检测,发现TKI处理后抑制了SVFs上调p-Tie-2和CD31的表达,而ANG-1的表达则进一步增强。提示p-Tie-2的缺乏会抑制血管生成,而脂肪移植迫切需要新生血管,因此导致了ANG-1的积累。但结果表明ANG-1 富集未能维持移植脂肪的存活。通过对凋亡相关蛋白表达的检测发现,SVFs抑制了脂肪移植物的凋亡,而TKI组则显示凋亡过程的加重。这一系列结果提示SVFs可能通过ANG-1/Tie-2信号通路促进血管生成,保护移植脂肪,提高存活,抑制凋亡,见图6。综上所述,本研究表明SVFs可以通过ANG-1/Tie-2信号通路促进血管生成,抑制细胞凋亡,从而提高脂肪移植的存活率。本研究为临床提高移植脂肪的成活率和软组织修复提供了新的理论依据。
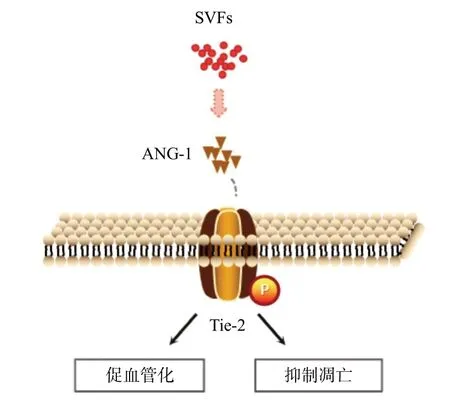
图6 SVFs通过ANG-1/Tie-2信号通路发挥血管再生和抗凋亡作用

