抗独特型抗体在CD47 单抗治疗患者抗体筛查和配血中的应用
李鹏 房阔 张警丹 傅炟 孙佳丽
[1.中国医学科学院血液病医院(中国医学科学院血液学研究所) 血液与健康全国重点实验室 国家血液系统疾病临床医学研究中心 细胞生态海河实验室,天津 300020;2.天津医学健康研究院]
CD47 是人类细胞表面的1 种跨膜糖蛋白,属于整合素相关蛋白,是免疫球蛋白超家族成员。CD47 能与巨噬细胞上的信号调节蛋白α(SIRPα)结合,通过表达“别吃我”的信号,逃避巨噬细胞的攻击[1-3]。 生理状态下,年轻细胞的CD47 抗原表达较高,而衰老细胞的CD47 抗原表达会下降,从而诱发巨噬细胞发挥免疫作用,清除衰老细胞。 有研究表明,病理状态下,多种血液系统恶性肿瘤和实体肿瘤细胞表面CD47 抗原表达增加,包括急性白血病、慢性粒细胞白血病、淋巴瘤以及肾癌、卵巢癌和其他癌症[3-9]。 此外,CD47 的表达可以帮助判断肿瘤治疗的疗效,多种肿瘤治疗效果不佳往往与CD47 的高表达相关[4,10-12]。 抗-CD47 单克隆抗体(以下简称为CD47 单抗)通过结合肿瘤细胞表面CD47 抗原,阻断“别吃我”信号的表达,从而消灭肿瘤细胞。
CD47 单抗大多是IgG4 亚类抗体。 由于红细胞上也有CD47 抗原的表达,当患者血清中存在CD47 单抗时,抗原抗体结合,使红细胞致敏。 此时加入抗人球蛋白试剂,会造成间接抗人球蛋白试验(间接Coombs 试验)假阳性结果,导致红细胞抗体筛查试验阳性、主侧配血试验阳性。 而对于次侧配血的影响,则根据患者的直抗结果不同而有所差异[11]。
目前普遍认为有效的解决方法是使用缺乏抗IgG4 抗人球蛋白的试剂进行输血前抗体筛查及配血试验。 其原理是利用CD47 单抗为IgG4 亚类抗体的特性,通过漏检的方式消除CD47 单抗对间接抗人球蛋白试验的影响。 另外1 种新的处理方法是使用抗独特型抗体(anti-idiotypic antibody,AID)进行中和试验[13-14]。 利用CD47 AID 提前结合CD47 单抗的抗原结合位,使CD47 单抗不能与试剂细胞和献血者细胞上的CD47 抗原进行结合,从而消除CD47 单抗的影响[15]。 还有1 种可能的机制是抗独特型抗体既能结合一部分单克隆抗体的抗原结合位,又能结合单克隆抗体的Fc 段。 在阻止单克隆抗体结合抗原的同时,还能阻止抗人球蛋白试剂结合到单克隆抗体上[15]。 本研究比较了使用CD47 AID 中和法(方法1)和缺乏抗IgG4 抗人球蛋白法(方法2)的受试组患者输注红细胞后Hb值变化,并比较了使用方法1 配血的受试组患者与对照组患者(普通微柱凝胶法配血且未使用CD47单抗)的输血效果差异。
1 材料与方法
1.1 研究对象
2020 年5 月—2022 年3 月,在本院进行CD47单抗药物临床试验的受试者18 名,其中16 名受试者使用天境生物TJ011133 即TJC4,2 名受试者使用信达生物IBI188 CD47 单抗。 患者年龄25 ~78岁。 其中骨髓增生异常综合征(MDS)患者8 名,急性髓细胞白血病(AML)患者10 名。 实验标本均为患者用药后EDTA 抗凝标本。 对照组为随机抽选同时期住院未使用CD47 单抗且采用普通微柱凝胶法配血的患者,共计16 名,其中MDS 患者6 名,AML 患者10 名。 分析比较受试组患者经CD47 AID 中和法(方法1)、缺乏抗IgG4 抗人球蛋白法(方法2)、对照组经普通微柱凝胶法配血,输血后24h 血红蛋白值的变化ΔHb。
1.2 试剂与仪器
DG Gel Coombs 抗人球蛋白卡(批号:20139.01.1、21072.01.1)、DG Gel Coombs 抗人球蛋白卡专用孵育器、DG Gel Coombs 抗人球蛋白卡专用离心机、Erytra 全自动血型配血系统、0.8%抗体筛查细胞(Diana,批号:20009.01~22003.01)、3%抗体筛查细胞(Sanquin,批号:8000262148 ~8000455635)、抗体 鉴 定 细 胞( Sanquin, 批 号: 8000450279 ~8000455637)、血清学离心机(久保田KA2200)、CD47 抗独特型抗体(天境TJ011133 抗独特型抗体,批号:RD210712755、RD2202100127;信达生物IBI188 抗独特型抗体,批号:PD20210903)、缺乏抗IgG4 抗人球蛋白(IMMUCOR,批号:702028)。
1.3 试验方法
1.3.1卡式抗体筛查、主侧配血及抗体鉴定试验
采用微柱凝胶法进行。 先向抗人球蛋白卡中每孔加入50 μL 0.8%抗体筛查细胞、献血者红细胞和抗体鉴定细胞,再加入患者血浆25 μL。 使用卡式孵育器37℃温育15 min 后,置于专用卡式离心机离心,观察结果。
1.3.2使用普通抗人球蛋白试剂和缺乏抗IgG4 抗人球蛋白试剂进行抗体筛查和主侧配血
使用经典抗人球蛋白方法,分别标记2 套抗体筛查Ⅰ、Ⅱ、Ⅲ及主侧配血管。 向每个试管中加入患者血浆2 滴,对应管中再分别加入1 滴3%浓度抗体筛查细胞和献血者红细胞。 混匀各管后于37℃温育30 min。 温育结束后用0.9%生理盐水洗涤各试管3 次,弃去最后1 次洗液并扣干试管。 混匀各试管,在1 套试管中加入1 滴普通抗人球蛋白试剂,另1 套试管中加入1 滴缺乏抗IgG4 抗人球蛋白试剂。 使用1 000 g 离心力离心试管15 s 后观察结果。
1.3.3CD47 AID 中和法相关试验
使用CD47 抗独特型抗体中和法进行微柱凝胶法抗体筛查、主侧配血和抗体鉴定。 取患者血浆400 μL,加入CD47 抗独特型抗体40 μL。 充分混匀后,于37℃温育10 min。 使用DG Gel Coombs 抗人球蛋白卡,卡上标记抗体筛查Ⅰ、Ⅱ、Ⅲ、主侧配血以及抗体鉴定1 ~11。 孔中分别加入0.8%抗体筛查细胞、献血者红细胞及抗体鉴定细胞50 μL,再向每孔中加入中和后血浆25 μL。 使用卡式孵育器37℃温育15 min 后,于专用离心机离心后观察结果。
1.4 统计学分析
使用SPSS 软件(IBM SPSS statistics 26.0)进行统计分析。 采用独立样本t检验比较2 种配血方法在CD47 单抗使用者中的输血效果差异,并比较使用方法1 配血的受试组患者与对照组患者(普通微柱凝胶法配血且未使用CD47 单抗)输血后的差异性,以P<0.05 为有差异有统计学意义。
2 结果
2.1 卡式抗体筛查、主侧配血及抗体鉴定试验结果
所有标本使用普通微柱凝胶法,抗体筛查结果、主侧配血结果、抗体鉴定结果均为阳性,凝集强度基本一致。 患者用药前抗体筛查均为阴性,结合患者用药史、输血史以及免疫史,可判断为CD47单抗引起的配血不合(图1)。

图1 患者使用CD47 单抗后主侧配血、抗体筛查及抗体鉴定结果示例Figure 1 Major crossmatch, antibody screening and antibody identification results of patients treated with CD47 monoclonal antibody
2.2 使用2 种抗人球蛋白试剂进行抗体筛查和主侧配血结果
使用普通抗人球蛋白试剂进行抗体筛查、主侧配血结果阳性;使用缺乏抗IgG4 抗人球蛋白试剂进行抗体筛查、主侧配血结果阴性(图2)。
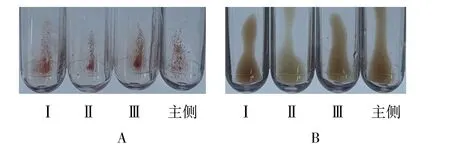
图2 使用2 种抗人球蛋白试剂的抗体筛查、主侧配血结果Figure 2 Antibody screening and major crossmatch results using common anti-human globulin reagent and reagent lack of anti-IgG4 anti-human globulin
2.3 使用CD47 AID 中和法进行抗体筛查、主侧配血及抗体鉴定结果
主侧配血、抗体筛查及抗体鉴定结果阴性(图3)。

图3 使用CD47 抗独特型抗体中和血浆后的主侧配血、抗体筛查及抗体鉴定结果Figure 3 Major cross matching, antibody screening and antibody identification results using plasma neutralized with CD47 anti-idiotypic antibody
2.4 18 名受试者经方法1、2 配血情况
18 名受试组患者用药后、抗体筛查结果转阴前共输血134 次,其中119 次在输血前、后均进行Hb 值检测。 使用方法1 配血88 次,使用方法2 配血31 次(表1)。 使用这2 种方法进行抗体筛查与主侧配血,均能得到抗体筛查阴性、主侧配血阴性的结果。

表1 使用2 种配血方法的CD47 单抗受试组患者输血次数(n=119)Table 1 Number of transfusions of patients treated with CD47 monoclonal antibody using method 1 and method 2(n=119)
2.5 统计学分析
比较2 种配血方法对受试组患者输注红细胞后24 h Hb 变化的影响,差异无统计学意义(t=0.786,P>0.05);比较使用方法1 配血的受试组患者与对照组患者输血后24 h Hb 值变化,也无显著的统计学差异(t=1.732,P>0.05)(图4)。 提示CD47 AID 中和法可以替代使用缺乏抗IgG4 抗人球蛋白法,应用于使用CD47 单抗治疗的患者输血前抗体筛查及主侧配血。
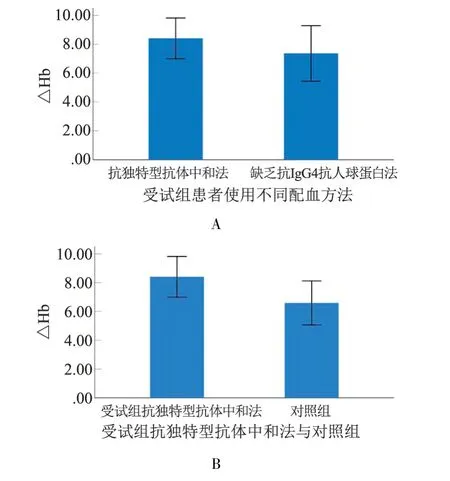
图4 各组输血后24 h Hb 变化Figure 4 Hb changes 24 h after transfusion in each group
3 讨论
随着CD47 单抗临床药物试验的广泛开展,其对输血前检查的影响越来越受到关注。 CD47 单抗引起的凝集强于CD38 单抗,而且不能通过DTT、2-Me、蛋白水解酶等处理掉抗原的方法解决[11,16-17]。鉴定此类患者抗体时,所有的鉴定细胞反应均呈阳性,并且凝集强度基本一致,而自身对照往往是阴性或者弱阳性。 这种特性使得CD47 单抗与针对高频抗原的同种抗体高度相似[18]。 对有紧急输血需求的患者,如不能准确判断抗体特性,并合理消除药物影响,势必会延误患者输血。 此时,输血科与临床科室沟通的重要性凸显。 临床应明确告知输血科患者即将用药的时间,以便输血科在用药前确定患者ABO 血型,并将结果告知患者或其家属。对用药前3 个月内未曾输血的患者进行ABO 血型以外其他血型系统抗原表型检测,以便用药后进行相容性输血[11],或待患者产生同种抗体后,辅助判断可能为何种抗体。 同时,用药前需对患者进行抗体筛查试验,越接近用药当天越好。 抗筛阳性患者进一步做抗体鉴定,以明确抗体特异性。
对于明确为CD47 单抗引起的假阳性标本,目前普遍的做法是使用缺乏抗IgG4 抗人球蛋白试剂进行输血前抗体筛查及交叉配血。 该方法成本低,试剂容易获取,对于血浆药物浓度不高的患者,可以通过漏检CD47 单抗的方式,消除CD47 单抗对输血前检查的影响。 而有重要临床意义的同种抗体往往是IgG1 和IgG3 亚型,IgG4 抗体仅会引起贫血,并没有显著的溶血,因此即使漏检IgG4 抗体对输血效果的影响是有限的[17]。 不过,由于其灵敏度会低于普通抗人球蛋白试剂,所以在使用该方法时,最好对实验体系的灵敏度设一个定值的对照。另外,使用缺乏抗IgG4 抗人球蛋白试剂进行试验须考虑药物使用剂量和使用频率导致的药物浓度升高对试验结果的影响[13]。 有文献报道,从第2周开始,每两周给药30 mg/kg 的维持方案可使血清药物浓度达到200 μg/mL 或更高[19]。 高浓度的CD47 单抗会影响试管法试验的结果,比如ABO 血型反定型、试管法抗体筛查及交叉配血试验等。 向这些含有高药物浓度的患者血浆中加入3%患者同型红细胞或O 型红细胞立即离心,会引起红细胞凝集。 这种凝集不能通过盐水洗涤的方式去除,并且37℃温育后凝集也不会消失。 在这种情况下,以试管法为基础的输血前检查试验方法包括盐水法、经典抗人球蛋白法及凝聚胺法等,结果都会呈现假阳性。 但是,CD47 单抗效价下降较快,3 ~4 周即可从较高的效价降低为0[18],因此后续配血结果与用药轮次、抽取交叉血的时间、用药结束时间密切相关。总的来说,较低的CD47 单抗浓度对使用缺乏抗IgG4 抗人球蛋白法进行抗体筛查和主侧配血几乎没有影响,但是对于血药浓度较高的患者,使用该方法进行试验往往无法得到阴性结果;对于次侧配血,使用该方法不会受到CD47 单抗的影响,或影响较小。 另外该方法对由IgG1 型CD47 单抗或者IgG1 型CD47 融合蛋白造成的影响,也收效甚微。
抗独特型抗体可以中和特异性抗体,即利用抗独特型抗体“内影像”的特性,结合单克隆抗体的抗原结合位,从而使单克隆抗体不能结合到靶位抗原上[15]。 CD47 抗独特型抗体(CD47 AID)主要通过与CD47 单抗抗原结合部位特异性结合,使CD47 单抗无法结合到红细胞的CD47 抗原上,从而消除单抗对输血前检查的影响。 本文通过比较CD47 AID 中和法与使用缺乏抗IgG4 抗人球蛋白法配血受试组患者输血后Hb 值的变化,发现这两种方法配血对患者输血后Hb 影响没有显著差异;并且使用CD47 AID 中和法与随机对照组(使用普通微柱凝胶法配血且未使用CD47 单抗的MDS、AML 患者)输血后Hb 值变化也无显著差异。 因此,CD47 AID 中和法可以完全替代缺乏抗IgG4 抗人球蛋白法。 相对于使用缺乏抗IgG4 抗人球蛋白法,CD47 AID 中和法更加简单易操作,仅需要向患者待检血浆中添加适量的抗独特型抗体即可达到消除CD47 单抗影响的目的,并且结果判读客观准确,值得推荐。
目前,还有其他一些可用于解决CD47 单抗对输血前试验影响的方法,比如根据患者红细胞表型分型进行相容性输注[18]、使用红细胞或者血小板进行吸收试验[11]、Immucor Capture-R 技术、使用PEG 吸收CD47 抗体等方法[11,20-21]。 这些方法不论是在处理过程的便捷性或是结果的可靠性,都不如使用CD47 AID 中和法和使用缺乏抗IgG4 抗人球蛋白试剂法[11,18,22],现将各方法的优劣简要比较如下。
红细胞表型分型是对患者红细胞多个血型系统主要抗原表型进行鉴定,根据表型结果进行红细胞同型输注或者相容性输注,在不消除CD47 单抗的影响下,避免潜在的同种抗体对输血造成影响。参考抗-CD38 单克隆抗体配血的相关内容[23],表型分型通常需要在患者开始接受CD47 单抗治疗前、末次输血3 个月后进行。 有条件的实验室可使用毛细管离心法对新生红细胞进行表型检测,包括C、c、E、e、K、Fya、Fyb、Jka、Jkb、M、N、S 等,如能进行基因检测,可进一步提高结果准确性,且不受患者输血及用药情况的影响。 但是,根据分型结果进行红细胞同型输注或者相容性输注工作量较大,并且对于一些国人稀有表型如Fy(a-b+)等,很有可能无法筛到可用的血液,甚至部分地区无法提供抗原匹配红细胞。 同时需要注意的是,即使提供抗原匹配红细胞也不能保证不漏检其他有重要临床意义的抗体[16]。 所以红细胞表型分型往往用来作为患者基本信息的补充,以及怀疑患者产生同种抗体后,分析可能为何种抗体时的参考。
使用红细胞和血小板进行吸收试验包括使用红细胞和血小板进行同种吸收试验以及使用自身红细胞进行自身吸收试验[11]。 通过红细胞对患者血浆中的CD47 单抗进行多轮吸收,利用吸收后的血浆进行输血前检查,从而消除CD47 单抗对临床输血的影响。 但是使用红细胞进行吸收时,若患者血浆中存在同种抗体,可能被异体红细胞吸收,从而造成同种抗体漏检。 这种情况下需要使用放散处理后的自身红细胞进行吸收。 同时,高效价CD47 抗体血浆往往需要进行4 ~6 轮吸收,用来吸收的红细胞中残留的洗液也会对患者血浆造成稀释,从而可能漏检有重要临床意义的抗体。 并且对于高效价的患者,同种吸收可能无效[11]。 使用木瓜酶处理后的红细胞对使用CD47 单抗患者血浆进行吸收试验,有较好效果,成功消除了CD47 单抗的泛反应性[11,16]。 对于使用血小板进行吸收试验,有文献报道吸收效果不佳,未能达到消除CD47单抗对抗人球蛋白法抗体筛查和交叉配血的影响,但却可以用血小板吸收后的血浆进行血型反定型试验[11,22]。
Capture-R 技术其本质上仍是利用缺乏抗IgG4抗人球蛋白试剂进行输血前检查,虽然灵敏度高于手工抗人球蛋白法,但同样存在该技术的其他弊端。 另外,Capture-R 技术需要配备专门的仪器,不利于推广。 PEG 吸收法最大的问题是对抗体无差别的消除,会漏检有重要临床意义的抗体[11,20-21]。
还有1 种可能有效方法是使用可溶性CD47 抗原或者高亲和力SIRPα 单体进行中和。 已经证明这种方法在解决由CD47 融合蛋白ALX148 造成的泛反应性时,可以在不漏检有重要临床意义抗体的前提下解决药物对输血前检查的影响[16]。 特别是高亲和力SIRPα 单体,它提前与待检红细胞上CD47 抗原结合,从而消除CD47 单抗的影响。 中和的过程不需要CD47 单抗参与,因此理论上不受不同厂家CD47 单抗特异性的影响。 这为量产中和试剂提供了1 种潜在的经济价值。 由于CD47 单抗对配血结果产生的严重影响,很多药物厂商已经着手研发能够减少或者消除这种影响的新药。 包括CD47 融合蛋白(如ALX148、IMM01)、CD47 相关 双 靶 位 药 物(如 CD47/CD19、 CD47/CD33、SIRPα/CD123)等[4,24]。 这些药物能够有效地减轻对输血前检查的影响,并且对肿瘤细胞的杀伤更有针对性。 特别是CD47 相关的双靶位药物,对比两种单抗联合用药,双靶位药物能够得到更高的肿瘤抑制率[11]。
本研究仍有不足之处,首先是入组患者人数较少,特别是没有观察到同时呈现同种抗体的病例;使用缺乏抗IgG4 抗人球蛋白试剂进行抗体筛查和配血的例数较少,存在一定的系统误差。 其次,由于CD47 AID 主要是结合CD47 单抗的Fab 端,因此对于直抗阳性的患者,该方法无法消除CD47 单抗对次侧配血的影响。 再次,抗独特型抗体获得的渠道较少,目前主要由CD47 单抗药物生产厂商配备且不同厂商的抗独特型抗体之间不能完全互相替代。 笔者曾经尝试交叉使用不同厂商的抗独特型抗体去中和不同的CD47 单抗(TJ011133、IBI188、AK117),效果不佳。 这与其他文献报道的结果不一致[13],需要更多的临床试验进一步证实。此外,目前还没办法完全明确CD47 AID 的用量。下一步,我们计划继续增加入组病例数量,以明确CD47 AID 用量与用药周期或药物浓度之间的关系。

