枸杞多糖通过激活Nrf2/HO-1 通路保护HK-2细胞氧化损伤的作用
赵 杰,史素芳,单铁强,郭 明,皮珊珊,张银平,郭 菲
(1.邯郸市中心医院 临检科,河北 邯郸056002;2.河北工程大学附属医院 护理科,河北 邯郸056002;3.秦皇岛市海港医院 a.检验科;b.肾内科,河北 秦皇岛066000)
枸杞多糖(LBP)是从中草药枸杞成熟果实中分离出来的一种生物活性成分,对生物体具有抑制肿瘤的生长和扩散、调控免疫应答、减轻组织炎症反应、增强抗氧化反应能力等多种药理学功效[1-3]。近几年的研究表明,枸杞多糖能通过降低脂多糖诱导的小鼠肺组织中丙二醛(malondialdehyde,MDA)的含量、增强超氧化物歧化酶(superoxide dismutase,SOD)活性及促进Akt/eNOS 通路的表达来减轻肺组织损伤[4]。LBP能提高糖尿病小鼠的睾丸组织中抗氧化酶活性,提高自噬水平及激活PI3K/Akt信号通路达到改善睾丸功能的作用[5]。枸杞多糖对肾小管上皮细胞氧化损伤修复及其潜在的分子机制尚不清楚。因此,本研究在体外孵育人肾小管上皮细胞株(HK-2),并经过适当浓度的过氧化氢作用构建氧化损伤细胞模型,经枸杞多糖干预后,从细胞长势、形态和存活率,细胞内产生氧化产物MDA的量、抗氧化酶SOD和谷胱甘肽过氧化酶(GSH-Px)的水平,HK-2内的核因子 E2 相关因子 2(Nrf2)/血红素氧合酶-1(HO-1)通路激活的情况,分析枸杞多糖拮抗HK-2细胞氧化损伤的分子机制,报道如下。
1 材料与方法
1.1 实验材料人肾小管上皮细胞系购自上海中乔新舟生物公司;枸杞多糖购自陕西永源生物公司,提前将其用少量三蒸水溶解、高压灭菌、冷藏,实验时稀释为相应浓度。检测细胞存活率的试剂盒、胰蛋白酶及30%双氧水均购自山东汇恒生物公司;测量细胞内MDA含量、SOD和GSH-Px水平的检测试剂盒均购自上海沪峥生物公司;定量细胞内蛋白Nrf2、HO-1的抗体检测试剂盒均购自北京安诺伦生物公司。
1.2 方法
1.2.1细胞实验分组和形状、长势观察 体外孵育HK-2细胞到长势、状态最佳时,将其等量分成4组:正常组(A组)、LBP组(B组)、氧化损伤组(C组)及LBP干预组(D组)。正常组:常规孵育液;LBP组:内含枸杞多糖(100 mg/L)孵育液;氧化损伤组:内含过氧化氢(100 μmol/L)的孵育液;LBP干预组:提前24 h培养于含有枸杞多糖(100 mg/L)孵育液中,再加入过氧化氢(100 μmol/L)培育30 min。4组细胞作用等同时间后,分别观察细胞的形状和长势情况。
1.2.2细胞存活率测定 在多孔孵育板中将每组细胞接种为重复的6孔,作用等同时间后,每孔中的孵育液被吸干净,分别加入试剂盒内的检测活细胞数量的试剂,再继续培养4 h。将多孔孵育板放进酶标仪中测定每孔细胞的吸光度值。最后计算并分析每组细胞的存活率。
1.2.3细胞内MDA、SOD及GSH-Px水平的检测 每组细胞均作用24 h时,用胰蛋白酶处理贴壁细胞,分离出的细胞放入无菌的试管中,连续冰冻溶解3次,细胞破碎释放出内含物,分别收集4组细胞的内含物,按照试剂说明书的程序,依次定量4组细胞内MDA、SOD及GSH-Px的水平。
1.2.4细胞内蛋白相对值的检测 每组细胞均作用24 h时,缓冲液漂洗细胞,置于低温下充分裂解细胞后,检测每组细胞中所含的总蛋白量。蛋白煮沸使其变性,每个泳道中加入40 μg进行恒压电泳2.5 h,接着在恒定电流作用下,将胶中的蛋白条带转至薄膜中,将膜浸入封闭溶液里室温孵育1 h,依次加入第一抗体稀释溶液Nrf2(1∶500)和HO-1(1∶500)中,置于温箱中作用4 h,投进第二抗体稀释溶液(1∶1200)中反应1 h,发光液显影、定影到X光片上、扫描后分析各种蛋白的相对值。
2 结果
2.1 细胞形状和长势的观察光镜下可见,正常组与LBP组相比,两组细胞均生长良好,在形状、长势方面无差异;氧化损伤组的细胞皱缩变圆并脱落、贴壁的细胞数量变少;LBP干预组的细胞形状伸展、长势有所恢复、贴壁细胞较多。见图1。

图1 各组活细胞形状和长势的观察(×100)
2.2 各组细胞存活率的比较通过每组6孔细胞的吸光度均值计算细胞存活率,正常组与LBP组相比,两组细胞的存活率差异无统计学意义(P>0.05);氧化损伤组的细胞存活率显著低于正常组(P<0.01);LBP干预组的细胞存活率显著高于氧化损伤组(P<0.01)。见表1。

表1 各组细胞的存活率、细胞内MDA、SOD及GSH-Px水平的分析
2.3 各组细胞内MDA、SOD及GSH-Px水平的比较正常组与LBP组相比,两组细胞内的MDA、SOD及GSH-Px水平差异均无统计学意义(均P>0.05);氧化损伤组细胞内MDA水平显著高于正常组(P<0.01),而SOD及GSH-Px水平均显著低于正常组(P<0.01);LBP干预组细胞内MDA水平显著低于氧化损伤组(P<0.01),而SOD及GSH-Px水平均显著高于氧化损伤组(P<0.01)。见表1。
2.4 各组细胞内Nrf2/HO-1通路蛋白相对值的比较正常组与LBP组相比,两组细胞内Nrf2、HO-1蛋白的相对值差异均无统计学意义(均P>0.05);氧化损伤组细胞内Nrf2、HO-1蛋白的相对值均显著低于正常组(P<0.01);LBP干预组细胞内Nrf2、HO-1蛋白的相对值均显著高于氧化损伤组(均P<0.01)。见表2、图2。

表2 各组细胞内Nrf2/HO-1通路蛋白相对值的比较
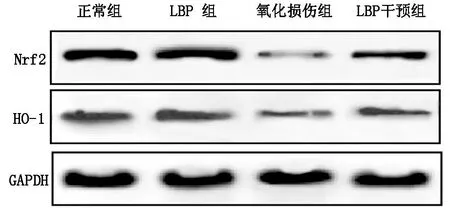
图2 各组细胞内Nrf2、HO-1的蛋白条带
3 讨论
肾脏的主要功能为滤过血液产生原尿、重吸收原尿、分泌排泄生成终尿,从而使机体内的水、电解质处于平衡状态。肾小管是组成肾脏实质的结构和功能重要组分,其壁由一层上皮细胞围成。此种细胞的主要作用为吸收原尿中的有用成分使之重新入血;分泌、排泄一些离子、小分子等成分进入尿液[6];相邻细胞侧面间的紧密连接构成保护屏障,防止有害物质的入侵[7]。当肾组织受到有害因素刺激发生氧化损伤时,肾小管对此刺激最为敏感,其管壁细胞表现为程度不等的坏死状态[8]。根据上述肾小管功能的重要性及易受损伤性,因此,探索其抗氧化的潜在分子机制对临床上肾脏氧化损伤的防治具有十分重要的意义。
过氧化氢为一种强氧化剂,具有很强的氧化活性,当其作用于细胞时,能迅速穿透细胞膜,破坏细胞内部所含的脂质、蛋白质及核酸等生物分子的结构,使其功能降低或丧失[9]。文献已经证实,利用过氧化氢能成功建立多种类型细胞的氧化损伤模型[10]。因此,本实验采用100 μmol/L过氧化氢的孵育液刺激HK-2细胞,细胞皱缩变圆并脱落、贴壁的细胞数量变少,细胞存活率下降。这表明HK-2细胞氧化损伤模型已经成功建立。
氧化与抗氧化的平衡是维持细胞正常生命的必备条件,调节此平衡的途径有多种,较为常见的调节是胞质内氧化物质与抗氧化物质含量的平衡。正常状态下,细胞内的抗氧化酶如SOD、GSH-Px等能及时清除代谢过程产生的活性氧、自由基等氧化物质。这些氧化物质具有毒害作用,若其产量增多超过抗氧化酶的清除力时,细胞会遭受氧化损害[11]。过氧化氢作用细胞后,细胞内生成过量的有害氧化物质不仅消耗SOD、GSH-Px等抗氧化酶,而且还会生成毒性产物MDA,使损伤程度加深、范围扩大[12]。因此,细胞内抗氧化酶SOD、GSH-Px的水平可作为衡量细胞抗氧化能力的高低,氧化产物MDA的水平能衡量细胞受到的氧化损伤程度[13]。
Nrf2/HO-1通路激活对细胞内的氧化反应起负调控作用[14]。Nrf2常和Keap1相结合为复合物存在于胞质中,若细胞受到氧化刺激时,Keap1被磷酸化而失活并与Nrf2分开,游离的Nrf2入核后结合相应基因,启动并增强抗氧化酶如SOD、GSH-Px等基因的转录和表达,降低胞质内氧化反应的强度并减轻氧化损伤[15]。HO-1是受Nrf2调控的抗氧化蛋白,其抗氧化作用表现为:① 能催化血红素这种强氧化剂的分解,从而减少血红素的促氧化作用;②HO-1 分解血红素生成的分解产物具有较强的清除ROS、氧自由基等抗氧化功效[16]。本研究结果显示,经过氧化氢作用的HK-2细胞内Nrf2、HO-1蛋白的相对值降低、抗氧化酶SOD、GSH-Px的水平降低,氧化产物MDA的水平升高。经LBP干预后,HK-2细胞内Nrf2、HO-1蛋白的相对值升高、抗氧化酶SOD、GSH-Px的水平上升,氧化产物MDA的水平降低。这提示过氧化氢能抑制Nrf2/HO-1通路的活性降低抗氧化酶的活性使细胞发生氧化损伤,LBP能激活Nrf2/HO-1通路增强细胞的抗氧化能力来改善其氧化损伤。
综上所述,过氧化氢通过抑制HK-2细胞内Nrf2/HO-1通路的活性,降低抗氧化酶的含量,使MDA的水平升高,从而使细胞产生氧化损伤。经LBP干预后,提高Nrf2/HO-1通路的活性,升高抗氧化酶的含量,使MDA的水平降低,使细胞的氧化损伤得到改善。

