TPD52和TPD52L2在胃癌中异常表达的临床病理特征分析和相关基因共表达意义研究
高夏青,杨春婷,郭双铭,韩 静,樊 涛,杨 霄,李海龙*
(1.甘肃中医药大学第一临床医学院,甘肃 兰州730000;2.甘肃中医药大学附属医院 科研科,甘肃 兰州730000)
胃癌是全球最常见的消化系统恶性肿瘤。流行病学资料显示,2022年中国大约有51万新发胃癌病例和40万胃癌死亡病例[1]。到目前为止,手术治疗仍然是早期胃癌最重要的治疗手段。因此,探索胃癌发生、发展机制,寻找可靠的分子标记物对于提高胃癌的早期诊断和靶向治疗水平均有重要的临床意义。人类肿瘤蛋白D52(human tumor protein D52,hTPD52)家族是近年来新发现的一类原癌基因,其家族成员包括肿瘤蛋白D52(TPD52)、肿瘤蛋白D52样1(TPD53、TPD52L1)、肿瘤蛋白D52样2(TPD54、TPD52L2)和肿瘤蛋白D52样3(TPD55、TPD52L3)[2]。众多研究表明,hTPD52家族在肿瘤的进展中扮演着重要角色[3-14]。但鲜见TPD52和TPD52L2与胃癌的研究报道,本研究借助于生物信息学方法评估TPD52和TPD52L2在胃癌中的差异表达及其与临床病理特征的相关性,分析TPD52和TPD52L2的表达和胃癌患者预后的关系,并探讨TPD52和TPD52L2共表达基因参与胃癌发生发展的相关信号通路,以期为胃癌的基因靶向治疗提供依据。
1 资料与方法
1.1 TPD52和TPD52L2差异表达水平的比较
从TCGA数据库的胃癌项目获取基因表达数据(407例,包括32例癌旁组织样本和375例肿瘤组织样本),使用R语言软件包pROC和ggplot2进行TPD52和TPD52L2的差异表达和ROC曲线分析。
1.2 TPD52和TPD52L2与临床病理特征的相关性
基于从TCGA获取的407例胃癌患者的数据信息,借助R语言软件包ggplot2比较TPD52和TPD52L2的表达与胃癌患者的病理分期、组织学分级、幽门螺旋杆菌感染和Barretts食管的相关性。
1.3 TPD52和TPD52L2的免疫组化分析
通过Human Protein Atlas数据库[15](https://www.proteinatlas.org/)分析TPD52和TPD52L2在胃癌组织和癌旁组织中的免疫组化染色情况。
1.4 TPD52和TPD52L2与胃癌的免疫细胞浸润分析
通过单样本基因集富集分析(ssGSEA)的方法分析TCGA数据库中胃癌与免疫细胞的浸润情况,以及选取Spearman秩相关性分析与免疫细胞的相关度,使用R语言软件包GSVA进行统计分析和可视化。
1.5 TPD52和TPD52L2与胃癌预后关系的分析
借助于Kaplan-Meier Plotter数据库[16](https://kmplot.com/analysis/)在线评估TPD52和TPD52L2在胃癌中的表达与总生存期(OS)、首次进展生存期(FP)和再次进展生存期(PPS)的关系,并使用R语言软件包rms、survival对TCGA数据建立Nomogram(列线图)模型、绘制Calibration(校准曲线)图、单因素和多因素Cox回归分析。
1.6 TPD52和TPD52L2共表达基因的信号通路富集分析
通过cBioPortal数据库[17](https://www.cbioportal.org/)中(TCGA,PanCancer Atlas)胃癌患者的数据,提取TPD52和TPD52L2的共表达基因,随后将Spearman秩相关系数(r)的绝对值≥0.3的共表达基因输入SangerBox数据分析软件[18](http://vip.sangerbox.com/home.html)进行KEGG富集分析并绘图。
1.7 蛋白质-蛋白质相互作用(PPI)分析与核心基因的筛选
基于cBioPortal数据库筛选的共表达基因,结合STRING数据库[19](https://cn.string-db.org/)构建PPI网络,以相互作用分数≥0.7作为阈值,并使用Cytoscape 3.9软件中CytoNCA插件筛选核心基因。
1.8 核心基因在胃癌中的生存曲线和相关性分析
使用Kaplan-Meier Plotter数据库验证核心基因与胃癌患者总生存期的关系,进一步借助R语言软件包ggplot2探索核心基因与TPD52和TPD52L2的相关性。
1.9 统计学方法
R语言软件包(v.3.6.3)用于统计学分析。两组间的差异表达采用t检验。与临床病理特征的相关性分析使用F检验;Spearman秩相关系数分析TPD52和TPD52L2的免疫细胞浸润和共表达基因;生存分析采用log-rank检验;单因素和多因素的生存分析使用Cox比例风险模型;富集分析使用FDR方法;Pearson相关系数分析TPD52和TPD52L2与核心共表达基因的相关性。P<0.05为差异具有统计学意义。
2 结果
2.1 TPD52和TPD52L2在胃癌组织中的差异表达结果分析
为了探索TPD52和TPD52L2在胃癌进展中的作用,使用TCGA数据库(32例癌旁组织样本和375例肿瘤组织样本)预测基因的差异表达,结果表明:与癌旁组织相比,TPD52和TPD52L2在胃癌组织中均高表达(P<0.001)(图1A,C)。TPD52表达水平的ROC曲线下面积为0.794(95%CI=0.730~0.859)(图1B),TPD52L2为0.809(95%CI=0.728~0.890)(图1D),提示均有一定的诊断价值。
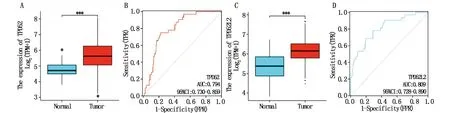
图1 TPD52(A,B)和TPD52L2(C,D)在胃癌组织与癌旁组织中的差异表达和ROC曲线
2.2 TPD52和TPD52L2与胃癌患者临床病理特征的结果分析
进一步分析胃癌组织与癌旁组织中TPD52和TPD52L2的表达水平与临床病理特征的关系。结果表明:与癌旁组织相比,TPD52和TPD52L2高表达与病理分期、组织学分级、幽门螺旋杆菌感染和Barretts食管均密切相关,差异有统计学意义(P<0.05)(图2A-H)。
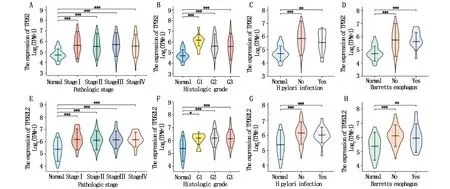
图2 TPD52和TPD52L2分别在胃癌不同分期(A,E)、不同分级(B,F)、幽门螺旋杆菌感染(C,G)和Barretts食管(D,H)中的表达
2.3 Human Protein Atlas数据库免疫组化结果分析
通过Human Protein Atlas数据库下载TPD52和TPD52L2在胃癌组织和癌旁组织的免疫组化染色结果图片。分析结果显示:TPD52在癌旁组织(图3A)和胃癌组织(图3B)中均染色成阳性;TPD52L2在癌旁组织(图3C)中染色成阴性,在胃癌组织(图3D)中染色成阳性。
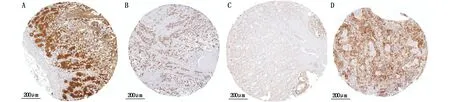
图3 TPD52(A,B)和TPD52L2(C,D)分别在癌旁组织和胃癌组织的免疫组化染色结果
2.4 TPD52和TPD52L2的表达与免疫细胞浸润的结果分析
通过Spearman秩相关性分析发现,TPD52的表达与免疫细胞Th2 cells(辅助性T细胞2)和T helper cells(辅助性T细胞)等细胞的浸润丰度呈正相关,与免疫细胞NK cells(自然杀伤细胞)、pDC(浆细胞样树突状细胞)等细胞的浸润丰度呈负相关(P<0.05)(图4A);TPD52L2的表达与免疫细胞Th2 cells的浸润丰度呈正相关,与免疫细胞pDC和Mast cells(肥大细胞)等细胞的浸润丰度呈负相关(P<0.05)(图4B)。
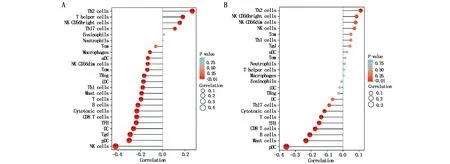
图4 TPD52(A)和TPD52L2(B)与胃癌免疫细胞浸润的相关性
2.5 TPD52和TPD52L2的表达在胃癌中的独立诊断价值结果分析
Kaplan-Meier生存曲线结果表明:TPD52高表达组胃癌患者的OS、FP和PPS高于低表达组,可能由于样本量的差异与预期结果不符(图5A-C)。TPD52L2高表达组胃癌患者的OS、FP和PPS低于低表达组(P<0.05)(图5D-F),表明高表达组的生存期明显缩短。然后使用TNM分期、病理分期、组织学分级、组织学类型、TPD52和TPD52L2的表达作为预测胃癌患者1年OS的指标(图6A,C)。校准曲线图显示了1年临床结果的理想预测(图6B,D)。TPD52和TPD52L2的单因素Cox分析结果表明,T期、N期、M期和病理分期与胃癌患者的预后不良相关,多因素Cox分析结果表明,M分期是影响胃癌患者OS的独立危险因素(P<0.05)(表1)。
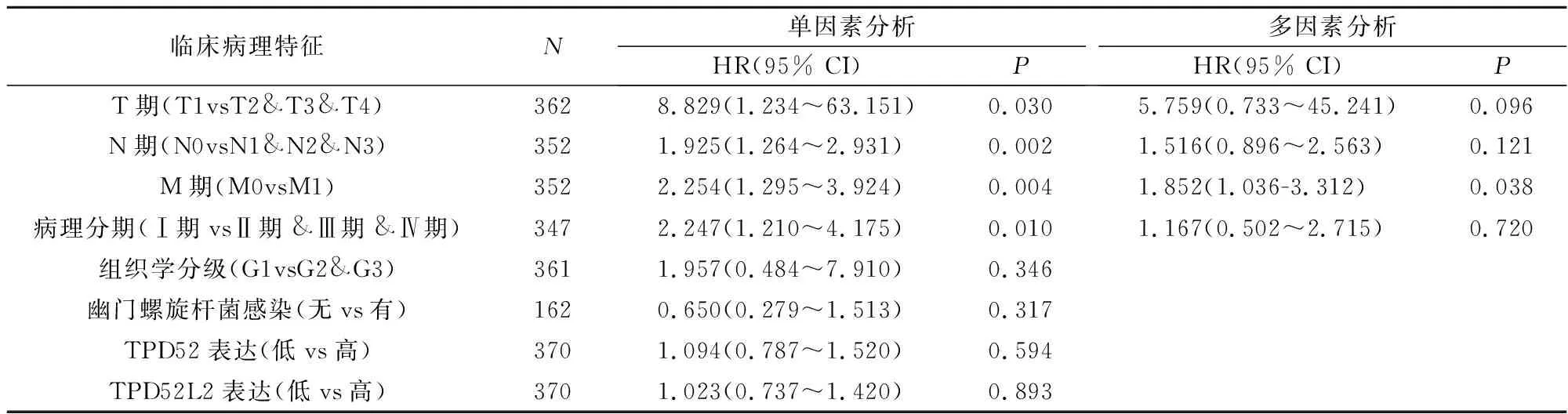
表1 单因素和多因素Cox回归分析TPD52和TPD52L2的表达与OS的相关性
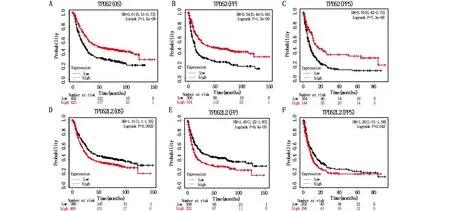
图5 TPD52和TPD52L2表达水平与胃癌患者的OS(A,D)、FP(B,E)和PPS(C,F)生存曲线分析
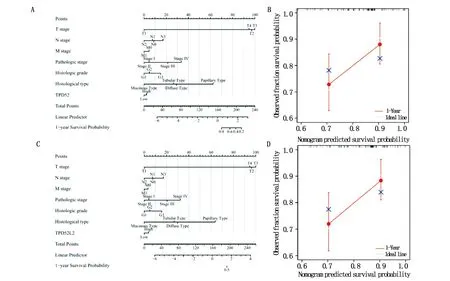
图6 TPD52(A,B)和TPD52L2(C,D)表达的列线图的构建与验证
2.6 TPD52和TPD52L2的共表达基因信号通路富集分析结果
通过cBioPortal数据库和SangerBox数据平台分析TPD52和TPD52L2共表达基因的KEGG富集分析。分析结果表明:与TPD52有相关性的1 365个共表达基因主要富集在代谢通路、癌症的转录失调和TNF信号通路等信号通路中(图7A)。与TPD52L2有相关性的412个共表达基因主要富集在癌症通路、剪接体和小细胞肺癌等信号通路中(图7B)。
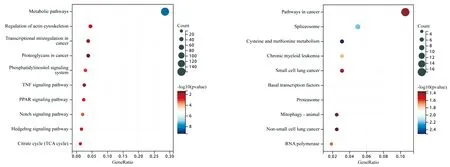
图7 TPD52(A)和TPD52L2(B)共表达基因的KEGG富集分析
2.7 共表达基因的PPI网络构建与核心基因的筛选结果
通过STRING数据库构建TPD52和TPD52L2共表达基因的PPI网络分析,TPD52的平均节点度为1.08,TPD52L2的平均节点度为1.33,PPI网络富集均P<0.001,随后分别下载PPI网络数据导入Cytoscape 软件中,使用CytoNCA插件筛选PPI网络中的核心共表达基因。分析结果显示:TPD52位于前10的核心共表达基因包括PLCG1、PRKACA、MAPK11、CYCS、NGFR、PTK2、NCOR2、NOTCH3、PSEN1和ST3GAL3(图8A),TPD52L2位于前10的核心共表达基因包括RUVBL1、NOP56、HSP90AB1、JAK2、CCT6A、PLCG1、PSMA7、EIF6、HJURP和TAF4(图8B)。
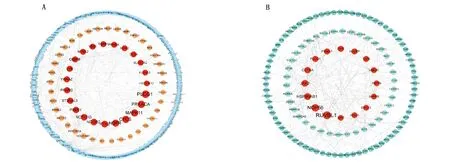
图8 TPD52(A)和TPD52L2(B)共表达基因的PPI网络
2.8 核心基因的生存期和相关性分析结果
使用Kaplan-Meier Plotter数据库验证TPD52和TPD52L2前5位核心共表达基因与胃癌患者总生存期的关系。结果表明:TPD52核心共表达基因PLCG1、PRKACA、MAPK11和NGFR高表达组比低表达组患者的总生存期低(P<0.05),CYCS高表达组比低表达组患者的总生存期高(P<0.05)(图9A-E)。TPD52L2核心共表达基因HSP90AB1高表达组比低表达组患者的总生存期低(P<0.05),核心共表达基因RUVBL1、NOP56、JAK2和CCT6A高表达组比低表达组患者的总生存期高(P<0.05)(图9F-J)。进一步借助R语言软件包ggplot2验证TPD52和TPD52L2与前5位核心共表达基因的关系,结果发现MAPK11、CYCS和NGFR是与TPD52关系最紧密的基因(P<0.05)(图10A-C),RUVBL1、NOP56、HSP90AB1和CCT6A是与TPD52L2关系最紧密的基因(P<0.05)(图10D-G)。
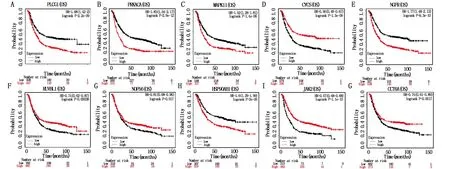
图9 TPD52(A-E)和TPD52L2(F-J)核心共表达基因在胃癌中的生存分析
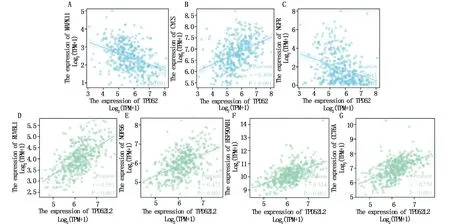
图10 TPD52(A-C)和TPD52L2(D-G)与核心共表达基因的相关性
3 讨论
TPD52最初在人类乳腺癌中被发现高表达,位于染色体8q21[20],是肿瘤中常见的染色体扩增区域,与细胞的增殖、凋亡和转移密切相关。miRNA是一种内源性非编码单链RNA分子,在动植物中参与转录后基因表达调控[21],miRNA通过结合靶信使mRNA的3′-UTR抑制mRNA转录,促进RNA降解。然而,TPD52和TPD52L2在不同肿瘤中可作为多种miRNA的靶点。有研究表明,miR-449、miR-34a、miR-1323和miR-218-5p通过靶向调节TPD52抑制乳腺癌细胞的增殖和转移[22-25],miR-107通过Wnt/β-连环蛋白信号通路下调TPD52的表达水平来增加乳腺癌细胞对紫杉醇的敏感性[26]。miR-218、miR-224和miR-103a-3p通过下调TPD52的表达抑制前列腺癌细胞的生长、侵袭和转移,促进细胞凋亡[27-29],外源性表达的TPD52也可激活PKB/Akt信号通路,通过ανβ3整合素促进前列腺癌细胞的迁移[30],另一方面,TPD52通过与PRDX1相互作用增加PRDX1过氧化物酶活性,外源性TPD52在前列腺癌细胞中的表达促进了PRDX1的二聚化,下调TPD52和PRDX1可协同抑制前列腺癌细胞的增殖[31]。miR-139-5p通过下调TPD52抑制子宫平滑肌瘤细胞的增殖,诱导细胞凋亡和G1期阻滞[32]。LEWIS等[33]研究发现,小鼠TPD52(mD52)在3T3细胞中的表达诱导多个参与促进转移的基因上调,而预防肿瘤形成和转移的基因则被下调。WANG等[34]沉默TPD52通过降低Akt在Ser473位点的磷酸化来抑制胰腺癌细胞的增殖、迁移和侵袭,并诱导细胞凋亡。TPD52在维甲酸诱导的IMR-32神经母细胞瘤细胞的体外神经元分化中也发挥了重要作用[35]。LI等[36]报道TPD52在结直肠癌中过表达通过诱导上皮-间充质(EMT)转化并激活黏着斑激酶介导的整合素和PI3K/Akt信号通路来促进癌细胞的迁移和侵袭。在肾细胞癌中,TPD52过表达可显著上调E-钙黏蛋白和下调N-钙黏蛋白与波形蛋白的表达,表明TPD52能抑制EMT转化,从而影响肿瘤的进展[7]。沉默TPD52还可抑制胃癌[37]、血管瘤内皮细胞[38]、鼻咽癌细胞[39]和肺鳞状细胞癌细胞[40]的进展,其TPD52的表达水平与胆管癌患者的病理分化和TNM分期密切相关[41]。
TPD52L2基因定位于染色体20q13[42],在人类肿瘤中广泛表达。有学者发现TPD52L2可以和一种在进化上非常保守的非跨膜ATP结合蛋白hABCF3结合,在体外促进肝癌细胞的增殖[43]。miR-485-5p直接下调其靶点TPD52L2显著抑制胶质瘤细胞的增殖、迁移和侵袭[44],TPD52L2的表达还可通过调节Wnt/β-连环蛋白/snail信号通路影响胶质母细胞瘤的恶性生物学行为[45]。miR-217通过沉默TPD52L2显著抑制胰腺癌细胞的增殖和转移,诱导细胞凋亡和G0/G1期阻滞[46]。REN等[47]研究显示TPD52L2高表达与前列腺癌患者的预后不良相关,沉默TPD52L2可抑制前列腺癌细胞的增殖和集落形成[48]。MUKUDAI等[49]发现TPD52L2通过talin 1介导的细胞外基质调节整合素的激活,从而影响口腔鳞状细胞癌细胞的迁移、细胞外基质的黏附和PKB/Akt的激活。ZHUANG等[50]对TPD52L2的敲除可增加PDH-E1α蛋白的降解,导致PDH酶活性降低,减少线粒体的耗氧量和活性氧的产生,从而促进了乳腺癌细胞对二甲双胍的耐药。
本研究结果表明,TPD52和TPD52L2在胃癌组织中高表达,其表达水平与临床病理特征和免疫细胞浸润密切相关,ROC曲线结果显示,TPD52和TPD52L2具有一定的诊断价值。生存曲线结果表明,TPD52L2高表达组比低表达组生存期明显缩短,TPD52和TPD52L2的单因素Cox分析结果表明,TNM分期和病理分期与胃癌患者的预后不良相关,多因素Cox分析结果表明,M分期是影响胃癌患者OS的独立危险因素,提示TPD52和TPD52L2可作为诊断胃癌的潜在分子靶标,进一步增强了TPD52和TPD52L2作为预后指标的可信度。通过对KEGG富集分析结果发现,TPD52相关基因主要参与了代谢通路和癌症的转录失调等信号通路,TPD52L2相关基因主要参与了癌症通路和剪接体等信号通路,表明TPD52和TPD52L2可能通过以上通路调控胃癌的发生发展。PPI网络中核心基因生存分析结果表明,高表达组的PLCG1、PRKACA、MAPK11、NGFR和HSP90AB1预后较差,相关性分析发现MAPK11、CYCS和NGFR是与TPD52关系最紧密的基因,RUVBL1、NOP56、HSP90AB1和CCT6A是与TPD52L2关系最紧密的基因,可作为探讨TPD52和TPD52L2参与胃癌恶性生物学行为的候选基因。
综上所述,本研究通过生物信息学的方法对TPD52和TPD52L2的深入挖掘,进一步证明了TPD52和TPD52L2与胃癌的发生发展存在密切的关系,可作为未来胃癌早期诊断和基因治疗的潜在靶点。但由于TPD52和TPD52L2影响胃癌患者预后的确切机制尚未完全阐明,应进一步进行实验来验证本研究的结论。

