胃神经内分泌癌的研究进展*
周凯 王安强 吴艳 李忠武 步召德
胃神经内分泌癌(gastric neuroendocrine carcinoma,G-NEC)是胃神经内分泌肿瘤的一个亚组,具有侵袭性强、分化差和预后差的生物学特性,发病率持续上升[1]。然而,由于G-NEC 的诊疗水平有限,导致患者的预期寿命普遍较短,中位生存期仅为4~16个月[2]。由于G-NEC 的罕见性、复杂性和异质性导致研究者对其认识的局限性。目前多数报道均为小型研究,集中于疾病的某些单一方面,或在大型研究中仅有少数G-NEC 病例被纳入到胃肠胰神经内分泌肿瘤的研究队列。单独研究G-NEC 的流行病学、临床表现、遗传背景、组织病理学和诊疗的大型独立研究相对罕见。为探寻更好的治疗方法并改善G-NEC 患者的预后,对其生物学特性进行深入的理解至关重要。本文通过对国内外文献进行系统综述,旨在为这一目标提供理论支持。
1 G-NEC 的命名演进
1867 年,德国的Theodor Langhans 首次对“类癌”进行了肉眼形态及组织学特征的描述;1888 年,德国的Otto Lubarski 对这一当时尚属模糊且难以解释的医学实体进行了重新审视,回顾分析35 例发生在回盲瓣附近的肠癌记录,并提出其中部分细胞的性质并非“真正的”癌;1890 年,英国的William Bramwell Ransom 报道了首例类癌综合征。1895 年,Notthafft将其称为“初发癌”[3]。1907 年,Siegfried Oberndorfer首次将其命名为“类癌”,强调其良性特征;后续研究中,其认为这些小肠肿瘤可能是恶性或者转移性肿瘤[4]。1980 年,世界卫生组织(WHO)将神经内分泌肿瘤分为4 类:Ⅰ 类癌;Ⅱ黏液类癌;Ⅲ混合型类-腺癌;Ⅳ 假瘤样变[5]。1995 年,意大利的Carlo Capella 首次提出“神经内分泌肿瘤(neuroendocrine tumor,NET)”概念,进而取代“类癌”一词。2000 年,WHO 根据NET 的不同生物学行为,将其分为5 个基本的类型:类癌-高分化神经内分泌肿瘤、高分化神经内分泌癌、小细胞癌-低分化神经内分泌肿瘤、混合性外分泌-内分泌肿瘤和肿瘤样病变[6]。2010 年,WHO 提出神经内分泌肿瘤的广泛定义:所有来自神经内分泌细胞的肿瘤。可分为神经内分泌瘤(G1/G2);低分化神经内分泌癌G3(neuroendocrine carcinoma,NEC),包括大细胞神经内分泌癌与小细胞神经内分泌癌;混合性腺癌神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)及增生和癌前病变[5]。2019 年,WHO 对胃肠道和肝胆胰器官神经内分泌肿瘤(neuroendocrine neoplasms,NENs)进行分类和分级更新,分为NET(G1,G2,G3)、NEC(包含小细胞型和大细胞型)、混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrinenon-neuroendocrine neoplasms,MiNEN)[7]。
2 G-NEC 的发病机制
目前,关于G-NEC 的组织起源仍存在争议。部分研究者认为G-NEC 可能起源于正常的肠嗜铬样细胞,在进化过程中,这些细胞可能经历基因突变累积,进而形成胃神经内分泌瘤(gastric neuroendocrine tumor,G-NET),进一步发展形成G-NEC[8]。然而,有研究认为G-NET 和G-NEC 具有不同的起源,两者在遗传学和临床病理特征上是不同的,NET 和低级别NEC 的增殖活性不同于高级别NEC,提示其可能来自不同的前体细胞群[9]。有研究认为G-MiNEN 是胃腺癌向G-NEC 发展的中间阶段,胃神经内分泌细胞主要起源于腺癌成分中出现的神经内分泌前体细胞,在克隆扩增过程,腺癌成分可能坏死或脱落,而神经内分泌成分迅速发展[10]。还有研究认为G-NEC 是由多潜能干细胞衍生而来,当TP53、Rb1 或P16 或cyclin D1 信号通路发生改变时,多能干细胞可能分化为不同类型的癌细胞,并可能在不同阶段停止其独特的分化程序,多数情况会向鳞癌或腺癌转化,少数情况转化为NEC。目前对于G-NEC 的发生机制已存在一些假说,但对于其遗传学特征、与G-MiNEN 和GNET 之间的关系等尚不清楚。因此,仍需开展更多的研究,深入揭示这些肿瘤的基因改变和组织起源。在精准医学的时代背景下,破译G-NEC 致癌的分子途径不仅有助于指导靶向治疗,还能为预后信息提供重要参考。
3 G-NEC 的诊断及临床病理特征
G-NEC 主要依靠胃镜活检病理结果进行确诊,结合其组织形态和肿瘤的增殖活性,同时联合突触素(synaptophysin,Syn)、嗜铬粒素A(chromogranin A,CgA)、CD56 等免疫组织化学染色进行检测[11]。此外,还存在其它与G-NEC 相关的标志物。如,甲状腺转录因子1(thyroid transcription factor-1,TTF-1)属于同源域转录因子家族,有研究发现TTF-1 在胃肠胰NEC 表达阳性率为21.4%[12]。棘刺-梳状同源基因1(achaete-scute homologue 1)(在人类中称为hASH1)是一种螺旋环-螺旋(bHLH)转录因子的成员,在胃大细胞神经内分泌癌中表达稍微弱,在胃腺癌及正常组织黏膜中通常呈现阴性[13]。hASH1 在低分化神经内分泌癌中高表达,敏感性为71%,特异性为95%[14]。
关于外周血标志物,已有研究表明,50%以上的神经内分泌肿瘤患者血清中CgA 水平会升高。这一指标不仅能够反映肿瘤负荷情况,还能作为预测患者预后、肿瘤复发风险以及评估治疗效果的重要依据[15]。也有研究认为尽管CgA 在GEP-NET 中监测有效,但其对GEP-NEC 的诊断和监测价值不高[16]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)在神经内分泌组织起源有关的肿瘤中升高。在食管NEC 的研究中,发现NSE 的基线水平与化疗反应和总生存期相关[17]。血清中的胰多肽及24 小时尿5-羟吲哚乙酸对神经内分泌肿瘤的诊断有帮助,但其受某些药物或食物的影响,可能出现假阳性结果[18]。显然,相较于单独使用每一个标志物,肿瘤标志物的组合在诊断和预后评估中能够提供更多、更有价值的信息。
4 G-NEC 的分子生物学特征探索
关于G-NEC 的分子机制,目前仍存在诸多未知。尽管我们对胃肠胰NEC 分子的研究和理解尚显不足,但已有的研究成果与肺NEC 丰富的细胞遗传学和分子研究结果相吻合,均表现出高度的染色体不稳定性和复杂的染色体组型[19]。有研究采用微卫星分析技术,发现胃肠NEC 中等位基因缺失的现象极为普遍,这种缺失通常涉及广泛的染色体区域或整个染色体。进一步通过间期荧光原位杂交测定验证,结果表明非整倍性是这些核型的主要特征[20]。
自高通量方法发展以来,研究者对肿瘤组织miRNA图谱进行了全面的研究,并确定了特异性miRNA 信号作为癌症诊断、治疗效果预测和预后的潜在生物标志物[21]。2003 年,有研究发现肿瘤组织中miR-143和miR-145 的表达水平显著低于正常黏膜,这是首次报道胃肠道癌中miRNA 特异性变化[22]。在G-NEC中miRNA 的生物学特征和功能至今仍是一个未被充分探索的领域。有研究通过分析G-NEC 转录组发现,G-NEC 和胃腺癌样本中下调基因的功能富集模式存在显著性差异。CACNA1A 作为多个差异基因和信号通路网络的核心节点,可能参与介导G-NEC 对伊立替康的耐药。NeuroD1 基因敲除后促进G-NEC 细胞生长,并且增强对伊立替康的敏感性。此外,NeuroD1 与G-NEC 的预后相关,其水平低的患者生存期更长,提示NeuroD1 可能是G-NEC 的重要致癌基因。因此,该研究推测,NeuroD1 或许能成为进一步研究G-NEC 的极具潜力的特异性靶点。为了验证这一推测,可以开展相关的体内实验,利用G-NEC 细胞系异种移植模型来探究其化学敏感性的变化[23]。此外,有研究分析G-NEC 细胞系的肿瘤/非肿瘤组织的转录组图谱,在体外和体内的研究中观察到SNAP25基因敲除后降低G-NEC 细胞的增殖和肿瘤生长,并增加G-NEC 细胞对多种化疗药物5-氟尿嘧啶和紫杉醇的敏感性。同时证实了通过RUNDC3A 和SNAP25 的过度表达可以调节Akt 蛋白稳定性,从而促进G-NEC 肿瘤生长和化疗耐药性的新机制[24]。Griger 等[25]研究对36 例G-NEC/MANEC 患者的肿瘤进行全基因组和转录组测序分析,绘制G-NEC 及其组织学变体的基因组图谱,发现MYC 是G-NEC 的关键驱动因素,胃神经内分泌细胞可能是G-NEC 的起源细胞。此外,该研究还揭示了G-NEC 的关键脆弱性,为疾病发病机制、治疗靶点提供多方面的见解(表1)。
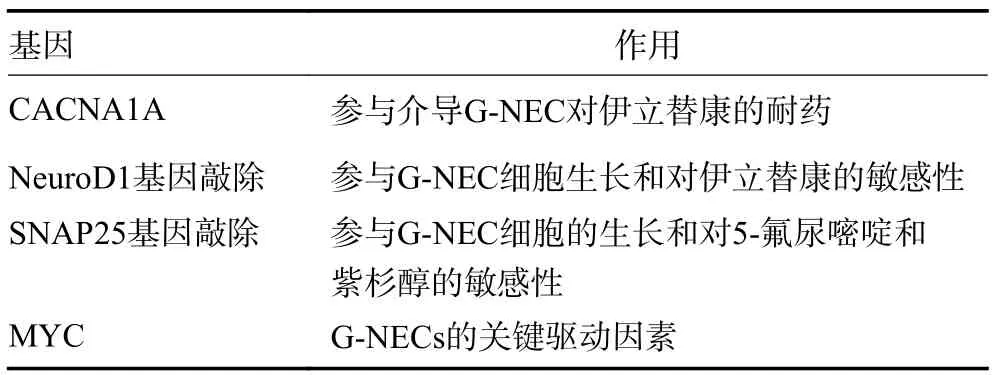
表1 部分与G-NEC 相关的基因及功能
5 G-NEC 的治疗进展
5.1 手术治疗
手术治疗是G-NEC 的首选治疗方式[26],也是唯一可能治愈的方式,目前仍然遵循胃腺癌的治疗原则[27-28]。吴文欢等[29]认为肿瘤直径<1 cm 且在cT2 以下,可选择内镜下黏膜切除术。董兰花等[30]认为5~10 mm 的G-NEC 即可出现脉管癌栓,有肿瘤复发和转移的风险,建议行腹腔镜胃局部切除术。同时有研究表明肿瘤直径在1~2 cm,可以先行胃部分切除术,术中送快速病理,若侵及肌层则行胃癌根治术,否则只需行胃局部切除术[29]。李燕等[31]认为,如果GNEC 的直径<2 cm 且在cT2N0 以下,可直接进行胃局部切除术。对于Ⅳ期G-NEC,美国国立综合癌症网络(NCCN)建议化疗是一线治疗,如果出现进展,则考虑采用纳武利尤单抗+伊匹木单抗,未提及手术治疗[32]。但是,Li 等[33]利用美国国立癌症研究所(NCI)的大型肿瘤数据库进行回顾性分析,结果显示,无论远处转移发生在一处还是多处,无论是转移至肝脏、卵巢、腹膜还是其他部位,手术切除原发灶均能有效改善患者的预后。然而,关于姑息性切除原发性肿瘤是否能为Ⅳ期G-NEC 患者带来生存获益,目前仍存在争议(表2)。

表2 G-NEC 的手术方式及适用情况
5.2 非手术治疗
由于NEC 和小细胞肺癌具有临床病理特征的相似性,因此有研究建议G-NEC 的一线方案采用顺铂联合依托泊苷(EP)、顺铂联合伊立替康(IP)[34]。尽管Ⅰ期的胃腺癌不推荐术后辅助化疗,但在G-NEC 的治疗中应考虑给予术后辅助化疗[27]。对于晚期GNEC,Zhang 等[35]发现IP 联合长效奥曲肽的疗效令人满意。伊立替康联合氟尿嘧啶、亚叶酸钙(FOLFIRI)、奥沙利铂联合氟尿嘧啶、亚叶酸钙(FOLFOX)、卡培他滨联合替莫唑胺通常被认作二线化疗用药,具体疗效尚缺乏验证[36],目前尚未建立有循证医学证据的二线方案。国内有研究表明对于可切除的胃肠胰神经内分泌肿瘤,辅助治疗与5 年无复发生存率呈负相关,并且不会带来总体生存时间获益[37]。G-NEC 的异质性可能是造成辅助化疗治疗效果差的原因之一。对于G-NEC 的新辅助化疗,有研究发现新辅助化疗组3、5 年总生存均优于手术组,新辅助化疗组接受EP/IP方案与非EP/IP 方案患者的总生存相似[28]。另有研究发现新辅助化疗不能改善G-NEC 患者的预后,甚至可能会缩短患者的生存时间[38]。上述研究均把GNEC 和G-MANEC 患者一并纳入研究,且新辅助化疗方案不一,这可能影响了结果的准确性和可比性。因此对于G-NEC 围术期辅助化疗的治疗指征及化疗方案,还需要进一步研究。
目前尚缺乏针对G-NEC 的靶向治疗,Griger 等[25]在小鼠和人G-NEC 中对舒尼替尼和几种选择性mTOR 抑制剂进行测试,结果发现舒尼替尼在小鼠和人G-NEC 中仅出现药物相关的不良反应。同样,mTORC2(JR-AB2-011)和mTORC1(依维莫司)抑制剂不引起或仅引起微弱的治疗反应。该研究还发现在临床相关浓度下,双重 mTORC1/C2 抑制剂萨帕尼色替布(sapanisertib )在 G-NEC 中具有很好的治疗反应。此外,该研究发现Hsp90 抑制剂,伊利司莫(elesclomol )和STA-9 090(ganetespib)两种药物在小鼠和人G-NEC 的验证试验中均显示出较好的治疗反应。
对于G-NEC 的免疫治疗,一项针对胃肠胰NEN的多中心Ⅰb 期临床试验,NEC 患者占比80%,其中8 例患者对抗程序性死亡受体1 抗体特瑞普利单抗治疗显示出有效性。这一结果表明,特瑞普利单抗在治疗复发性或转移性NENs 方面展现出抗肿瘤活性和安全性。此外,该研究还发现,程序性死亡配体-1 表达阳性、高肿瘤突变负荷和(或)微卫星不稳定的患者可能从这种治疗中获益。同时,ARID1A 的基因组突变和高基因组重排可能与临床获益存在相关性[39]。对于免疫治疗方案的探索不仅包括单一免疫检查点抑制剂的应用,还包括与化疗、靶向治疗和放射性药物的组合治疗,以及探索新的免疫治疗靶点和机制,如针对DLL3 的双特异性抗体和T 细胞激活剂的研究。上述综合治疗方案为G-NEC 患者提供更多、更有效的治疗选择,特别是对于那些对传统治疗方法无效的患者。
6 结语与展望
随着对G-NEC 的深入关注和认识,其发病率呈现逐年上升的趋势。G-NEC 与传统的胃腺癌在恶性程度和预后方面存在显著性差异,多数G-NEC 患者呈现出更差的生物学特性,包括较高的侵袭性和转移倾向。然而,当前对G-NEC 的发病机制、分子生物学特征以及治疗机制的认识仍然十分有限,导致其治疗策略缺乏针对性和系统性。因此,迫切需要开展更多具有前瞻性和随机对照的研究,以探索G-NEC 的病理生理学基础和潜在的治疗靶点。此外,考虑到GNEC 的复杂性和多样性,未来的研究需要采取多中心、跨学科的合作方式,共同探索更有效的治疗方法。通过整合不同学科的知识和技术,有望揭示G-NEC 的病理机制,发现新的生物标志物,以及开发出更为精准和有效的治疗策略,最终实现改善G-NEC 患者的预后和生存质量的目标。
本文无影响其科学性与可信度的经济利益冲突。

