胃窦癌组织中LAG-3 FGL1 MHC-Ⅱ的表达与预后的关系*
戚颖 黄子祺 别鸿宇 颜次慧 任秀宝
胃癌是全球最常见的恶性肿瘤之一,死亡率居癌症相关死亡第4 位[1]。胃窦是炎症、溃疡和肿瘤的高发部位,胃窦癌(gastric antral cancer,GAC)是消化系统常见的恶性肿瘤[2]。免疫治疗已成为癌症治疗的重要方式,研究者越来越认识到免疫检查点在肿瘤免疫治疗中的关键作用。免疫检查点是T 细胞表面的信号分子,可以通过调控其活性并参与免疫反应。通过阻断免疫检查点,可以促使肿瘤消退。因此,研究免疫检查点与癌症临床治疗的关系至关重要[3-5]。目前研究较多的是PD-1、PD-L1 抑制剂,但其并不能对所有肿瘤患者有效,因此有必要找出更多的免疫检查点。靶向多个免疫检查点可能是一种有前途的策略,可以阻断免疫检查点的抑制作用,从而在癌症中获得更多的抗肿瘤效果[6]。淋巴细胞激活基因3(lymphocyteactivation gene 3,LAG-3)是一种免疫检查点受体蛋白,可在活化的T 淋巴细胞上表达,其在抗肿瘤免疫中的作用越来越受到重视[7]。纤维蛋白原样蛋白1(fibrinogen-like protein 1,FGL1)是肝脏分泌的与增殖和代谢有关的蛋白。多项研究证明FGL1 是LAG-3 的一个新型免疫检查点配体,阻断FGL1、LAG-3 相互作用可能为新型免疫检查点抑制剂治疗带来希望[8]。主要组织相容性复合体Ⅱ类分子(major histocompatibility complex class Ⅱ,MHC-Ⅱ)是LAG-3 的经典配体,LAG-3 与MHC-Ⅱ的结合可以抑制T 细胞的活化,从而发挥负性免疫调节的功能,维持内环境稳定[9]。本研究旨在探讨LAG-3 与其配体FGL1、MHC-Ⅱ在胃窦癌中的表达情况,以及与临床病理特征和预后的关系,从而为临床肿瘤免疫治疗研究提供新线索。
1 材料与方法
1.1 临床资料
1.1.1 病例资料 收集天津医科大学肿瘤医院2012年1 月至2014 年12 月诊断为GAC 患者的组织石蜡标本67 例。纳入标准:1)所有患者均行胃部肿瘤切除术,术前未进行其他抗癌治疗,经病理确诊为胃窦癌;2)临床分期均为Ⅲ期;3)均有完整的病历资料,留有完整组织标本。排除标准:1)术前接受其他抗癌治疗;2)临床病理资料不完整;3)精神疾病或认知障碍者。
全部标本中男性52 例,女性15 例;年龄30~82 岁,≤55 岁24 例,>55 岁43 例;分期采用国际抗癌联盟(UICC)和美国抗癌联合委员会(AJCC)第8 版TNM 分期。本研究获得天津医科大学肿瘤医院伦理委员会的批准(编号:E20230556),患者均知情同意。
1.1.2 主要试剂 抗体:#15372(LAG-3)购自美国Cell Signaling Tecnology 公司;ab275091(FGL1)购自英国Abcam 公司;ab7856(MHC-Ⅱ)购自英国Abcam 公司。DAB 显色试剂盒购自北京中衫金桥生物有限公司;二抗即酶标羊抗鼠/兔IgG 聚合物购自福州迈新生物技术开发有限公司。
1.2 方法
1.2.1 免疫组织化学检测 石蜡切片脱蜡后用枸橼酸盐缓冲液高温高压修复,3%H2O2封闭,一抗于4℃冰箱孵育过夜。第二天PBS 洗后,于室温孵育二抗,加入现配制的DAB 显色液显色,至出现棕色阳性反应。苏木素染色,盐酸分化,氨水返蓝,乙醇梯度脱水,置于通风橱晾干后树胶封片显微镜下观察。
1.2.2 收集信息 收集患者临床病理特征,随访至2023 年7 月,中位随访时间为35.5(4~123)个月。总生存期(overall survival,OS)定义为手术日期至任何原因死亡的时间,无病生存期(disease-free survival,DFS)定义为手术日期至肿瘤复发或由于肿瘤进展死亡的时间。全部患者失访13 例,故分析54 例患者LAG-3、FGL1、MHC-Ⅱ三个指标在各部位表达情况的生存曲线。
1.2.3 结果判定 评估时首先排除正常、坏死和压坏的伪影区域,然后对全片进行阅片。PBS 代替一抗作阴性对照,采用已知阳性切片作阳性对照。所有指标的结果均由两位病理科医师经双盲法测定,对免疫细胞及肿瘤细胞(细胞浆、细胞核)表达的百分比进行评估,为减小误差,最终结果取两位医生评估的平均值。阳性率(%)=阳性细胞数/总细胞数×100%
本研究中提到的LAG-3、FGL1、MHC-Ⅱ在免疫细胞和肿瘤细胞中的阳性率以及FGL1 的免疫组织化学评分(histochemistry score,H-score)均用简称代替(表1)。
表1 LAG-3、FGL1、MHC-Ⅱ在各部分表达的简称
组织化学评分(H-score):H-score=Σpi(i+1),公式中pi 表示特定指标阳性百分率;i 代表着色强度。着色强度分数:0 分(不着色 ),1 分(弱着色 ),2 分(中着色 ),3 分(强着色 )。
分组方法:根据年龄、性别、吸烟史、饮酒史、肿瘤大小和淋巴结转移情况分别进行分组,与LAG-3 免疫细胞、FGL1 肿瘤细胞、MHC-Ⅱ免疫细胞以及MHC-Ⅱ肿瘤细胞阳性表达率进行比较。
1.3 统计学分析
采用SPSS 26.0 和GraphPad Prism 8.0 软件进行统计学分析。对于非正态分布的两独立样本,采用Mann-WhitneyU法检验两组间是否存在差异。根据OS 制作受试者工作特征曲线选取截断值,采用Kaplan-Meier 法绘制生存曲线,采用Log-rank 法进行生存分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 免疫组织化学染色
2.1.1 LAG-3、FGL1、MHC-Ⅱ阳性表达细胞 LAG-3、FGL1、MHC-Ⅱ阳性表达细胞通过读片统计,LAG-3仅在免疫细胞中表达;FGL1 可在免疫细胞也可在肿瘤细胞中表达:免疫细胞中表达非常少,在本次试验中忽略不计,主要在肿瘤细胞中表达;MHC-Ⅱ在免疫细胞和肿瘤细胞中均有表达。
2.1.2 LAG-3、FGL1、MHC-Ⅱ阳性细胞定位 LAG-3、FGL1、MHC-Ⅱ在阳性细胞中的定位通过观察LAG-3 在免疫细胞细胞膜上表达;FGL1 在肿瘤细胞的细胞浆和细胞核中均表达,且细胞浆的表达明显高于细胞核;MHC-Ⅱ在免疫细胞细胞膜上表达,同时在肿瘤细胞的细胞浆和细胞核表达(图1~图3)。采用柯尔莫戈洛夫-斯米诺夫检验分析,表明LAG-3、FGL1、MHC-Ⅱ在各部分表达的百分比均不符合正态分布;FGL1 肿瘤细胞中细胞核表达率中位数(95%CI)和FGL1 肿瘤细胞核表达率中位数(95%CI)均为0,故未体现(表2)。
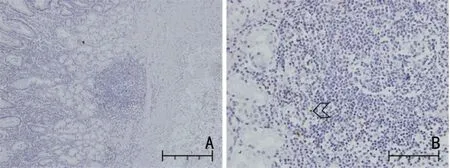
图1 LAG-3 在免疫细胞中的表达
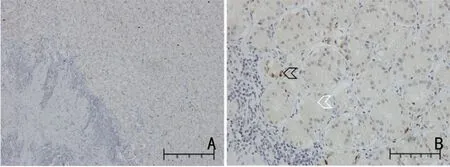
图2 FGL1 在肿瘤细胞中的表达
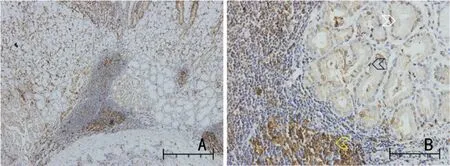
图3 MHC-Ⅱ在免疫细胞、肿瘤细胞细胞浆和肿瘤细胞细胞核中的表达
表2 LAG-3、FGL1、MHC-Ⅱ在各部分表达的中位数(95%CI)
2.2 LAG-3、FGL1、MHC-Ⅱ在不同细胞内表达率和病理特征的相关性
LAG-3 免疫细胞阳性率与肿瘤大小、淋巴结是否转移具有统计学相关性(P<0.05),肿瘤大小<4 cm的患者和无淋巴结转移的患者LAG-3 免疫细胞阳性率更高;与患者年龄、性别、有无吸烟史、有无饮酒史无统计学相关性(P>0.05)。而MHC-Ⅱ在肿瘤细胞中的阳性率与患者性别具有统计学相关性(P<0.05),女性患者MHC-Ⅱ免疫细胞阳性率更高;与年龄、有无吸烟史、有无饮酒史、肿瘤大小、淋巴结是否转移差异无统计学相关(P>0.05),见表3。所有分组中的数据均不符合正态分布,故采用Mann-WhitneyU检验统计数据。
表3 LAG-3、FGL1、MHC-Ⅱ在不同细胞内表达率和病理特征的相关性
2.3 GAC 患者病理特征及LAG-3、FGL1、MHC-Ⅱ在免疫细胞和肿瘤细胞内的表达与生存的关系
LAG-3 免/免高的患者的OS 显著高于LAG-3 免/免低的患者(P<0.05,图4A);LAG-3 免/总高的患者的OS 显著高于LAG-3 免/总低的患者(P<0.05,图4B);MHC-Ⅱ免/总高患者的OS 显著高于MHC-Ⅱ免/总低的患者(P<0.05,图5A);MHC-Ⅱ肿/总高的患者的OS 显著低于MHC-Ⅱ肿/总低的患者(P<0.05,图5B);MHC-Ⅱ核/肿高的患者的OS 显著低于MHC-Ⅱ核/肿低的患者(P<0.05,图5C)。MHC-Ⅱ免/总高的患者的DFS 显著高于MHC-Ⅱ免/总低的患者的(P<0.05,图6A);MHC-Ⅱ肿/总高的患者的DFS 显著低于MHC-Ⅱ肿/总低的患者(P<0.05,图6B);MHC-Ⅱ浆/总高的患者的DFS 显著低于MHC-Ⅱ浆/总低的患者(P<0.05,图6C)。同时也对表2 中除上述外其余指标均进行生存分析发现差异无统计学意义,与生存预后无相关性(表2)。
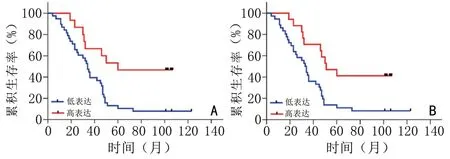
图4 LAG-3 在免疫细胞中表达水平与生存的关系

图5 MHC-Ⅱ在免疫细胞、肿瘤细胞中的表达水平和生存的关系
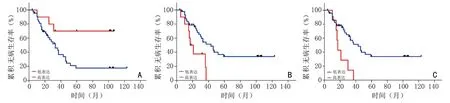
图6 MHC-Ⅱ在免疫细胞、肿瘤细胞中的表达水平和预后的关系
综上所述,GAC 患者LAG-3、MHC-Ⅱ在免疫细胞上的高表达预示着较好的预后。
3 讨论
2020 年,胃癌新发病例约有100 万例,发病率居全部恶性肿瘤第5 位,病死率居第4 位[10]。胃窦是炎症、溃疡和肿瘤的好发部位,胃窦癌是消化系统常见的、多发的恶性肿瘤。免疫检查点的研究是肿瘤免疫治疗至关重要的一环。
LAG-3 主要表达在活化的CD4 和CD8 T 细胞上、NK 细胞和浆细胞样树突状细胞表面,是一种抑制性受体,是继 PD-1、PD-L1 之后最具有应用前景的免疫检查点之一[11]。LAG-3 分子作为一种免疫检查点受体蛋白,在多种实体肿瘤中表达异常,且与疾病预后有关。T 细胞中的LAG-3 表达是免疫抑制和肿瘤侵袭进展的标志物,说明LAG-3 在肿瘤免疫中发挥重要的调控作用。Lv 等[12]研究认为,与LAG-3 表达阳性细胞百分比低的患者相比,肿瘤组织中LAG-3 表达阳性细胞比例高的胃癌患者生存期更短,LAG-3 阳性表达与胃癌的不良预后有关。LAG-3 选择性地与抗原提呈细胞和肿瘤细胞的MHC-Ⅱ相互作用,从而激活共抑制信号通路,最终导致T 细胞功能障碍。因此,靶向LAG-3 抑制其免疫抑制活性被认为具有巨大的临床应用潜力。但在某些实体瘤的研究中得出相反的结论:LAG-3 的高表达与良好的OS 和DFS 相关,特别是在早期阶段[11]。Zhang 等[13]研究报道,在包含所有阶段(Ⅰ~ Ⅳ)的食管鳞状细胞癌混合队列中,LAG-3 表达与生存率提高相关,而LAG-3 的高表达对结局的有利影响仅限于Ⅰ~Ⅱ期肿瘤。本研究纳入67 例GAC 患者,发现肿瘤大小<4 cm 的患者和无淋巴结转移的患者LAG-3 免疫细胞阳性率更高,LAG-3 免疫细胞表达率高的GAC 患者有更好的OS,可能的原因是LAG-3 在免疫细胞中的表达增加不能单纯视为免疫抑制作用,或许可能是增强了炎症免疫反应,刺激肿瘤微环境中淋巴细胞发挥抗肿瘤反应,从而获得较好的OS。总而言之,LAG-3 在胃窦癌中的确切作用机制目前尚不明确,其在免疫系统中发挥的具体调节作用有待未来进一步研究。
FGL1 与LAG-3 受体高亲和力结合产生抑制信号,阻断LAG-3/FGL1 相互作用能够促进肿瘤微环境中T 细胞的活化和增殖,增强机体抗肿瘤免疫功能。癌症患者血浆中FGL1 升高与预后不良和免疫治疗效果有关[14-15]。Zhang 等[16]研究发现,FGL1 在胃癌组织中表达升高,与预后不良相关。本研究表明,FGL1 在免疫细胞和肿瘤细胞中的表达与GAC 患者的预后无显著相关。这可能与LAG-3 存在多种配体并且与这些配体相互作用有关。
MHC-Ⅱ主要由抗原提呈细胞表达,活化的CD4+T 细胞通过T 细胞抗原受体与MHC-Ⅱ分子呈递的抗原结合并发挥效应。本研究中免疫细胞中MHC-Ⅱ高表达较低表达患者的预后较好,与预期一致。然而,MHC-Ⅱ也可能是由肿瘤细胞表达,其可能与T 细胞浸润和IFN-γ 信号通路基因富集相关。本研究中GAC 患者肿瘤细胞中MHC-Ⅱ高表达较低表达的患者预后差,可能是肿瘤细胞中MHC-Ⅱ与LAG-3 相互作用,产生免疫抑制信号,影响免疫细胞的功能。另有报道表明,肿瘤MHC-Ⅱ表达与多种癌症类型(如乳腺癌、结肠癌、黑色素瘤)的良好预后相关[17]。推测在不同肿瘤、不同类型细胞中MHC-Ⅱ的表达可能对LAG-3 阳性T 细胞产生不同的影响,存在不一样的机制,有待进一步研究。
本研究详细分析了LAG-3、FGL1、MHC-Ⅱ在不同区域表达量的差异,以及与GAC 预后的关系。GAC 患者LAG-3 免/免、LAG-3 免/总高表达与较好的OS 相关,可能提示免疫细胞处于活化状态,具有抗肿瘤潜力并发挥作用。后续可更深入地探索LAG-3与其配体FGL1、MHC-Ⅱ的相互调控机制,为肿瘤免疫调控的研究以及临床转化应用提供线索。
本文无影响其科学性与可信度的经济利益冲突。

