血液炎症指标与cN0 期甲状腺乳头状癌颈部淋巴结转移的关系△
肖雨,齐洪志,努尔比耶·米吉提,李玉莹
新疆医科大学第一附属医院肿瘤科,乌鲁木齐 830000
甲状腺癌是内分泌系统中最常见的恶性肿瘤,2020 年全球新发甲状腺癌病例超过了58 万例,发病率居第九位,女性甲状腺癌发病率约为男性的3 倍,达10.1/10 万[1]。近几十年来,全球甲状腺癌的发病率呈上升趋势,中国女性甲状腺癌发病率迅速增长,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占主要部分[2-3]。PTC 是甲状腺癌中最常见的组织学亚型,占新发病例的90%以上[4]。外科手术切除是目前PTC 的标准治疗方法之一,接受手术治疗的患者一般预后较好[5]。然而,伴有颈部淋巴结转移的患者生存率降低,死亡风险增加[6-7]。术前颈部淋巴结转移的精准判断与PTC 的临床分期及治疗方式直接相关,而目前常规的检查方法包括超声、CT 及MRI,诊断能力并不理想[8]。需要寻找一种简便可靠的方法来评估PTC 术前颈部淋巴结转移情况。近些年研究发现,PTC 的发生及发展与肿瘤微环境中免疫炎症反应密切相关[9]。血液炎症指标作为循环免疫标志物能够反映机体的免疫状态,具有鉴别甲状腺结节性质及预测甲状腺癌预后的潜力[10-11]。目前针对血液炎症指标与PTC 淋巴结转移相关性的研究较少。本研究探讨血液炎症指标与cN0期PTC颈部淋巴结转移的关系,旨在为PTC 术前颈部淋巴结转移状态的评估及治疗方案的制订提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2021 年1 月至2023 年3 月就诊于新疆医科大学第一附属医院的cN0期PTC 患者的病历资料。纳入标准:①初次行甲状腺切除术及颈部淋巴结清扫术,且术前超声未见颈部淋巴结转移;②术后经病理检查诊断为PTC;③术前未进行放化疗、131碘等抗肿瘤治疗;④病历资料完整。排除标准:①合并其他恶性肿瘤;②合并血液系统疾病、自身免疫性疾病或伴有严重肝肾功能不全;③合并高血压、冠心病、糖尿病、急性或慢性感染性疾病等可造成血常规异常的疾病;④术前2 个月内服用过激素类、抗凝血药物等影响血液指标的药物。根据纳入、排除标准,共纳入418 例cN0期PTC患者,按术后病理显示淋巴结转移情况分为无淋巴结转移组(324 例)和淋巴结转移组(94 例),淋巴结转移为术前超声检查未能发现的淋巴结转移,但通过病理检查确认其实际存在转移情况。本研究经过新疆医科大学第一附属医院医学伦理委员会审批通过(K202311-25)。
1.2 研究方法
所有患者术前均行甲状腺及颈部淋巴结超声检查,并经超声科医师出具诊断报告。采集患者术前1 周内晨起空腹静脉血液标本,经全自动血液细胞分析仪检测相关炎症指标,包括中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、全身炎症反应指数(systemic inflammatory response index,SIRI)、系统性免疫炎症指数(systemic immune inflammation index,SII),SIRI=中性粒细胞计数×单核细胞计数/淋巴细胞计数,SII=血小板计数×中性粒细胞计数/淋巴细胞计数。术后甲状腺组织标本经由高年资病理科医师诊断并出具病理报告。详细记录患者的一般资料及病理参数。
1.3 统计学方法
采用SPSS 26.0 软件进行数据分析。计数资料以例数及率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验;影响因素分析采用Logistic 回归分析;预测价值分析采用受试者工作特征(receiver operating characteristic,ROC)曲线;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 cN0期PTC 患者颈部淋巴结转移影响因素的单因素分析
无淋巴结转移组与淋巴结转移组患者肿瘤数量、肿瘤位置、T 分期、腺外侵犯情况、淋巴细胞计数、血小板计数、PLR 和LMR 比较,差异均无统计学意义(P﹥0.05)。无淋巴结转移组与淋巴结转移组患者性别、年龄、肿瘤直径、白细胞计数、中性粒细胞计数、单核细胞计数、NLR、SII 和SIRI 比较,差异均有统计学意义(P﹤0.05)。(表1)
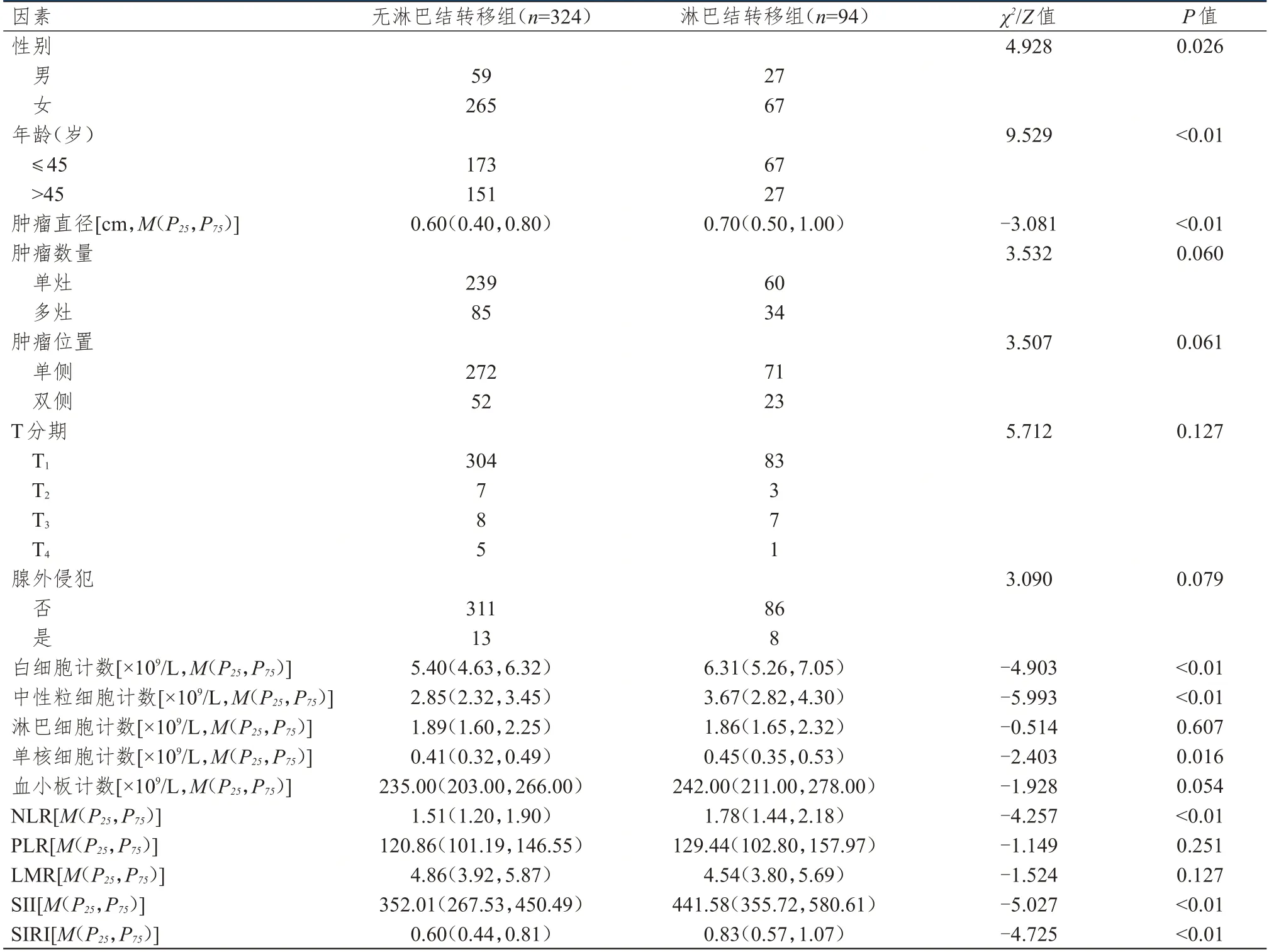
表1 cN0期PTC 患者颈部淋巴结转移影响因素的单因素分析
2.2 cN0期PTC 患者颈部淋巴结转移影响因素的多因素分析
将单因素分析中差异有统计学意义的9 项指标(性别、年龄、肿瘤直径、白细胞计数、中性粒细胞计数、单核细胞计数、NLR、SII、SIRI)作为自变量建立Logistic 回归模型,结果显示,年龄、肿瘤直径、SII 均是cN0期PTC 患者颈部淋巴结转移的独立影响因素,其中年龄越小、肿瘤直径越大、SII 越高的患者越容易合并颈部淋巴结转移。(表2)
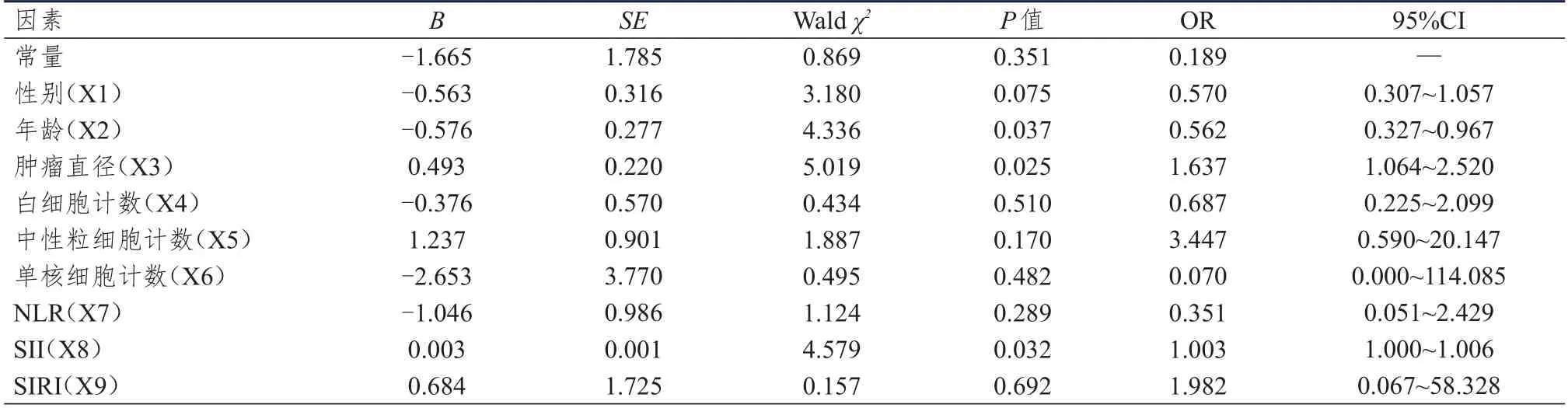
表2 cN0期PTC 患者颈部淋巴结转移影响因素的多因素Logistic 回归分析
2.3 预测模型对cN0期PTC 患者颈部淋巴结转移的预测价值分析
将年龄(X2)、肿瘤直径(X3)、SII(X8)这3 个影响因素作为回归方程的参数建立预测模型,回归方程为:Logit(P)=In[P/(1-P)]=-1.665-0.576X2+0.493X3+0.003X8,由此得出预测cN0期PTC 患者颈部淋巴结转移的概率模型为:P=1/[1+Exp(1.665+0.576X2-0.493X3-0.003X8)]。该模型可以基于患者年龄、肿瘤直径和SII,计算出患者存在颈部淋巴结转移的概率。对预测模型进行拟合优度检验,结果显示,χ2=11.543,P=0.173﹥0.05,表明在预测模型中,根据模型所获得的预测值与样本的实际观察值之间没有明显差异,预测模型方程的拟合是可行的。采用ROC 曲线评价该模型对cN0期PTC 患者颈部淋巴结转移的预测价值,曲线下面积(area under the curve,AUC)=0.743,95%CI:0.686~0.799,P﹤0.01,最佳截断值为0.197 时,灵敏度为0.755,特异度为0.648(图1)。
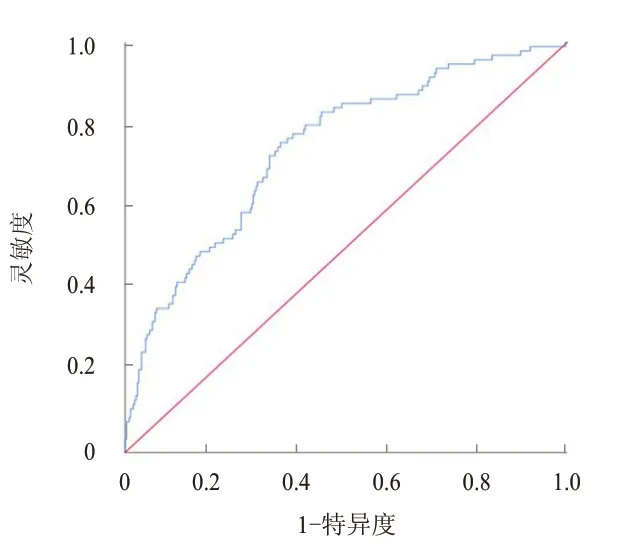
图1 预测模型预测cN0期PTC患者颈部淋巴结转移的ROC曲线
2.4 NLR、SIRI、SII 对cN0期PTC 患者颈部淋巴结转移的预测价值
采用ROC 曲线确定术前NLR、SIRI、SII 最佳截断值,并评估以上指标对cN0期PTC 患者颈部淋巴结转移的预测价值,结果显示,NLR、SIRI、SII 预测cN0期PTC 患者颈部淋巴结转移的AUC 分别为0.644、0.660、0.670,最佳截断值分别为1.605、0.815、419.405,对应的灵敏度分别为63.8%、51.1%、59.6%,特异度分别为57.7%、75.6%、68.2%。(图2、表3)
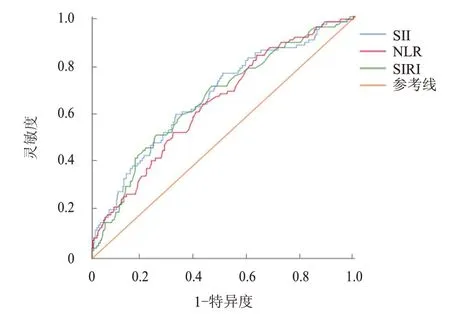
图2 NLR、SIRI、SII预测cN0期PTC患者颈部淋巴结转移的ROC曲线

表3 NLR、SIRI、SII 对cN0期PTC 患者颈部淋巴结转移的预测价值
2.5 术前NLR、SII、SIRI 与cN0期PTC 患者临床特征的关系
根据最佳截断值将cN0期PTC 患者分别分为低NLR 组(≤1.605)和高NLR 组(﹥1.605)、低SIRI组(≤0.815)和高SIRI 组(﹥0.815)、低SII 组(≤419.405)和高SII 组(﹥419.405)。低NLR 组与高NLR 组患者肿瘤直径比较,差异有统计学意义(P﹤0.05);低SIRI 组与高SIRI 组患者肿瘤直径、T 分期、腺外侵犯情况比较,差异均有统计学意义(P﹤0.05)。(表4)
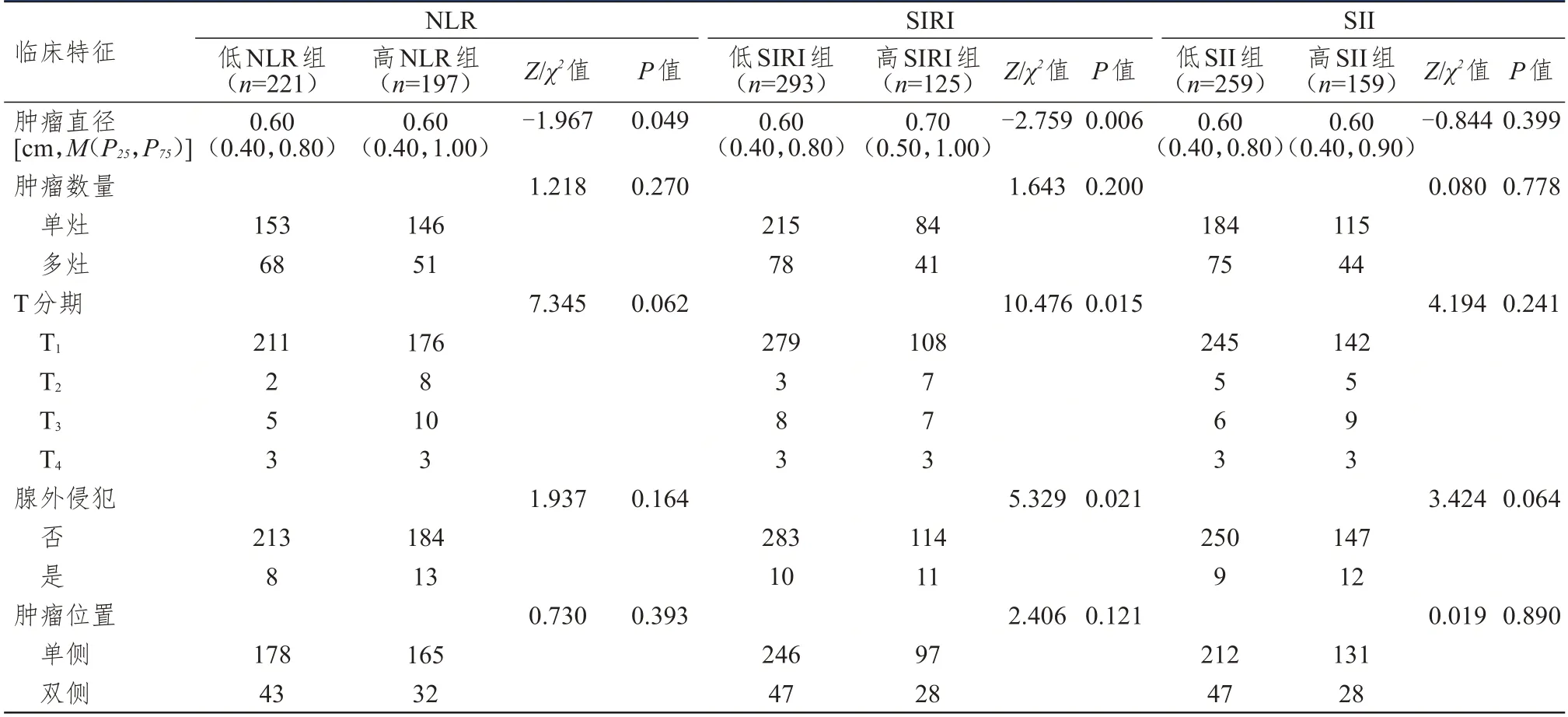
表4 术前NLR、SII、SIRI 与cN0期PTC 患者临床特征的关系
3 讨论
随着肿瘤筛查的普及和影像学技术的不断进步,近年来甲状腺癌的发病率也随之迅速增长,其中包含越来越多无症状的低风险肿瘤。有研究认为,无症状的甲状腺微小乳头状癌无需行手术治疗,对于临床诊断无淋巴结转移(cN0期)证据的患者,行预防性中央区淋巴结清扫术仍存在争议[12]。临床常用的淋巴结转移诊断方法如超声或CT 检查仍具有一定的局限性,由于中央区淋巴结前方有腺体、管腔结构和骨性结构的遮挡,干扰了超声对中央区隐匿性淋巴结的检出效能[13]。CT 检查诊断中央区淋巴结转移的灵敏度要高于超声,但其特异度偏低[14]。除外常用的影像学方法,近年来血液指标渐渐受到人们的关注。
现代免疫学研究显示,炎症与肿瘤的发生及转移密切相关,炎症协调了肿瘤微环境中免疫细胞的浸润及免疫逃逸,从而影响了肿瘤的侵袭和转移。炎症指标在一定程度上可以反映机体免疫状态,且因其方便快捷、易获取的特点,越来越受到人们的关注,用于肿瘤诊断及预后预测。
中性粒细胞在白细胞中占比最高,是参与早期炎症反应的主要细胞,其通过抑制肿瘤杀伤细胞、促进肿瘤新生血管生成等方式来促进肿瘤的进展和转移,是乳腺癌、胃癌、食管癌等肿瘤转移或预后预测指标[15-17]。淋巴细胞是机体免疫应答功能的重要成分,CD8+T 淋巴细胞可通过释放穿孔素和颗粒酶启动细胞凋亡,也可通过Fas-Fas 配体相互作用直接杀伤肿瘤细胞。CD4+T 淋巴细胞作为免疫系统中的辅助角色,通常通过分泌各种细胞因子激活CD8+T 细胞,维持和增强其抗肿瘤特性。淋巴细胞减少是鼻咽癌、乳腺癌不良结局的预测因素[18-19]。NLR 已被证实在多种肿瘤诊断及预后评价中发挥重要作用。Mjaess 等[20]发现,NLR 升高预测了泌尿系肿瘤患者总生存期、无进展生存期和无复发生存期更差。Kocer 等[10]发现PTC 患者的NLR 明显高于结节性甲状腺肿和淋巴细胞性甲状腺炎患者。
血小板来源于巨核细胞细胞质的裂解脱落,除了参与凝血与止血,血小板可直接或间接促进肿瘤的生长及转移,一方面其可通过表面的多功能受体与配体结合促进肿瘤的转移,另一方面,血小板可通过释放生长因子影响肿瘤的生长及扩散,还可保护肿瘤免受自然杀伤细胞破坏[21]。研究表明,血小板增多与肿瘤预后不良相关,可作为胃癌、直肠癌转移及复发的预测指标[22-23]。因此,PLR 作为血小板计数与淋巴细胞计数的比值,可用于肿瘤的诊断及预后分析。Kim 等[24]发现,在PTC 中,术前较高的PLR 提示了更高的颈部淋巴结转移率。
单核细胞可作为肿瘤微环境中浸润性巨噬细胞和树突状细胞的前体促进肿瘤生长,调节肿瘤转移。LMR 较低也被认为是多种恶性肿瘤的不良预后因素[25-26]。在PTC 中,Huang 等[11]的研究结果显示,NLR、PLR 和LMR 与侵袭性临床特征和术后复发密切相关;而Lang 等[27]认为,NLR 与cN0期PTC 的隐匿性中央区淋巴结转移无相关性。基于中性粒细胞、血小板的促癌作用及淋巴细胞的抑癌作用,Hu 等[28]开发了一种新型指标SII,SII 同时结合NLR 与PLR,放大了诊断效能,能更全面客观地反映机体的炎症与免疫平衡。另一炎症指标SIRI 由Qi 等[29]首次提出,其基于中性粒细胞、单核细胞和淋巴细胞计数,可用于预测胰腺癌化疗患者的生存率。
本研究结果显示,术后病理证实有淋巴结转移的PTC 患者SII、SIRI、NLR、中性粒细胞计数均高于无淋巴结转移患者,这表明以上指标的检测有助于PTC 患者颈部淋巴结转移状态的鉴别。本研究显示PLR 和LMR 并无此种鉴别能力。基于不同淋巴结转移状态术前血液指标所表现出的这种差异,本研究试图进一步利用术前血液中的免疫指标结合临床特征以鉴别术前超声显示cN0期患者的真实淋巴结转移情况。NLR、SIRI、SII 预测cN0期PTC 患者颈部淋巴结转移的灵敏度分别为63.8%、51.1%、59.6%,特异度分别为57.7%、75.6%、68.2%。根据各自的最佳截断值将患者分为低值组和高值组,分析各指标与临床特征的关系,发现NLR 高值组有较大的肿瘤直径,SIRI 的升高与肿瘤直径、T 分期、腺外侵犯情况有关,而SII与肿瘤侵袭性特征无关。
本研究应用Logistic 回归模型分析PTC 患者的临床特征和血液指标对颈部淋巴结转移的预测能力,结果发现,年龄、肿瘤直径、SII 均是cN0期PTC 患者颈部淋巴结转移的独立影响因素,并根据分析结果建立预测模型,使用ROC 曲线分析得出此模型可在一定程度上对cN0期PTC 患者颈部淋巴结转移情况进行预测。但其诊断能力尚存在一定局限性,后续研究需进一步纳入大样本、多中心数据以提高预测准确性。PTC 患者预后普遍良好,生存期长,血液指标与肿瘤预后及复发的相关性需要大样本长期随访以进一步探究。

