乳腺癌合并间质性肺疾病患者的临床特征及治疗情况
王环,李惠平,宋国红,邸立军,邵彬,姜晗昉,梁旭,严颖,张如艳,冉然,张嘉扬,刘雅昕,刘笑然,王晶
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100000
OncolProg,2024,22(3)
间质性肺疾病(interstitial lung disease,ILD)是以弥漫性肺实质、肺泡炎和间质纤维化为基本病理改变,以活动性呼吸困难、X 线胸片示双肺弥漫阴影、限制性通气障碍、肺弥散功能降低和低氧血症为临床表现的不同疾病群构成的病理实体的总称[1]。ILD 的病因错综复杂,化疗、放疗及靶向治疗是病因之一。药物引起ILD 的诊断比较困难[2],需排除器质性病变,严重者常合并呼吸衰竭,危及患者生命,因此一旦确诊应及时干预。本研究对乳腺癌患者经抗肿瘤药物治疗后发生ILD 的临床特征及治疗情况进行分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2015 年9 月至2021 年12 月北京大学肿瘤医院收治的乳腺癌合并ILD 患者的病历资料。纳入标准:①经组织病理学或细胞学检查确诊为乳腺癌。②使用过抗肿瘤药物,并且停药后症状好转。③ILD 临床症状主要为咳嗽、呼吸困难,部分患者伴发热(﹤38.5 ℃);肺部听诊呼吸音增粗或存在小爆裂音;胸部CT 多表现为双肺对称性分布、弥漫性磨玻璃影,可伴或不伴有絮状影、条索影;肺功能检查一般表现为肺限制性通气障碍、低氧血症及一氧化碳弥散能力下降。排除标准:肺部感染、肿瘤进展、肺栓塞、心力衰竭及放射性肺炎等临床表现类似的疾病,及其他原因导致的ILD[2]。依据纳入与排除标准,本研究共纳入76 例乳腺癌合并ILD 患者,年龄36~72 岁,中位年龄61.9 岁,年龄﹤60 岁46 例,≥60 岁30 例;早期乳腺癌6 例,进展期乳腺癌70 例;Luminal A 型18 例,Luminal B 型[人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性]27 例,Luminal B 型(HER2 阳性)12 例,三阴性乳腺癌14例,HER2 过表达型5 例;肺转移32 例,其他部位转移38 例。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 资料收集
收集76 例乳腺癌合并ILD 患者的病历资料,包括患者年龄、Luminal 分型、肿瘤分期、不良事件通用术语标准(common terminology criteria for adverse event,CTCAE)分级、临床表现、治疗方法、检查结果、ILD 发生及治愈情况等。
2 结果
2.1 临床症状及体征
76 例乳腺癌合并ILD 患者中,9 例(11.8%)乳腺癌合并ILD 患者无明显临床症状(完善评效检查发现),其余67 例(88.2%)患者均有临床症状,主要表现为胸闷、憋气、咳嗽、乏力、低热等,其中41 例(53.9%)患者存在单一症状,26 例(34.2%)患者存在2 种及以上症状。
76 例乳腺癌合并ILD 患者的体征无明显特异性,其中9 例(11.8%)患者双肺底可闻及干啰音,其余67 例患者双肺未闻及异常。
2.2 检查结果
76 例乳腺癌合并ILD 患者行胸部CT 检查,均呈现不同程度的间质改变,其中44 例(57.9%)患者可见双肺或单侧肺纹理增粗,不规则片絮影;25例(32.9%)患者主要表现为多发磨玻璃影或不规则实变影;7 例(9.2%)患者双肺纹理明显增重、模糊,可见弥漫条索影。
76 例乳腺癌合并ILD 患者在出现呼吸系统疾病症状或行胸部CT 检查发现ILD 时,同时进行了病原学检测,排除了病毒或细菌等所致的肺部感染。其中,52 例(68.4%)患者因憋气进行了血气分析,大部分患者表现为不同程度的低氧血症[60 mmHg(1 mmHg=0.133 kPa)≤动脉血氧分压(arterial partial pressure of oxygen,PaO2)﹤90 mmHg]和Ⅰ型呼吸衰竭[PaO2﹤60 mmHg,动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)﹤45 mmHg],少见Ⅱ型呼吸衰竭(PaO2﹤60 mmHg,PaCO2﹥50 mmHg),其中34 例(44.7%)患者存在低氧血症,16 例(21.1%)患者合并Ⅰ型呼吸衰竭,2 例(2.6%)患者存在多发肺转移合并Ⅱ型呼吸衰竭。
2.3 抗肿瘤药物的使用、ILD 的发生及治愈情况
76 例乳腺癌合并ILD 患者中,早期乳腺癌6 例(7.9%),进展期乳腺癌70 例(92.1%);存在肺转移32 例(42.1%),发生ILD 时间27~1431 天,中位时间82.5 天;接受系统性化疗46 例(60.5%),其中紫杉类药物27 例(35.5%)[多西他赛17 例(22.4%)、紫杉醇9 例(11.8%)、白蛋白紫杉醇1 例(1.3%)]、吉西他滨6 例(7.9%)、长春瑞滨5 例(6.6%)、卡培他滨3 例(3.9%)、表柔比星+环磷酰胺3 例(3.9%)、多柔比星脂质体1 例(1.3%)、依托泊苷1 例(1.3%),靶向药物27 例(35.5%),其中雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)抑制剂依维莫司20 例(26.3%)、周期蛋白依赖性激酶(cyclin dependent kinase,CDK)4/6 抑制剂5 例(6.6%)[阿贝西利2 例(2.6%)、哌柏西利3 例(3.9%)]、曲妥珠单抗2 例(2.6%),恩美曲妥珠单抗2 例(2.6%),内分泌药物氟维司群1 例(1.3%);紫杉类药物ILD 发生情况最多,ILD 发生时间20~260天,中位时间82 天;靶向药物中依维莫司ILD 发生情况最多,ILD 发生时间10~234 天,中位时间89天;内分泌药物ILD发生情况最少。(表1)

表1 抗肿瘤药物的使用、ILD 的发生及治愈情况
2.4 治疗情况
76 例乳腺癌患者均通过胸部CT 检查发现合并ILD,9 例患者CTCAE 分级为1 级,因其无临床症状未行特殊治疗,密切观察病情,其中8 例患者停止原方案治疗,1 例患者口服依维莫司过程中行胸部CT 检查考虑间质改变(图1A、图1B),暂停依维莫司治疗;2 周后复查胸部CT 结果提示右肺上叶多发不规则片絮状影密度减低、消失(图1C、图1D),继续口服依维莫司治疗;每2 周复查胸部CT结果提示病情稳定,未见间质性改变加重。9 例CTCAE 1 级患者的ILD 治愈时间7~21 天,中位治愈时间11 天。
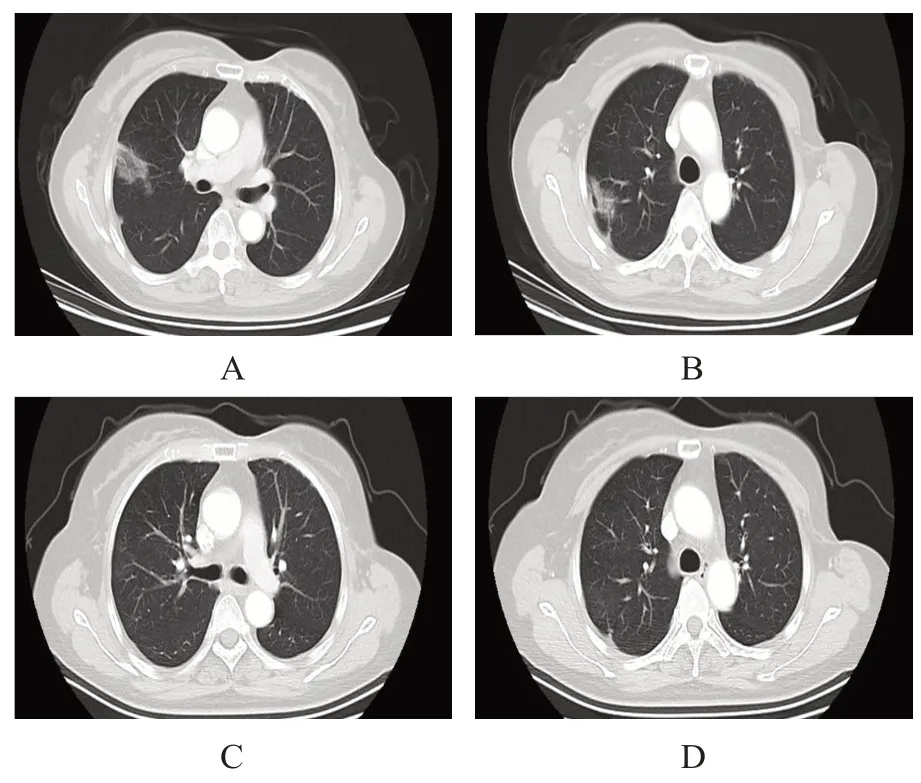
图1 CTCAE分级为1级乳腺癌合并ILD患者的胸部CT检查结果
76 例乳腺癌合并ILD 患者中,67 例患者出现ILD 后立即停止使用抗肿瘤药物,其中59 例CTCAE 分级为2 级(图2),均给予静脉滴注甲泼尼龙或者口服醋酸泼尼松片0.5~1.0 mg/(kg·d),32例患者同时口服或静脉滴注抗生素治疗,ILD 治愈时间19~93 天,中位治愈时间42 天。
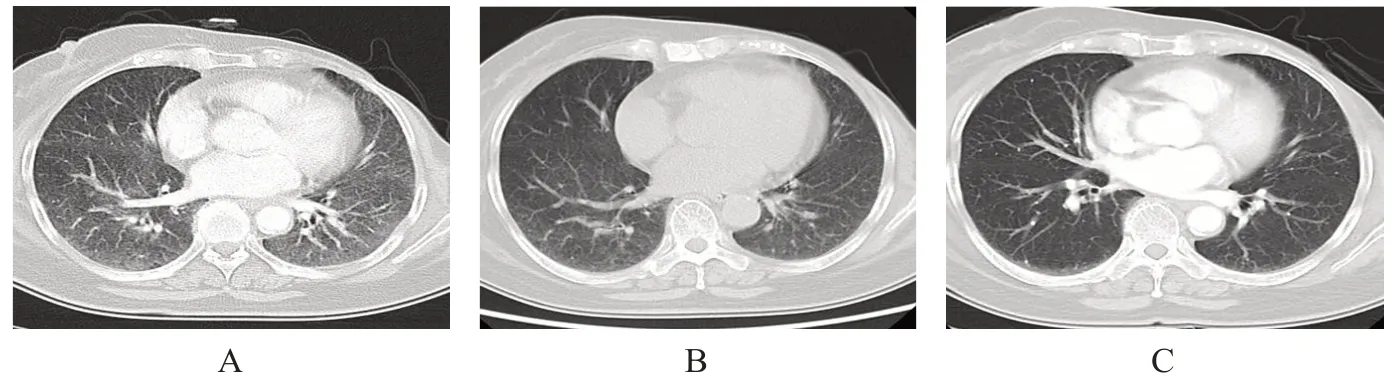
图2 CTCAE分级为2级乳腺癌合并ILD患者的胸部CT检查结果
76 例乳腺癌合并ILD 患者中,8 例患者CTCAE分级为3级(图3),给予吸氧、止咳等对症治疗,采用糖皮质激素治疗,静脉滴注甲泼尼龙1~2 mg/(kg·d),并根据病情逐渐减量,之后改为口服醋酸泼尼松片0.5~1.0 mg/(kg·d)治疗,治疗1个月症状缓解后每2周减量10 mg,从20 mg开始,每周减少5 mg直至停药,ILD治愈时间37~179天,中位治愈时间57天。

图3 CTCAE分级为3级乳腺癌合并ILD患者的胸部CT检查结果
76 例乳腺癌合并ILD 患者经过0.25~3.00 个月积极治疗后ILD 情况均明显好转,复查胸部CT 显示病变明显吸收。
3 讨论
ILD 属于抗肿瘤药物导致的严重不良事件,可发生于抗肿瘤治疗期间或治疗后。在治疗过程中发生ILD 后中断治疗,对于早期乳腺癌患者可能会延迟手术,对于晚期乳腺癌患者可能会影响患者预后[3]。
药物所致ILD 是指由不同机制的药物引起的弥漫性肺疾病,具有多样化的临床表现及特征,其中以肺泡、肺间质和肺小血管的炎症和纤维化为主要临床表现[4]。不同药物引起ILD 的发病情况不同,多数药物的剂量、疗程和肺毒性之间缺乏必然的联系,因此在临床治疗的决策中,药物的选择以及定期进行胸部CT 检查至关重要[5-6]。乳腺癌治疗药物所致ILD 的发生率为10%~20%,包括化疗药物、靶向药物、内分泌治疗药物、免疫治疗药物等[7-9]。
本研究中,所有患者发病初期化验检查排除了感染及其他因素,均为化疗、内分泌治疗及靶向治疗过程中出现肺间质改变,因此考虑与抗肿瘤药物相关。引起ILD 的药物主要以化疗和靶向药物为主,化疗药物中主要以紫杉类、吉西他滨化疗药物为主,而紫杉类中以多西他赛为主,分析原因可能为多西他赛对肺的损伤具有剂量依赖性,同时与其他化疗药物联用时,多西他赛导致的肺损伤风险增加。另外,吉西他滨导致的间质性肺改变也较常见。本研究中吉西他滨引起ILD 的时间为22~112 天,中位时间46 天,考虑其危险因素为合并基础肺疾病、联合其他化疗方案及胸部放疗史,与相关临床研究结果一致[10-13]。内分泌治疗一直是HR(+)乳腺癌治疗的重要基石;近年来,以CDK4/6 抑制剂、磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)抑制剂、组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂、抗体偶联药物(antibody-drug conjugate,ADC)、免疫检查点抑制剂等为代表的新型抗肿瘤药物给HR(+)晚期乳腺癌患者带来更多选择和更长的生存时间。BOLERO-2 随机Ⅲ期临床研究[14]表明,与安慰剂组相比,依维莫司组的中位无进展生存期明显延长了6 个月,依维莫司的推荐起始剂量为每日口服10 mg;ILD 的发生率为12%,其中2%的患者CTCAE 分级为3 级,未发生4 级不良事件。TAMRAD 研究[15]表明,ILD 的总发生率为17%,其中2%的患者CTCAE 分级为3 或4 级。本研究使用依维莫司的起始剂量为5 mg,仍有部分患者出现ILD,但大多患者CTCAE 分级为2~3 级,经过积极对症治疗后好转,未发生4 级不良事件。
本研究结果显示,2 例阿贝西利治疗后发生ILD 患者中,1 例CTCAE 分级为2 级,1 例CTCAE分级为3 级,其中1 例合并严重肺转移、Ⅱ型呼吸衰竭;3 例哌柏西利治疗后发生ILD 患者中,2 例CTCAE 分级为2 级,1 例CTCAE 分级为1 级的患者无明显临床症状,治疗至今(3 年余),症状无加重;2 例恩美曲妥珠单抗治疗后发生ILD 患者中,1例CTCAE 分级为1 级,1 例CTCAE 分级为3 级。因此,随着CDK4/6 抑制剂(哌柏西利、阿贝西利等)、ADC(恩美曲妥珠单抗、维迪西妥单抗、戈沙妥珠单抗、德曲妥珠单抗等)被广泛应用于临床,需要密切监测患者胸部CT[16-17]。
本研究总结关于乳腺癌患者使用抗肿瘤药物导致的ILD 的治疗原则:对于无症状、胸部CT 提示间质性改变的患者(CTCAE 1 级)不需要特殊处理,根据实际情况可酌情继续原方案治疗,定期复查胸部CT,密切观察病情变化;对于呼吸道症状轻微、影像学及肺功能轻度异常患者(CTCAE 2级),首先停用相关的抗肿瘤药物,予以静脉滴注或口服激素治疗,病情缓解后逐渐减量,疗程2~4周,酌情联用抗生素治疗;对于呼吸困难明显或影像学表现较重的患者(CTCAE 3 级),建议静脉滴注激素治疗,逐渐减量;激素治疗同时应预防性使用抗肺孢子菌肺炎及真菌感染的药物;对于年龄较大的患者需慎重选择治疗方式,激素减量时要适当减慢速度,同时预防并发症。
邵彬等[18]在2020 年发表的《乳腺癌治疗相关肺损伤诊治共识》中描述了肺损伤的诊断、治疗标准。但对于抗肿瘤药物所致的ILD,目前尚缺乏国际共识及指南。因此,掌握抗肿瘤药物引起ILD 的临床特征及治疗方法,并有针对性地为乳腺癌合并ILD 患者选择适宜的治疗方案,既可以增加药物疗效,也可以减少药物的不良反应,改善患者预后。

