补肾宁心方治疗绝经后骨质疏松症临床观察 *
雷海燕 钟发明 杜 薇
(1.江西中医药大学附属医院干部保健办公室,江西 南昌 330006;2.江西中医药大学附属医院脊柱骨科,江西 南昌 330006)
由雌激素缺乏引起的绝经后骨质疏松症(Postmenopausal osteoporosis,PMOP)是一种骨代谢性疾病,不仅是诱发女性衰老和残疾的主要原因之一,也是全球公共卫生负担的来源之一[1]。流行病学调查[2]显示,超过30%的绝经期女性患有骨质疏松症。目前临床常用药物治疗周期长、患者依从性差,导致不良反应、骨密度持续进行性降低、骨折风险增加和治疗费用增高[3,4]。因此,探索规范、有效的PMOP 防治方案已经成为临床诊疗的主要研究方向。PMOP 归属于中医学“骨痿”等范畴,肾藏精,主骨生髓,肾精亏虚则骨痿。作者通过多年临床观察发现,PMOP 患者多属心肾不交,符合“心不静则肾不实”理论,基于“肾藏精”藏象理论,应用补肾宁心方治疗PMOP 患者。本次研究基于“肾藏精”藏象理论,旨在探究传统中药方剂补肾宁心方对PMOP患者的临床疗效及作用机制,现报道如下。
1 资料与方法
1.1 一般资料选取2018 年1 月—2019 年12 月在江西中医药大学附属医院骨科门诊或住院部确诊为PMOP 并治疗的120 例患者。按随机数字表法分为观察组63 例、对照组57 例,年龄62~88 岁,平均年龄(76.3±7.6)岁。对照组:年龄60~88 岁,平均年龄(75.21±7.7)岁;平均身高(156.50±5.13)cm;平均体质量(57.26±7.76)kg。观察组:年龄62~88 岁,平均年龄(77.24±7.4)岁;平均身高(155.92±5.42)cm;平均体质量(56.80±7.13)kg。两组患者一般资料比较差异均无统计学意义(P>0.05),具有可比性。该研究已得到江西中医药大学附属医院伦理审查委员会的批准。
1.2 入选标准
1.2.1 纳入标准(1)符合PMOP 的西医诊断标准[5]:骨密度(BMD)值标准差<2.5 且停经>1 年。(2)符合《绝经后骨质疏松症(骨痿)中医药诊疗指南(2019 年版)》[6]中有关PMOP的中医诊断标准。(3)随访时间≥6 个月。(4)患者资料完整且依从性良好,所有患者均签署知情同意书。
1.2.2 排除标准(1)合并严重器质性病变;(2)有长期服用激素类药物;(3)伴有严重内科疾病;(4)合并新鲜的压缩性椎体骨折(压缩高度>1/3以上)。
1.3 治疗方法参考2010 年版《绝经后骨质疏松症(骨痿)中医药诊疗指南(2019 年版)》[6]制定诊疗计划。
1.3.1 对照组基础治疗:阿法骨化醇片(0.5 μg,重庆药友制药有限责任公司,国药准字H10950134)口服,每次0.5 μg,每天1 次;阿仑膦酸钠片(70 mg,杭州默沙东制药有限公司,注册证号H20160100)口服,每次70 mg,每周1 次,服用3 个月;结合运动疗法(步行,每次30 min,每周3~5次)。
1.3.2 观察组补肾宁心方联合基础治疗。补肾宁心方药物组成:补骨脂、熟地黄各15 g,菟丝子、当归尾、山萸肉、独活、杜仲、肉苁蓉、没药、枸杞子、茯苓、合欢皮、牡丹皮各10 g,莲子心5 g。以上中药均为颗粒剂,开水150 mL 饭后冲服,早晚各1 次,连续服用3 个月。基础治疗同前。
1.4 观察指标
1.4.1 BMD治疗前后分别采用全身双能X 射线骨密度仪(韩国OSTEOSYS公司,型号:PRIMUS)检测两组患者腰椎及髋部的BMD。
1.4.2 骨代谢指标治疗前后采集两组患者空腹静脉血5 mL,离心待检。采用电化学发光免疫分析法(ECLIA)测定骨代谢指标水平:骨钙素(BGP)、Ⅰ型前胶原氨基端原肽(PINP)、血清Ⅰ型胶原羧基端交联肽原(β-CTX)。
1.4.3 炎症指标于治疗前后采集两组空腹静脉血5 mL,离心待检。采用酶联免疫法测定高敏C-反应蛋白(hs-CRP)、趋化因子(CCL3)和胰岛素样生长因子结合蛋白(IGFBP-3)水平。
1.4.4 临床疗效根据《中医病证诊断疗效标准》[7]评定标准评定,BMD 的T 值增加率(T%)=(治疗后T 值-治疗前T 值)/治疗前T 值。显效:T%≥1/3 且胸腰背疼痛消失;有效:1/6≤T%<1/3 且胸腰背疼痛明显缓解;无效:T%<1/6,胸腰背疼痛未缓解。总有效率=(显效+有效)例数/总例数×100%。
1.5 统计学方法用SPSS 26.0 进行统计分析。计量资料用(±s)表示,使用t检验;计数资料用率(%)表示,采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 腰椎及髋部BMD与治疗前相比,治疗后,两组患者的BMD 均显著增加(P<0.05);与对照组相比,观察组患者BMD增加更为显著(P<0.05)。见表1。
表1 两组PMOP患者腰椎及髋部BMD比较(±s,g/cm3)

表1 两组PMOP患者腰椎及髋部BMD比较(±s,g/cm3)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
组别对照组髋部0.59±0.01 0.62±0.081)0.58±0.02 0.68±0.031)2)例数57观察组63时间治疗前治疗后治疗前治疗后腰椎0.70±0.02 0.88±0.031)0.69±0.07 0.98±0.051)2)
2.2 骨代谢指标与治疗前相比,治疗后,两组患者血清中BGP、PINP水平均显著增加,β-CTX 水平均显著下降(P<0.05);观察组相应指标均较对照组改善更为显著(P<0.05)。见表2。
表2 两组PMOP患者治疗前后血清骨代谢指标比较(±s)

表2 两组PMOP患者治疗前后血清骨代谢指标比较(±s)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
β-CTX/(pg/mL)438.72±158.22 344.82±150.841)317.88±136.43 234.72±148.611)2)组别对照组例数57观察组63时间治疗前治疗后治疗前治疗后PINP/(ng/mL)50.82±27.52 53.11±22.411)51.84±17.24 57.38±36.391)2)BGP/(ng/mL)3.25±0.20 3.77±0.241)3.22±0.24 4.51±0.211)2)
2.3 炎症指标与治疗前相比,两组患者治疗后血清中hs-CRP、CCL3 含量均显著下降,IGFBP-3 含量均显著增加(P<0.05);观察组相应指标均较对照组改善更为显著(P<0.05)。见表3。
表3 两组PMOP患者治疗前后血清炎症指标比较(±s)
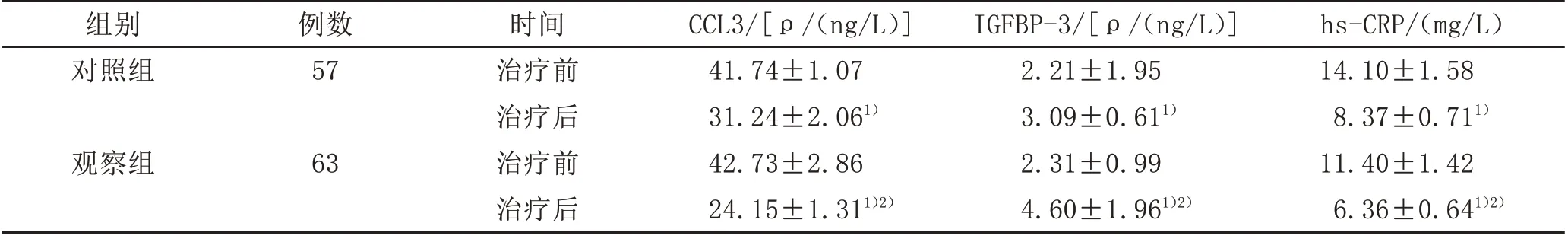
表3 两组PMOP患者治疗前后血清炎症指标比较(±s)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
hs-CRP/(mg/L)14.10±1.58 8.37±0.711)11.40±1.42 6.36±0.641)2)组别对照组例数57观察组63时间治疗前治疗后治疗前治疗后CCL3/[ρ/(ng/L)]41.74±1.07 31.24±2.061)42.73±2.86 24.15±1.311)2)IGFBP-3/[ρ/(ng/L)]2.21±1.95 3.09±0.611)2.31±0.99 4.60±1.961)2)
2.4 临床疗效观察组总有效率为80.95%(51/63),显著高于对照组的64.91%(37/57),差异有统计学意义(x2=3.937,P=0.047)。见表4。

表4 两组PMOP患者临床疗效比较[例(%)]
3 讨论
PMOP 是一种与衰老有关的常见病,其并发症等严重地影响老年人的身体健康和生活质量,甚至导致寿命缩短。其治疗以激素替代疗法以及双磷酸盐、甲状旁腺素等药物为主[2]。中医药在治疗老年性疾病方面具备多靶点、多系统及整体诊治的特有优势。不仅促进西药的吸收,缩短治疗周期,还可以产生增效协同的作用。PMOP 归属中医学“骨痿”“骨痹”等范畴,其病机为心肾不交[8]。补肾宁心方具有补益肝肾、强壮筋骨、宁心安神之功,被广泛应用于骨科筋骨病、老年代谢性疾病等研究中[9]。
女性绝经后骨代谢水平呈高转换状态,PINP、β-CTX和BGP 等骨代谢标志物,有利于动态反映PMOP 的病理生理状况及骨丢失的速率[10]。本研究结果表明,补肾宁心方治疗后,患者BGP、PINP水平提高,β-CTX 水平降低,腰椎及髋部BMD 增加,提示补肾宁心方显著改善PMOP 患者的骨代谢水平,促进骨生成,抑制骨吸收。究其原因,现代药理研究[11]表明,方中菟丝子、肉苁蓉、补骨脂等中药提取物通过多种信号途径提高成骨细胞的活性,减少破骨细胞的合成,改善其骨代谢和骨组织结构,进一步说明补肾活血汤治疗PMOP 的特点,充分体现中医药治疗疾病的特色及优势。
另外,临床研究[12]表明,血清hs-CRP、CCL3、IGFBP-3 与围绝经期患者骨代谢水平和骨组织结构直接相关。根据此次研究结果,补肾宁心方治疗后IGFBP-3水平提高,hs-CRP、CCL3 水平降低,提示补肾宁心方显著改善PMOP 患者的炎症指标水平。相关报道[13]显示,随着PMOP 患者BMD 下降,BGP、PINP、IGFBP-3表达显著降低,β-CTX、CCL3、hs-CRP 表达显著升高。这与本研究结果一致。
综上所述,本研究明确了补肾宁心方治疗PMOP 可提高临床效果,改善患者BMD,可能通过抑制骨吸收、加快骨形成以及抑制炎症反应发挥作用。

