退役锂电池带电破碎安全风险研究进展*
何佰玫,何昕阳,陈俊冬,王建波
(1.西南科技大学 环境与资源学院,四川 绵阳 621010;2.固体废物处理与资源化教育部重点实验室,四川 绵阳 621010)
0 引言
1985年Akira Yoshino基于John Goodenough对可嵌入锂离子阴极的研究成果,创造了第一个商业上可行的锂离子电池[1],也创造了一个可重复充电的世界,从而使无化石燃料的社会成为可能。1991年,锂离子电池首次进入市场[2],从此极大改变了人们的生活。目前,锂电池作为人类摆脱传统能源约束的重要突破口,已被广泛用于消费电子、航空航天、大型储能、新能源汽车等领域[3]。国务院发布的《新能源汽车产业发展规划(2021-2035年)》提出,至2035年,我国新能源汽车市场渗透率将从2021年的13.4%提升到20%[4]。然而我国新能源产业在快速发展的同时,也面临着巨大的资源和环境压力,作为新能源汽车的“心脏”——锂电池一般在使用5~8 a后进入退役期,据中国汽车技术研究中心测算,至2022年动力电池累计退役量达88 GW·h,相当于约176万辆电动汽车的装车量,大规模退役锂电池的处置问题亟待解决。
目前已有许多学者针对锂电池回收问题进行了深入研究,退役锂电池经前处理环节获得纯净的正极粉末后[5-12],有价金属以离子态或化合态从正极粉末中分离[13-19],再通过富集纯化再生为锂电池原料[20-22]。退役锂电池必须经过稳定化消除其残余电能,才能杜绝在后续回收过程中发生燃爆,锂电池稳定化技术对于整个回收流程的安全至关重要。
退役锂电池的稳定化技术包括盐溶液放电、电子负载放电和导电粉末放电[23]。盐溶液放电相较于电子负载放电和导电粉末放电不存在电压反弹和电极熔断虚假放电的缺陷[24],氯盐[25]和硫酸盐[26-27]溶液体系均有较好的放电效果,但存在放电时间长、产生大量废水使后续处理成本增加、电解液泄露产生有毒含氟废气等问题,在处理效率、避免二次污染等方面仍存在明显不足。因此为实现高效放电、降低环境污染风险、保证后续回收的安全,探索更为先进的稳定化技术极具现实意义。
除将放电作为单独的工艺环节外,另一种稳定化技术是在破碎电池过程中消除残余电压[28],从而减少二次污染、提高工艺效率、缩短工艺流程。带电破碎工艺分为3种途径:湿式破碎、低温破碎和气体保护破碎,现有研究对带电破碎装置的完善和控制参数的确立起到了极大的推动作用,但从带电破碎的核心问题——燃爆风险的角度来看,现有研究并未就燃爆发生的影响因素及控制手段进行深入分析。
因此,为了全面明晰锂电池在带电破碎过程中由于机械破坏导致的燃爆风险,并对此类问题的防控提供解决思路,本文系统总结了带电破碎工艺路线,全面综述了不同工艺的研究现状,并从燃烧和爆炸必须具备的三要素(可燃物、助燃剂、点火源)出发,详尽分析了带电破碎过程中燃爆的影响因素及规律,并针对性地探讨了安全控制策略。
1 带电破碎工艺路线
1.1 湿式破碎
湿式破碎是利用盐溶液辅助放电、降温、绝氧。常用的方法是在破碎过程中喷淋溶液[29-31],为减少溶液用量和废水产量,通常会设置溶液循环回流系统[30],其中适宜的喷淋溶液回流比为(0.1~0 .5) ∶1[31]。除在破碎过程中喷淋溶液外,有研究提出在破碎完成后立即将锂电池破碎物料沉入水槽浸泡[32]或者在输送锂电池破碎物料的过程中喷淋水雾[33],此时喷淋溶液仅起到了降温作用。另外,有研究者设计了一种浸没在溶液内的破碎装置,使破碎腔内液面始终维持在一定水位来密封进料口[34],破碎后的电池碎料通过捞渣机收集[35];破碎腔中的溶液可以是H2O、Na2CO3、NaHCO3、NaCl、KCl、Na2SO4中的一种或多种,用于溶解废锂电池中的氟化物及有机溶剂[36]。为了提高安全性,湿法破碎可以在惰性气体保护下进行[37-38],破碎完成后在60~200 ℃下干燥0.1~5 h,气体和液体经冷凝后分别净化再进行排放和回流[38]。湿式破碎存在以下问题:破碎过程中产生的HF不可避免地会对设备造成腐蚀,破碎后在浆料中收集破碎物料时会造成损耗,破碎后必要的物料干燥工序会增加工艺流程。
1.2 低温破碎
低温破碎是通过降温来降低电池反应活性,防止破碎过程中发生燃爆。在破碎前冷冻电池是其途径之一[39-41]。有研究通过使用半导体制冷片和液氮在破碎前完成了两级冷冻[40],如TOXCO公司就是利用液氮将电池冷冻至-196 ℃再进行破碎[41]。在破碎中用液氮进行降温也是其途径之一[42-45],使破碎机内形成低温无氧区[43],其间产生的气体被泵吸排,在控制氧气浓度的同时带走部分热量[44-45]。除液氮以外,干冰也是实现低温破碎的可行辅助物。退役锂电池与干冰以质量比1∶(1~10)混合破碎后,调控体系的温度至40~60 ℃、压力至10~40 MPa进行固液分离,得到退役锂电池粗碎颗粒和富有电解液的溶液[46]。低温破碎可以有效遏制燃爆发生,然而由于成本过高,其工业应用的可行性较低。
1.3 气体保护破碎
气体保护破碎是利用某些气体消耗链式反应中的自由基,从而阻止链传递来防止燃爆发生,另外这些气体的存在还降低了氧气浓度和温度,消除了燃爆发生的条件。现有研究对气体保护破碎的物料输送、密封[47-48]、自动化[49]、均匀布气[50]等装置均有涉及。气体保护破碎参数设置见表1。气体保护破碎可以缩短工艺流程、降低运行成本,且后续可直接进行电解液挥发和PVDF热解,不需要额外干燥,但其控温能力相对于湿法破碎和低温破碎较差。
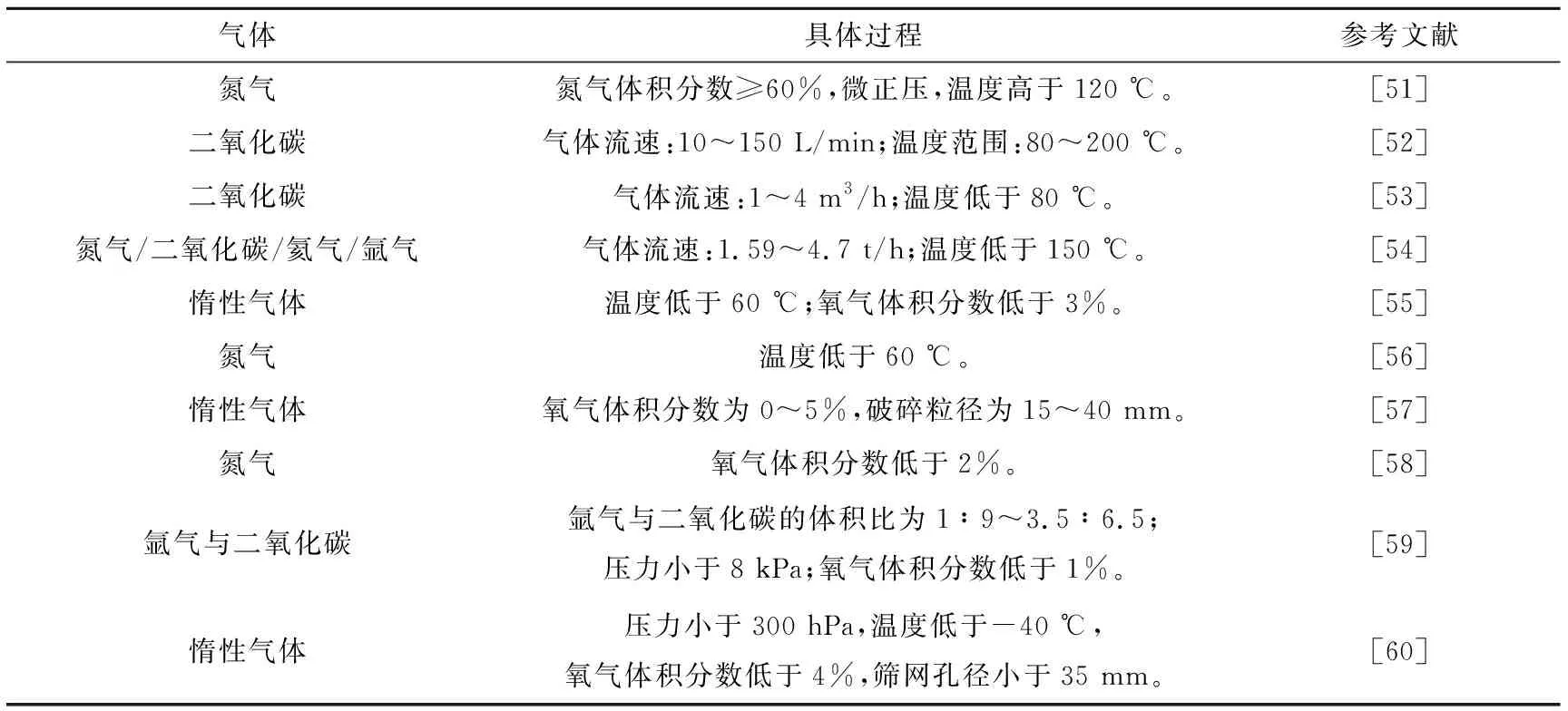
表1 气体保护破碎参数设置
大多数带电破碎研究虽对温度和氧气浓度进行了控制,但其数值范围相差较大,且未对与燃爆相关的影响因素进行深入研究,因此本文将以带电破碎过程中产生的可燃物、助燃剂、点火源为切入点,探讨燃爆发生的影响因素及规律。
2 可燃物
锂电池释放可燃气体的过程中涉及了热失控问题,热失控的原因大致分为3类:机械作用(穿刺挤压)、过充过放和过热(见图1)。虽然造成热失控的途径众多,但所有热失控的发生都有一个共同点——达到一定温度条件[61]。
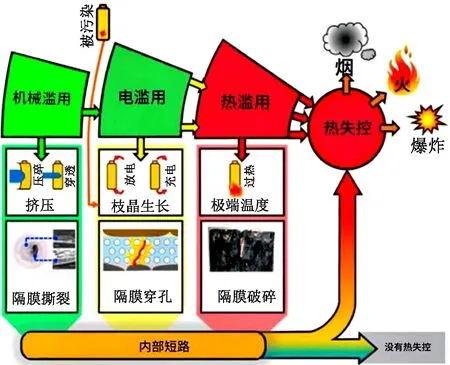
图1 锂电池热失控途径[61]
锂电池在带电破碎过程中,大多是由于机械作用导致内短路发生,在破碎过程中产生的热量使温度升高,待温度到达一定值后会释放气体,当所释放的可燃气体在有氧环境中达到一定浓度时,就会有发生燃烧和爆炸的风险,因此厘清锂电池在破碎过程中释放的气体组分、各组分浓度、气体总量对带电破碎的安全性至关重要,表2展示了部分锂电池热失控释放气体研究成果。
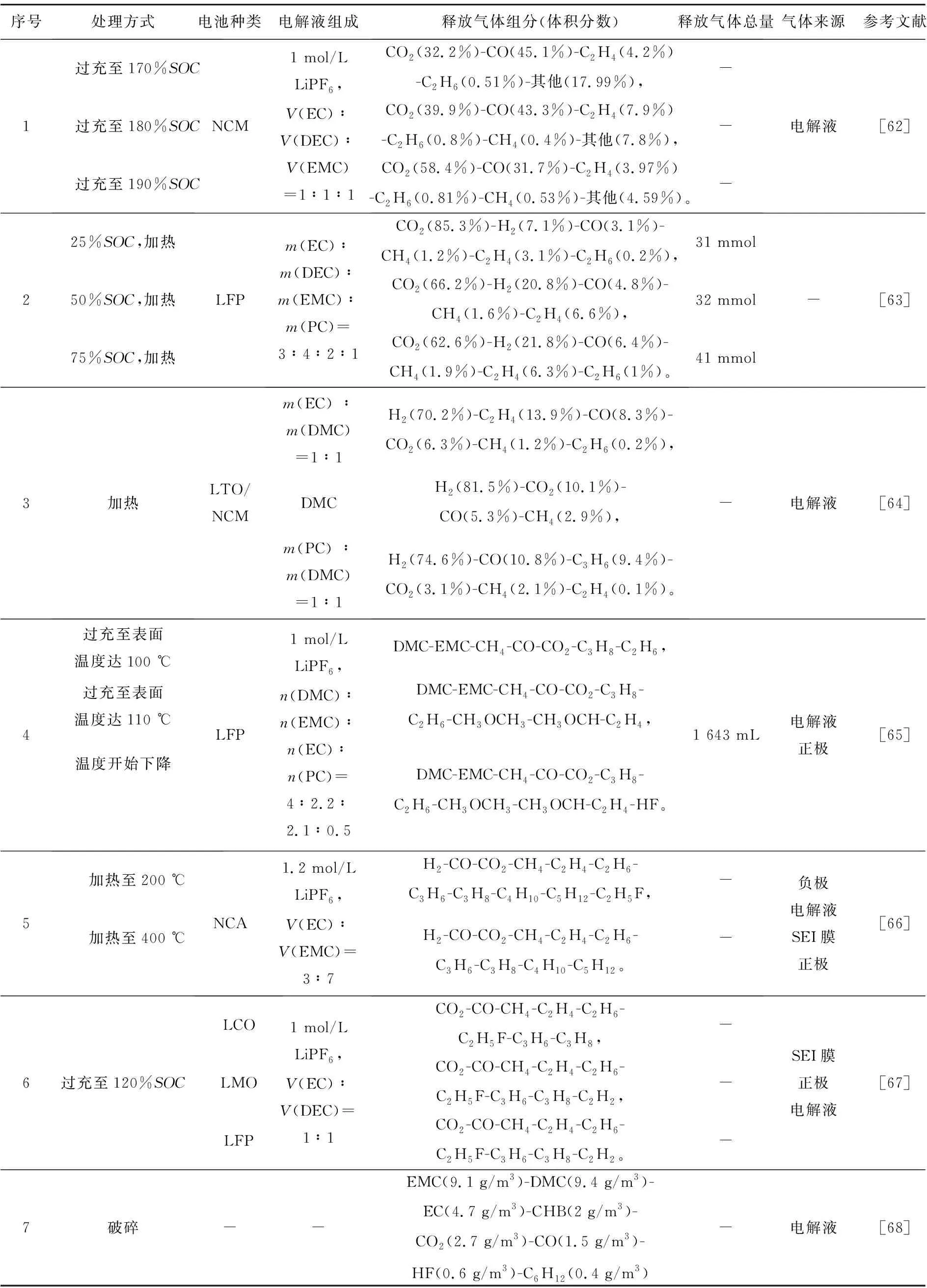
表2 部分锂电池热失控释放气体研究成果
在整个热失控过程中,电解液参与了绝大多数产热产气反应,温度对反应发生的程度或阶段有较大影响。从表2中可以看出,电解液、温度、SOC、正极材料与锂电池产气均有一定关联,因此有必要研究上述因素对锂电池产生可燃气体的影响。
2.1 电解液的影响
2.1.1 有机溶剂对产气种类的影响
锂电池热失控释放气体的来源为电解液,为了明确电解液的影响程度,有学者对比了DMC、EMC热解释放的气体和由DMC、EMC组成电解液的锂电池过充释放的气体,发现气体种类一致,其区别仅在于气体组分的占比不同。
在热失控过程中,电解液中的线性碳酸酯和环状碳酸酯由于结构不同导致性质各异,在分解过程中,线性碳酸酯倾向于产生烷烃气体,而环状碳酸酯倾向于产生烯烃气体。DMC和PC的特征气体分别是CH4和C3H6,当电解液中存在DEC时产生C2H6较多,而存在EC时产生C2H4较多[64]。
DEC和EC[69-70]产生特征气体C2H6和C2H4的反应式为
DEC+2Li++2e-+H2→Li2CO3+2C2H6↑,
(1)
(2)
EC+2Li++2e-→Li2CO3+C2H4↑,
(3)
2EC+2Li++2e-→(CH2OCO2Li)2+C2H4↑。
(4)
YOSHIDA等[70]通过分析热失控过程发生的反应,发现EMC在一定情况下会与DMC和DEC相互转化。
2EMC↔DMC+DEC。
(5)
有学者在180 ℃、30 min条件下检测到了式(5)所示的酯交换反应,但DEC与DMC产生量之比总是大于理论上的1∶1,推测是由于DMC活性比DEC更强,参与了更多的热分解反应而被消耗了。
SHIN等[69]佐证了DMC除了产生特征气体CH4外,还会产生C2H6和C3H8。
3DMC+2Li++2e-+7H2→Li2CO3↓+8CH4↑,
(6)
2DMC+2Li++2e-+5H2→2CH3OLi↓+4CH4↑,
(7)
CH3OCO2CH3+e-+Li+→CH3OCO2Li↓+CH3·,
(8)
CH3OCO2Li+e-+Li+→Li2CO3↓+CH3·,
(9)
(10)
CH3·+CH3·→C2H6↑,
(11)
C2H5OCO2C2H5+e-+Li+→C2H5OCO2Li+C2H5·,
(12)
C2H5OCO2Li+e-+Li+→Li2CO3↓+C2H5·,
(13)
(14)
C2H5·+CH3·→C3H8↑。
(15)
另外在热失控过程中,除分解反应产生的气体外,还伴随着溶剂蒸发形成的蒸气[71],其中大部分蒸气为线性碳酸酯DMC和EMC蒸气,DMC和EMC的体积比约为7∶3,环状酯在180 ℃时产生的蒸气体积仅占气相的0.7%。
2.1.2 有机溶剂对产气量的影响
电解液不仅对产生气体种类有影响,还对气体产生量有影响。ROTH等[72]对5种不同正极相同电解液的锂电池加热至热失控,发现在热逸散峰值(通常为350 ℃)结束时每安时释放的气体体积几乎相同,约为1 200 mL/Ah,这表明释放气体体积与阴极材料关系不大而与电解液密切相关。
WU等[64]对不同电解液[m(EC)∶m(DMC)=1∶1,m(PC)∶m(DMC )=1∶1,m(PC)∶m(DEC)=1∶1,质量均为3.3 g]组装成的LTO/NMC电池在80 ℃下烘烤120 h时产生的气体和造成的电池体积膨胀率进行了研究,发现单一线性碳酸酯DMC、DEC、EMC的膨胀率分别为325%、88%、110%,与上文所提到的酯交换反应和热分解反应有一定关系。EC与DMC组合、PC与DMC组合的膨胀率分别为95%、50%,表明环状碳酸酯对DMC的膨胀率有明显的抑制作用。
2.1.3 锂盐对产气的影响
锂盐在电解液系统中会与衡量水反应生成路易斯酸,从而促进有机溶剂分解,这一过程会降低有机溶剂的热稳定性。ROTH等[72]在EC和EMC电解液体系中改变锂盐摩尔浓度,发现随着锂盐摩尔浓度的升高,初始分解温度从230 ℃降至160 ℃,完全分解温度从270 ℃降至200 ℃;此外,在n(EC)∶n(EMC)=3∶7的溶剂中分别添加0.2、0.6、1.2、1.8 mol/L锂盐,测量产生的气体发现,产气量随着锂盐浓度的升高逐渐增加,但气体组分比例保持不变,说明锂盐在热失控过程中的作用仅是提高电解液反应活性。
2.2 温度的影响
2.2.1 温度对产气种类的影响
温度是锂电池热失控释放可燃气体的最终原因,基于前人研究可将锂电池热失控过程划分为以下3个阶段。
1)第一阶段
在该阶段,SEI膜的分解从57 ℃开始[73],随后失去SEI膜保护的负极LixC6直接与电解液接触并释放气体,LixC6与电解液反应生成的固体物质是构成SEI膜的主要成分[61,74]。同时由于电解液组分中线性碳酸酯的沸点低,电解液在100 ℃左右便开始出现蒸发现象[75]。
有机SEI膜分解反应式[76-77]为
(CH2OCO2Li)2→Li2CO3+C2H4↑+
(16)
LixC6与电解液的反应式[76-79]为
2Li+C3H4O3(EC)→Li2CO3↓+C2H4↑,
(17)
2Li+C4H6O3(PC)→Li2CO3↓+C3H6↑,
(18)
2Li+C5H10O3(DEC)→Li2CO3↓+C4H10↑,
(19)
2Li+C3H6O3(DMC)→Li2CO3↓+C2H6↑,
(20)
2Li+C4H8O3(EMC)→Li2CO3↓+C3H8↑。
(21)
LiPF6与空气中水分接触并生成HF和路易斯酸POF3[63]:
LiPF6+H2O→2HF↑+LiF+POF3,
(22)
POF3+2H2O→POF(OH)2+2HF↑。
(23)
2)第二阶段
在120~250 ℃的温度范围内,SEI膜分解反应和再生反应达到平衡,温和产热[61],直到280 ℃时负极结构崩塌,SEI膜完全分解[80]。
在130 ℃时,隔膜开始熔化使正负极直接接触[79,81],内短路在短时间内释放大量热,极大促进了电池内部反应的发生[76]。
在150~160 ℃时,电解液开始分解产气[66],这是由于锂盐产生的路易斯酸降低了电解液体系的热稳定性。从170 ℃起,LiPF6分解产生PF5[63],进一步促进并参与电解液分解反应,其反应过程[76,78]如下:
LiPF6→LiF+PF5,
(24)
2C4H8O3(EMC)→C3H6O3(DMC)+
C5H10O3(DEC),
(25)
C3H6O3(DMC)+PF5→
CH3OCOOPF4+CH3F↑,
(26)
C5H10O3(DEC)+PF5→C2H5OCOOPF4+C2H5F↑,(27)
C2H5OCOOPF4→POF3+CO2↑+C2H4↑+HF↑,(28)
2C3H6O3(DMC)→CH3OCOO+
CH3OCOOCH2+CH4↑。
(29)
此阶段的升温速率加快[66]。
3)第三阶段
正极材料分解释放氧气,正极的热反应性排序为LCO>NCA>NCM>LMO>LFP[82]。与其他锂离子电池相比,LFP得益于正极(PO4)3-的强P=O键,热稳定性好[83],有学者提出LFP可能发生的析氧反应[84-85]见式(30),但尚未获得验证。
(30)
正极分解反应式为
LiCoO2→xLiCoO2+
(31)
(32)
(33)
(34)
电解液与氧气反应释放二氧化碳和一氧化碳,反应式[61]为
(35)
6O2+C5H10O3(DEC)→5CO2+5H2O,
(36)
3O2+C3H6O3(DMC)→3CO2+3H2O,
(37)
O2+CH6O3(PC)→CO2+3H2O,
(38)
O2+C3H4O3(EC)→3CO+2H2O,
(39)
(40)
(41)
2O2+C4H6O3(PC)→4CO+3H2O。
(42)
该阶段内部各种反应同时进行并相互促进,反应速率快速上升,电池内部温度急剧升高,并高速排出大量气体[66,76,81]。
温度条件决定了锂电池内部化学反应的发生进程,从而直接影响热失控释放气体的种类,不同起始温度下的产气种类见表3。
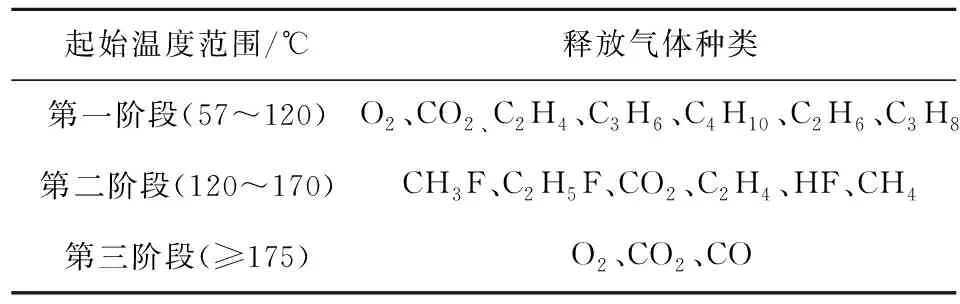
表3 不同起始温度下的产气种类
锂电池遇热温度升高,有研究[73]发现在57 ℃时检测到了SEI膜的分解。SEI膜的组成复杂,主要包括亚稳定成分(CH2OCO2Li)2和稳定成分Li2CO3、LiF[86]。由电解液和LixC6反应形成的固态电解质阻隔了电解液与LixC6的进一步反应,SEI膜分解主要是固体有机电解质(CH2OCO2Li)2分解产生固体无机电解质Li2CO3[73],并产生C2H4、CO2、O2等气体[76-77]。同时,六氟磷酸锂与电池内部痕量水反应生成HF、POF3[63]。
电解液中部分有机溶剂沸点低,在低于100 ℃的条件下有蒸气产生[65],各有机溶剂沸点分别为:DMC,90 ℃;EMC,107 ℃;DEC,126~128 ℃;PC,242 ℃;EC,248 ℃。由于各有机溶剂结构不同,环状碳酸酯较线性碳酸酯热稳定性更好。因此即便是在300 ℃时,环状碳酸酯蒸气体积在电解液蒸气中也仅占2%,而线性碳酸酯(DMC和EMC)蒸气体积占据了电解液蒸气的绝大部分。
随着SEI膜的剥落和温度的升高,LixC6与电解液反应更加剧烈,DSC检测结果显示,在100~300 ℃内均存在LixC6与电解液的反应峰,产生大量CH4、C2H4、C3H6、C4H10、C2H6、C3H8等气体[87]。
在没有LiPF6参与的情况下,有机溶剂的最低分解温度为247 ℃(DMC热分解温度)和 264 ℃(EMC热分解温度),环状碳酸酯初始分解温度为316 ℃(PC热分解温度)和335 ℃(EC热分解温度)。LiPF6的存在极大降低了初始分解温度,170~190 ℃时LiPF6产生的路易斯酸PF5、POF3促使电解液分解,释放的气体包括CH3F、C2H5F、CO2、C2H4、HF[63]。LiPF6对不同有机溶剂的影响存在差异,在LiPF6参与下DEC较DMC更易分解产生C2H4[86]。
电池内部除电解液和负极反应会释放气体外,锂电池正极在一定温度下也会分解释放氧气,不同电极材料分解温度区别较大,LCO分解温度范围在178~250 ℃[88],LMO分解温度约为300 ℃[88],LNO分解温度约为200 ℃[88],NCA分解温度范围在200~300 ℃[89],NCM分解温度范围在175~199 ℃[90],LFP分解温度约为350 ℃[85]。正极分解产生的氧气为电池内部高温产生的可燃气体提供了爆炸发生的必要条件,但具备氧气、高温、可燃气这3个因素不一定会发生燃烧爆炸。电池内部产生的氧气在量上并不足以与所有可燃气体发生反应,张青松等[91]通过对比正极材料的加热分解和相应锂电池发生热失控的氧气释放状况发现,锂电池热失控过程中产生的氧气在剧烈反应时被消耗殆尽。ROTH等[72]研究发现即使最活泼的正极材料释放的氧气量也不足以与全部电解质所释放的可燃气体反应,如NMC分解提供的氧气仅够与5%~15%的电解液反应。
温度达到250~260 ℃后,PVDF开始参与反应产生氢气[92]。
2.2.2 温度对产气浓度的影响
各气体组分的体积分数也会随温度的变化而变化。DMC在180、240、300 ℃三种温度下,CO2占比呈下降趋势,从47%降至35%~42%再降至28%;CH3OCH3和CH3OH占比也呈下降趋势,从32%和19%分别降至24%和7%;但CO和H2占比则分别升至21%和18%。EMC在180、240、300 ℃三种温度下, CO2和C2H5OH占比下降,到240 ℃时,CO2仅占22%;EMC发生的酯交换反应使DEC和DMC占比持续升高,DEC占比为17%,DMC占比约为15%。
ROTH等[66]对NCA加热至不同温度后,发现气体释放的组分一致,而各组分占比不同,随着温度的升高,CO2占比下降,CH4、H2、C2H2占比升高。
气体体积分数的下降并不意味着产生量的减少,事实上CO2、H2、CO、CH4、C2H4和溶剂蒸气量均随温度的升高而增加[67,93-94],其释放的气体总量也随之增加。ABRAHAM等[94]研究发现,锂电池在加热到150 ℃和160 ℃时所释放的气体体积分别为12.5 mL和30.6 mL。
在热失控升温至峰值后,锂电池中参与反应的物质逐渐消耗殆尽;在进入降温阶段后,高沸点的有机溶剂蒸气由于温度低于沸点而重新冷凝进入液相[95]。
2.3 SOC的影响
2.3.1SOC对产气浓度的影响
电解液与LixC6的反应是释放气体的重要来源,而LixC6的多少直接表现在电池残余电量即SOC上。相关研究表明,SOC越大,电池的燃爆风险越高。SOC对各组分浓度的影响见图2。图2中NCA、LFP数据来源于文献[63],LCO数据来源于文献[96],NCM数据来源于文献[81]。由图2可知, CO2、CO、H2、CH4体积分数随着SOC的变化在不同的电池上变化趋势一致,即随着SOC的升高,CO2体积分数降低,CO、H2、CH4体积分数均升高。
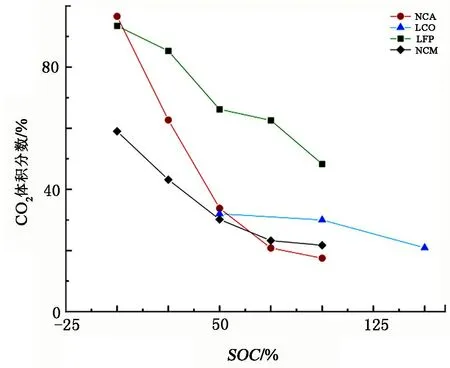
图2 SOC对各产气浓度的影响
对于NCA,随着SOC的升高,CO2从96.6%降至17.5%;对于LFP,随着SOC的升高,CO2体积分数大幅下降。对于NCA,随着SOC的升高,CO体积分数升高的幅度最大,从1%升至44%;对于LFP,随着SOC的升高,CO体积分数升高,但升高的幅度最小,且在各种电池中保持一个相对较低的体积分数,即使在100%SOC时体积分数也仅为9.1%。H2体积分数均在30%以下,NCA和LFP中的H2体积分数随着SOC的升高上升幅度最大。CH4体积分数均在10%以下,变化幅度最大的是NCA;LFP的CH4体积分数相对于其他几种电池较低,在0%SOC~100%SOC区间,CH4体积分数仅从0.7%升至5.4%。
各种电池最显著的相同点是:SOC越高,CO2占比越低,可燃气体总量占比越高,燃爆的风险越高。
2.3.2SOC对产气总量的影响
产气总量与SOC呈现明显的正相关关系[63,81]。在100%SOC条件下,统计了电池释放的气体总量,结果见表4。
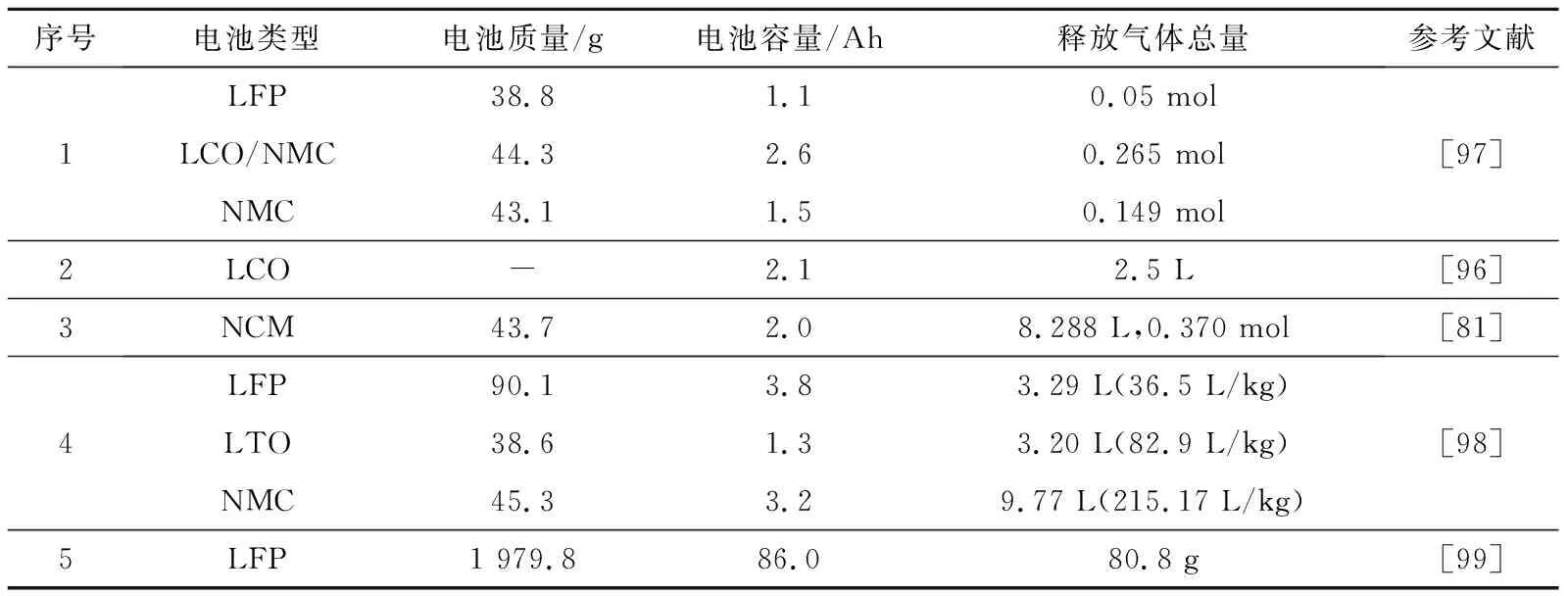
表4 100%SOC条件下不同锂电池产气总量
影响电池热失控产气总量的因素众多,过程复杂,但仍能总结出各产气组分的占比范围:CO2占比在20%~50%,H2占比在20%~30%,CO占比大约在4%~40%[63,81],CO2、H2、CO三种气体占比之和在80%以上,且三者之间不存在显著的此消彼长现象,大多数情况下CO2占比最高;CH4占比在4%~9%,C2H4占比在3%~10%,C2H6占比在2%以下[96-99]。
2.4 可燃物的爆炸极限
2.4.1 热失控生成混合气体的爆炸极限
对于单一组分的可燃气体的爆炸极限已有较多的研究和明确的测量值,但锂电池热失控产生的混合可燃气体,种类繁多、成分复杂,其爆炸极限的确定比较困难。
目前确定锂电池热失控产气的爆炸极限有以下两种方法:
(1)将电解液或热失控气体引入爆炸罐,通过改变分压来控制气体体积分数,为爆炸罐提供一定的热量,发生爆炸时气体的体积分数即为爆炸极限;实验所得不同组分的热失控气体爆炸极限[96,100-101]见图3。

图3 实验所得不同组分的热失控气体爆炸极限
由图3可知,爆炸极限范围最小的为CO2体积分数最高的混合气体,且爆炸下限均高于混合气体中任何单一气体的爆炸下限,说明CO2能有效提高爆炸下限,降低燃爆风险。总结前人实验结果得出,锂电池热失控气体的爆炸下限范围为5%~8%,爆炸上限范围为30%~40%。
(2)通过公式可以计算出混合气体的爆炸极限,最常用的是Le Chatelier或改进的Le Chatelier方程[102](见图4)。由公式计算得到的爆炸极限规律与实验相同,CO2体积分数越高的热失控气体爆炸极限范围越小,爆炸下限越高。通过计算得到热失控气体的爆炸下限在5%~15%,爆炸上限在30%~50%。
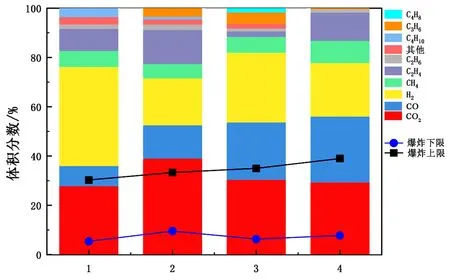
图4 由Le Chatelier计算得到不同组分的热失控气体爆炸极限
Le Chatelier公式[103]可表示为
(43)
式中,LELmix表示混合气体的爆炸下限,LELi表示单一气体的爆炸下限,xi表示气体混合物中一种组分的摩尔分数或体积分数,n表示混合物数量。
由公式计算得到的爆炸极限与SOC的关系[81,103-105]见图5。
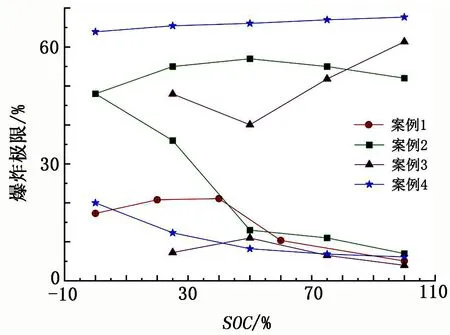
图5 由公式算得的爆炸极限与SOC的关系
但有研究者认为Le Chatelier公式并不能准确反映现实情况,其更适用于烃类气体与空气混合的情况,而对于含氢的多元爆炸性混合气体、氧氮比例不同于空气的气体计算结果存在较大偏差[106]。
由于锂离子电池排出的气体中不仅含有CO2,还含有CO、醛类、酯类等多种非烃成分,不符合Le Chatelier公式的适用条件,所以一般采用经验公式来估计LEL[103,105]:
(44)
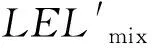
从热力学角度看,此时的爆炸上限(UEL)本质上是反应产热与系统散热之间的能量平衡极限,因此可燃气体与氧气反应释放的能量在数值上等于混合气体损失的总热量。这个原理适用于在爆炸上限附近因缺氧导致的反应不完全状态,所以可以通过热力学公式计算UEL[105]:
(45)
(46)
(47)
XU,mQF,m+(1-XU,m-XD)+XDQD=
(48)
式中:Xi表示气体混合物中一种组分的摩尔分数或体积分数,%;QF,m表示空气氛围下可燃气体混合物的吸热能力;QF,i表示空气氛围下可燃气体混合物中一种组分的吸热能力;HO,m表示空气氛围下参与反应的氧气放热能力;HF,i表示空气氛围下可燃气体混合物中一种组分的耗氧放热能力;CO,i表示可燃气体混合物中一种组分在反应中的氧系数;XU,m表示含惰性气体的可燃气体混合物的UEL,%;QD表示惰性气体的吸热能力;XD表示惰性气体的体积分数,%。
单一组分的QF、HO和HF可根据燃烧特性参数CO、XL和XU计算:
(49)
(50)
HF=COHO。
(51)
有研究[105]表明,LEL随SOC的变化趋势与烷烃含量的变化趋势一致,UEL随SOC的变化趋势与总不饱和烃含量的变化趋势一致。不饱和烃中因存在不稳定的双键结构而具有较大的反应活化能,与含量较少且相对稳定的烷烃相比,不饱和烃含量的大幅升高可能是导致混合气体爆炸极限范围扩大的主要原因。
影响爆炸极限的不仅是气体组分,还可能与压力有关。LI等[107]利用Le Chatelier公式计算得到在20、60、101 kPa时的爆炸极限范围分别为9.15%~56.27%、12.07%~63.16%、14.04%~67.5%。随着初始压力的增大,混合气体的爆炸极限范围变大。然而压力并非是通过影响气体组分来改变爆炸极限的,其原因可能是由于处于高压下的气体分子比较密集,单位体积中所含混合气体分子较多,分子间传热和发生化学反应比较容易,反应速度加快,而散热速度显著减小,因此会使爆炸极限范围扩大[108]。
2.4.2 电解液蒸气爆炸极限
带电破碎产生的气体不仅有热失控产生的可燃气体,还包括低温产生的大量电解液蒸气,这部分气体燃烧能提供更大的能量,也更具危险性。电解液蒸气爆炸极限见表5。
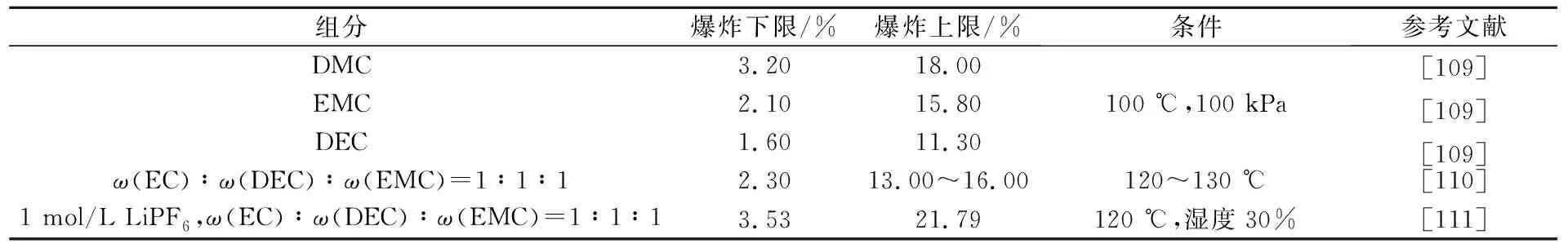
表5 电解液蒸气爆炸极限
3 温度
带电破碎过程中刀具对电池的挤压、剪切造成的短路使温度骤升,在挤压试验中,电池受力大小和受力点会影响电池正负极接触情况,挤压物与锂电池接触面积越大,温度越高[112];这可为破碎刀具的设计提供一定指导,然而在实践中刀具对电池施加的受力点和力的大小随机性太大,难以准确把控。
挤压速度对锂电池表面温度有明显影响。范文杰等[113]对80%SOC的NCM电池进行径向挤压,发现2、4、6 mm/min的加载速率对应的最高表面温度分别为72.4、82.0、268.8 ℃。
在针刺试验中,针刺速度、针刺点位置、针刺深度、针刺时长、针刺材质的导电性都会影响短路情况,从而影响热量聚集。刘仕强等[114]对圆柱和软包锂电池采用10~80 mm/s的针刺速度进行试验,发现针刺速度快慢对电池表面温度影响不大。另有研究[115]表明,随着穿刺速度的增大,积聚的气体和电解液逸出,电池内部压力降低,热失控风险降低,当穿刺速度在一定范围内增大时,穿刺速度对热失控影响不大。反而当针刺速度较低时,由部分穿透引起的短路电阻大于所有层被穿透时形成的短路电阻,热量聚集在局部,热失控风险更高。
MAO等[116]研究发现,针刺点越接近中间位置,热量向周围传播的面积越大,风险越高。在一定速度范围内,针刺深度与电池表面温度不呈正相关,与是否发生热失控无明显关系,但随着针刺速度的加快,温度分布变得更加不均匀。
ALEXIS等[117]通过机械滥用试验发现电池类型对最高温度有很大影响,NCA和LFP电池在针刺中最高温度分别为202~812 ℃和122 ℃,挤压试验中最高温度分别为609~800 ℃和89 ℃,显然NCA在机械滥用条件下的风险要远高于LFP[118]。
另外,在带电破碎中,温度还受到破碎后碎片大小的影响,粉碎成更小的碎片尺寸,可以减少短路电流释放的热量[119]。
带电破碎过程中的温度受破碎方式、刀具转速、破碎后物料粒径的影响。在带电破碎过程中,由刀具破开锂电池时金属间的摩擦以及瞬时电流释放而产生电火花,在这种有明火的情况下,若其余燃爆条件均得到满足,则温度仅需达到混合性可燃蒸气的闪点即可燃爆,而这些单一的电解液蒸气闪点是极低的,如DMC、DEC、EMC闪点分别为18、25、23 ℃。因此,选择气体保护带电破碎合适的风险控制方法至关重要。
4 氧气浓度
惰性气体在阻止燃爆方面具有重要作用,其原理如下:
a.降低可燃气体与氧气浓度。可燃气体爆炸三要素为一定浓度的可燃气体、一定量的氧气以及足够的热量,三者缺一不可,而氮气的加入会降低氢气和氧气的浓度,从而达到抑制爆炸的目的[120]。
b.惰化链反应。惰性气体会降低参与反应物质的化学反应活性,使活泼自由基变成低活性的稳定分子,终止燃烧或爆炸过程中链式反应的发展,从而达到抑制燃爆的目的[108,121-122]。
c.降低自由基浓度。加入氮气会同时降低氧气、可燃气以及参与反应自由基的浓度,增大氮气与活化分子的碰撞概率,减少可燃气体活化分子与氧气活化分子之间的碰撞概率,从而抑制爆炸[123]。
d.吸收热量。氮气会消耗链式反应过程产生的部分热量,从而降低体系温度,缩小可燃气体的爆炸极限范围,对燃爆起到一定的约束作用[122,124]。
从链传递角度而言,惰性气体阻止、打断了链的传递;从热量聚集角度而言,惰性气体使散热速率大于等于产热速率,热量不聚集,爆炸无法发生。然而带电破碎过程中的机械作用带来的短路导致温度骤升是不可避免的,这一过程产生的可燃气体的成分、浓度、总量均与温度有直接关系,而机械作用导致的短路程度难以预测,气体组分也受其影响时刻处于变化之中。当然整体上而言,温度、气体的组分及各组分浓度的变化仍然处于一定范围内,但无法确定是否在爆炸极限之外。因此为避免燃爆三要素齐全,通过惰性气体控制第三要素——氧气浓度是唯一可行的方法。
通过控制氧气浓度来保证带电破碎的安全性已在多项专利技术中有所提及,从ZHONG等[125]的研究中可知,带电破碎过程中系统内部氧气浓度存在波动,但始终维持在3%以下。
5 结论
a.导致锂电池热失控从而释放可燃气体的关键因素是温度,在带电破碎过程中,由于机械作用导致内短路,产生的热量导致温度升高,温度上升的不同阶段会导致不同组分可燃气体的释放。
b.在退役锂电池带电破碎过程中,破碎方式、刀具转速、破碎后物料粒径等均会影响温度变化,从而影响释放的气体组分、各组分浓度、总量等,因此在带电破碎过程中,将温度控制在反应温度以下,降低电解液的反应活性,是阻绝燃爆的有效途径。
c.由于破碎导致短路的程度难以预测,气体组分处于时刻变化之中,除了控制温度以外,控制氧气浓度也很重要,未来需要关注退役锂电池在带电破碎时释放气体的极限氧气浓度,以确保处理过程的安全。

