体外循环小鼠模型研究进展
董文豪,王添隆,吉冰洋
体外循环(extracorporeal circulation, ECC)是一种在一段时间内代替心肺功能,对某些特定病理状态下的患者起到生命支持作用的技术,在心脏外科手术及心肺衰竭、等待器官移植等患者的治疗过程中起到了重要的作用[1-3]。但与此同时,ECC 也存在众多的并发症[4]。建立一个稳定有效的ECC 动物模型有助于进一步探究ECC 对机体的影响及其病理生理过程,优化围术期管理策略,改善患者生存质量。
已经建立ECC 的动物模型有羊、猪、兔、大鼠等[5-9]。近年来随着显微操作技术的进步和小体积精密ECC 设备及耗材的普及,建立小鼠ECC模型的可行性大大提高[10]。相比于羊、猪等大动物,小鼠作为小动物存在易于获得、实验重复性高等优点。与同是小动物的大鼠相比,小鼠现有的基础疾病模型更加丰富,可更容易实现基因编辑等操作,为ECC 的基础研究提供了更多的可能性。同时市面上有很多针对小鼠的特异性抗体和试剂,这降低了开展分子层面研究的难度。
由于目前小鼠ECC 模型仍存在建模难度高、操作流程复杂、围实验期相关管理不规范等问题,所以有必要在小鼠体外循环的建立和管理策略等方面进行文献综述,同时为后续的研究提供理论依据。
1 ECC 小鼠模型基础特征
1.1实验小鼠的选择与管理 实验所选取的小鼠大多为C57BL/6 品系,周龄多在12 周左右,体重位于在25~35 g区间,均属成年小鼠范畴;见表1。小鼠成年后各组织器官发育成熟,具有更好的抗创伤能力,血管发育成熟有利于模型的建立。
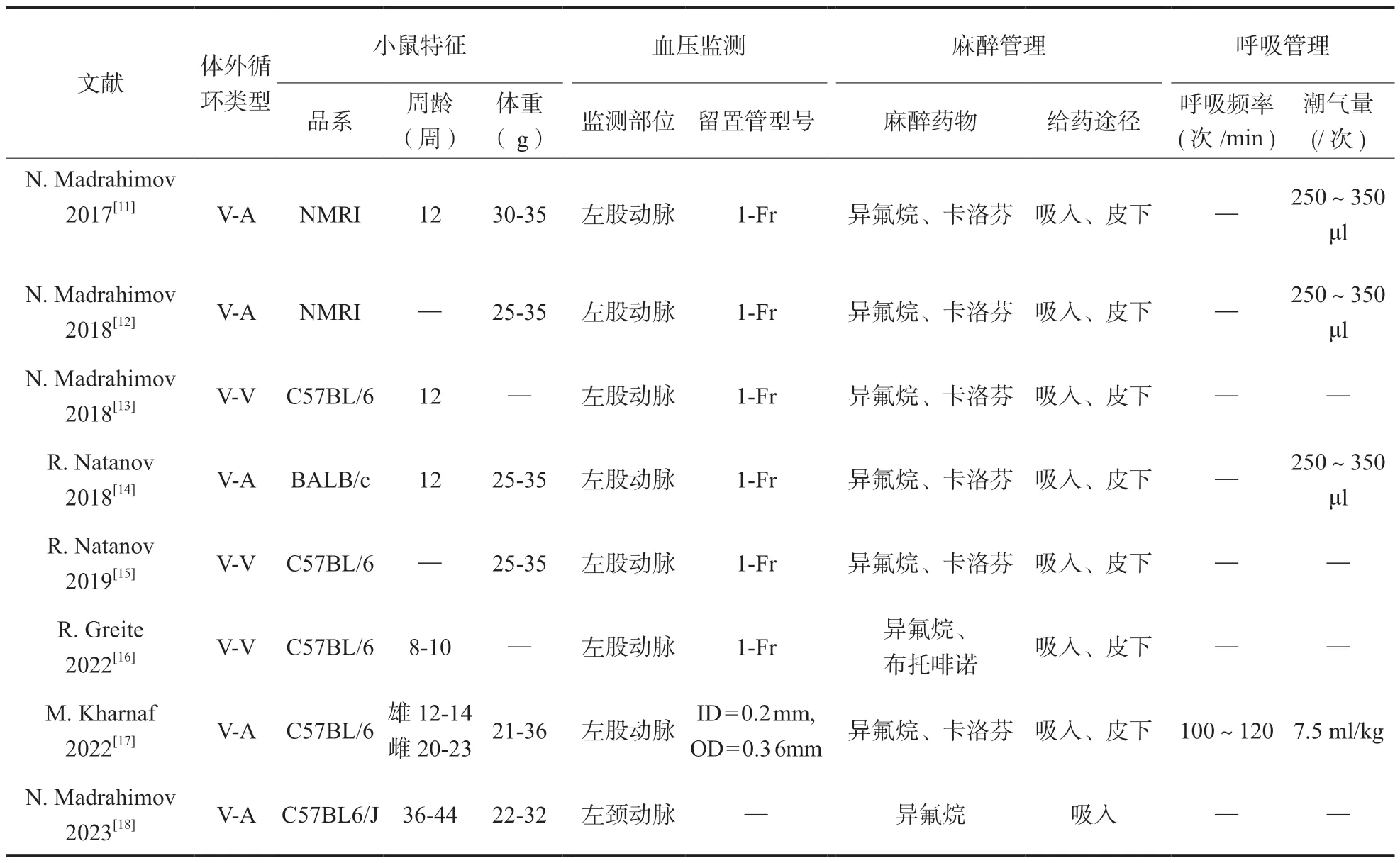
表1 小鼠体外循环模型基础参数
1.2小鼠围实验期体征监测纳入的所有实验小鼠均进行了血压监测,其中绝大部分小鼠测压是通过左股动脉穿刺完成的[11-17],但也有个别实验选择在颈动脉置管进行测压;见表1。小鼠左股动脉穿刺常采用1 Fr 尺寸的导管,有实验选择PE-8 型号导管(ID = 0.2 mm,OD = 0.36 mm),可能与该实验中选取小鼠年龄较大有关[17]。测温方面,直肠测温因其具有的简单操作、测量准确被所有实验采用。部分实验需要监测小鼠心脏功能,采用标准导联心电图进行连接测量。因小鼠循环血量较少( < 2 ml),为避免实验中小鼠失血过多,需要提前制定实验中用于血气分析的抽血的次数和单次抽血量并给予适当的实验中补液,单次抽血量一般为75 ~95 μl[12-13,15]。
1.3麻醉及呼吸管理 麻醉与呼吸管理是建立小鼠ECC 模型的基础,选择适当的麻醉药物、正确的麻醉方式、稳定的呼吸管理策略可以有效减少麻醉和呼吸因素对实验结果产生的影响。吸入麻醉具有调节简便、利于实时观察小鼠麻醉状态等优点,同时避免了静脉麻醉存在血液稀释的缺点。全部实验都选择了对小鼠进行吸入麻醉,麻醉药物选择均为异氟烷;见表1。同时所有活体小鼠实验均采用皮下注射镇痛药以减轻小鼠在实验中因外科操作带来的疼痛,以卡洛芬为主[11-15,17],也有实验选择了布托啡喏[16]。多数实验采取经口插管机械通气的方式以消除气管切开对小鼠造成的有创损伤,插管使用的导管型号仅有一项实验中记录为20 G 导管[11]。呼吸机相关参数中潮气量为250 ~350 μl/次或7.5 ml/(kg·次),呼吸频率有记录的研究显示为100 ~120 次/min,潮气量和呼吸频率都符合小鼠生理状态下的数值。实验中采取自主呼吸的小鼠没有进行气管插管,吸入麻醉是通过呼吸面罩完成的[13,15]。
2 ECC 小鼠模型建立及管理策略
2.1外科插管操作 区别于犬、家兔、大鼠等动物,小鼠体积很小,这就导致与插管相关的外科操作很难在肉眼下采用常规手术器械完成,因此实验的插管及相关操作是在显微镜下通过显微外科器械(显微剪、显微镊、显微血管钳等)进行的,部分实验也强调了研究人员需要具备显微外科相关的操作技术[11]。
根据引流与回流端血管不同,可以将ECC 系统分为静脉引流-动脉回流型(veno-arterial, V-A)和静脉引流-静脉回流型(veno-venous, V-V)两大类。所有实验引流端均选择右侧颈静脉进行穿刺,多采用2 Fr 型号留置管,并提前于显微镜视野下将套管距离末端的1/3 处开3 ~4 个窗口以保证引流通畅;见表1。颈静脉插管成功时距锁骨约2.5 cm,此时导管处于引流量最佳的位置[12]。V-A 模型回流端均选择左颈动脉插管,多采用27 G 型号的套管[11-12,14],也有实验采用如25 G、PE-8(ID = 0.2 mm,OD = 0.36 mm)型号套管。V-V模型的回流端大多选择在左颈静脉穿刺,采用26 G、2 Fr 等留置管。目前也有一种新型双腔套管的V-V 模型[15],Natanov 等人利用一根2 Fr 硅胶双腔导管于左颈静脉进行插管,分别在引流管腔距远端0.2 mm、0.4 mm、20 mm 和回流管腔距远端0.4 mm、0.5 mm 开窗,并将回流管腔远端封闭以防止血液再循环和分流,确保了ECC 运行过程中右心房引流以及上下腔静脉回流通畅;双腔套管模型示意图见图1。
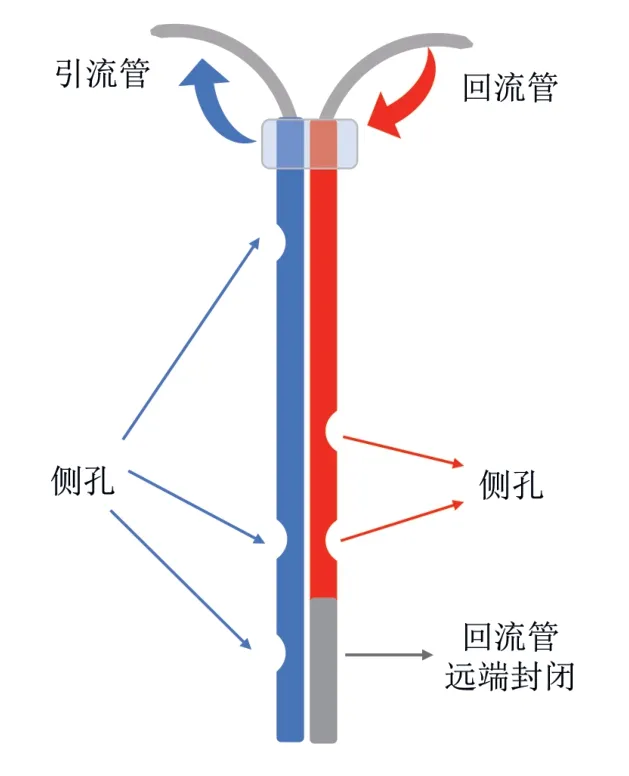
图1 双腔导管简图
2.2ECC 回路构成 常规小鼠ECC 回路主要由血管内留置套管、氧合器、储血室、血泵等组成:见图2。血泵是血液在回路中运转的动力来源,可分为滚压泵和离心泵两类。由于小鼠的ECC 流量较小,离心泵不适用于精密流量的调节[19],故小鼠模型ECC回路中多采用小体积滚压泵(蠕动泵),但滚压泵在使用过程中可能会造成溶血[20]。滚压泵的原理是挤压管路产生负压差进而推动血液流动,故大部分实验都选用了较为柔软同时具有韧性的硅胶材质管路,以尽可能地减少血液破坏;见表2。氧合器负责管路中血液的气体交换,氧合流经的血液,多数实验设定吸入氧浓度分数为80%或100%可以满足血液内氧分压或二氧化碳分压等指标的要求[11-14,18]。为避免转机过程中产生微小气泡,可另外设置储血室以进行转中排气[21]。

图2 体外循环小鼠模型示意图
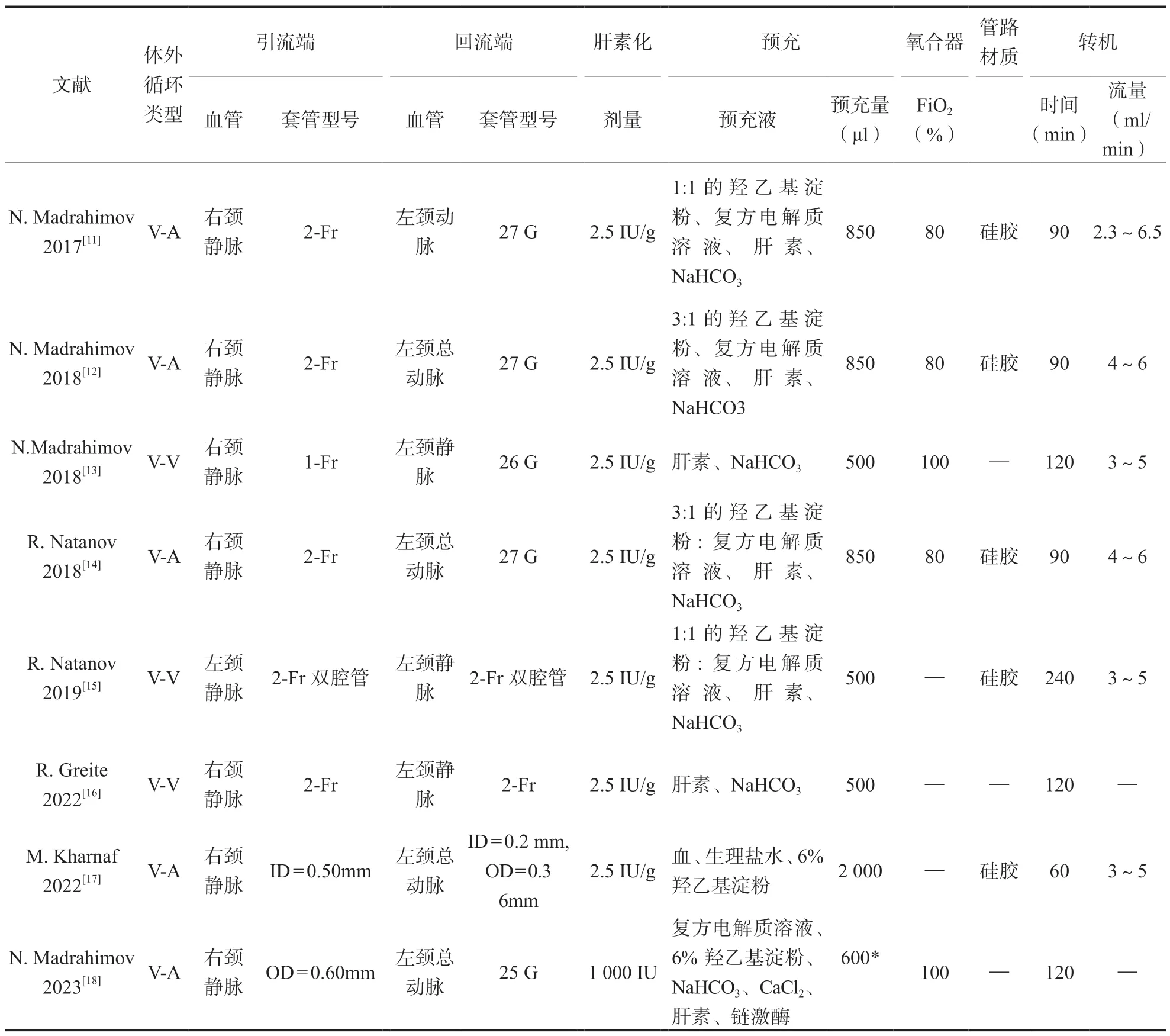
表2 小鼠体外循环模型建立及管理参数
以往有研究表明过高的预充量可能导致血液稀释进而使患者的预后恶化[22],氧合器与储血室是预充量中的主要体积来源,故缩小氧合器和储血室有利于减少高预充量导致的血液稀释。氧合器预充体积目前最小可以达到200 μl[16],储血室体积最小可达150 μl[11,16],二者体积的缩小使得回路预充液体积显著减小。
2.3ECC 管理策略 小鼠ECC 管路的总预充量大多在500 ~850 μl,其中多数预充液由晶体液和胶体液组成,目前小鼠模型报道中常用的胶体液主要是6%羟乙基淀粉和晶体液复方电解质液,一般将二者配成1 ∶1 或3 ∶1 的溶液[11-12,14-15,17-18],另添加肝素用于防止血液凝固以及碳酸氢钠溶液作为碱性缓冲液;见表2。也有实验采用来自其它小鼠的血液作为预充液,血液预充的优点是在满足较大预充量的同时几乎不造成血液稀释,缺点是溶血和炎症反应的风险也会增大[17]。小鼠在ECC 启动前需要全身血液肝素化抗凝,除一项利用死亡小鼠建立ECC 模型的实验采用了1 000IU 的超量肝素化策略[18],其余实验的肝素化策略均为2.5 IU/g。大多实验没有记录小鼠模型启动转机的活化凝血时间(activated coagulation time, ACT)值,有记录的研究ACT 值显示为800 s。大多数实验的ECC 时间为90 ~120 min,这可能是因为过长时间的转机会导致全身炎症反应[23],进而造成心脏骤停等不良后果。多数实验转机的流量在3 ~6 ml/min,约为正常小鼠心输出量(6 ~9 ml/min)的50%[13]。启动转机时流量大约0.5 ml/min,并在2 min 内达到3 ~6 ml/min。转机过程中血流量不足可能会导致急性肾损伤等并发症[24],流量的微调一般以动脉血压为依据,部分实验将动脉血压维持在40 ~60 mmHg 水平[11-12],也有实验将血压维持在70 ~85 mmHg 间[13],不同的灌注量与ECC 的类型及实验目的有关。
3 小鼠ECC 模型研究进展
ECC 在临床实践上可分为心外科手术中采用的心肺转流技术(cardiopulmonary bypass, CPB)及对于严重心肺衰竭患者进行器官支持的体外膜氧合技术(extracorporeal membrane oxygenation,ECMO)。目前进行小鼠ECC 模型研究的课题组数量不多,大多数实验的目的集中在建立有效的CPB 及ECMO 模型以及讨论相关管理策略。Madrahimov 等人在2017 年的研究中首次实现在小鼠体内建立一个功能完备且具有临床意义的CPB模型[11],研究人员通过减小氧合器与储血室体积将预充量减少到850 μl,增大了该模型的可行性。Madrahimov 等人在2018 年的一项研究中成功建立了自主呼吸小鼠的V-V ECMO 模型[13],该模型在满足通气麻醉功能的前提下减小了对小鼠的肺部损伤。Natanov 等人2019 年制作了一种血流动力学稳定的双腔插管V-V ECMO 模型[15],该单管双腔V-V ECMO 模型在减小多静脉插管损伤的同时改善了小鼠心肺功能的预后。Kharnaf 等人研究了一种以小鼠血进行预充的V-A ECMO 模型[11],该模型要求较高的预充量。
除了基础模型的构建,也有研究关注ECC 引起的全身炎症反应与器官损伤。Madrahimov 的研究指出小鼠经过CPB 处理后,肝脏及肾脏功能会受到损伤[12]。Natanov 等人发现CPB 会导致小鼠肾脏、肺和肝脏的促炎细胞因子显著增加,组织学病理改变明显[14]。Greite 的研究比较了ECMO模型和肾血管夹闭缺血再灌注损伤模型在造成小鼠急性肾损伤上的异同[16]。Madrahimov 等人在2023 年的一项研究中评估了一种新型ECMO 和血液透析的装置对于死亡小鼠终末器官的保护作用[18],这为器官移植前的保存提供了重要理论依据。
4 展望
研究ECC 小鼠模型的课题组近年来逐步增多,但目前对于ECC 全过程中的麻醉呼吸管理、外科操作流程、转机参数等还没有统一规范。小鼠作为模型动物的优点是具有多种疾病模型以及针对基因型设计的特异性试剂和抗体,但同时其循环血量少、血管较细等特点也给ECC 模型的建立造成了一些困难,下一步的研究还需要提供更精密的设备或耗材(如管路、氧合器等)以及更完善的围实验期管理策略。凭借更稳定的小鼠ECC 模型,未来有望结合数量众多的小鼠疾病基因型进行更多的基础实验,为临床上ECC 管理策略的进一步完善提供更多指导性的意见。

