体外膜氧合治疗儿童难治性脓毒性休克:现状、难点与探索
王香妮,杨宇帆,黄娇甜,卢秀兰,肖政辉
脓毒性休克是脓毒症中最严重的一种类型[1]。对标准复苏无反应的脓毒性休克,称为“难治性脓毒性休克(refractory septic shock, RSS)”[2],及时识别并干预RSS 是提高存活率的关键。体外膜氧合(extracorporeal membrane oxygenation,ECMO)是一种挽救生命的措施,用于支持心脏和肺的功能,为其它的治疗争取时间。在1990 年前,ECMO 治疗中易出现弥散性血管内凝血或出血,患者的不良预后难以解决,因此 ECMO 被认为是治疗RSS 的相对禁忌证[3]。随着医疗技术的进步,严格的肝素管理和环路护理,减少了ECMO 治疗中的并发症,最早在1994 年J Beca[4]的研究推荐将ECMO 作为儿童RSS 的挽救性治疗。之后,美国危重病协会也发布《儿童和新生儿脓毒性休克血流动力学支持临床实践指南》[5-6]推荐将ECMO用于新生儿和儿童RSS。患者的年龄、免疫状态、循环功能等基础情况都决定着ECMO 治疗RSS的存活率,国内的ECMO 技术处于发展阶段,目前的操作仍然极具挑战性,本文将对ECMO 治疗RSS 的现状、难点与探索进行综述,以期为ECMO 治疗儿童RSS 提供理论依据。
1 ECMO 治疗RSS 的现状
本综述分析国内外9 个有关ECMO 挽救治疗儿童RSS 的临床研究(表1),其中8 篇[4,7-13]为回顾性的单中心研究,一共分析152 份病例;1 篇是前瞻性研究[14],8 家医院多中心观察了一共70 例患者,其中64 例儿童,6 例新生儿。目前ECMO 治疗儿童RSS 的研究多在欧美及澳洲国家,亚洲地区文献不多,仍有待进一步深入探讨。

表1 体外膜氧合儿童治疗难治性脓毒性休克现状
1.1ECMO 治疗RSS 的类型 外周静脉-动脉(veno-arterial, V-A)ECMO 通常在股动脉和同侧股静脉进行的插管[15]。2011 年,Laren 等人[8]采用开胸的方法将静脉套管置于右心房,将动脉套管置于升主动脉,并将其称为中央V-A ECMO。静脉-静脉(veno-venous, V-V)ECMO[15]通常在右侧股静脉和颈内静脉插管,也有研究机构将颈内静脉换成上腔静脉。但是,V-V ECMO 的血液需要通过原生泵血系统,不提供心脏支持,一般不用于治疗RSS 患儿。V-A 或V-V ECMO 升级后出现了V-V-A ECMO、V-A-V ECMO[15]。它们结合了V-V 和V-A ECMO 的优点,同时提供了强有力的呼吸和循环支持,但是三重插管影响着血管压力、血液流量和氧合等多个方面,并增加了ECMO 治疗的复杂性。
1.2ECMO 治疗RSS 的存活率及影响存活率因素 外周V-A ECMO 用于治疗RSS 的存活率仍然不高。见表2。1994 年Beca J、2007 年Maclaren G、2015 年Rambaud J、2018 年Solé A、2019 年崔云、2022 年Ruth A 等人的研究[4,7,9-10,12-13]生存率均低于65.0%。中央V-A ECMO 的存活率为66.7%~73.9%[7-8,12],高于外周V-A ECMO 的存活率。Bichara 等人[11]使用外周V-V-A ECMO 的方式进行插管,该研究纳入10 例患者,拔管后的存活率达到70.0%(7/10),治疗过程中的高流量数据让人鼓舞,但是纳入的病例数量不多,需要更多的病例进一步研究。

表2 体外膜氧合治疗儿童难治性脓毒性休克生存率[(%)n/n]
1.3ECMO 治疗RSS 影响存活率的因素 感染可能影响ECMO 治疗RSS 的预后。病原菌的感染有可能会引起免疫系统广泛激活,导致炎症和器官损伤,甚至引起全身炎症反应综合征[16],增大ECMO 治疗的难度,从而影响死亡率。ECMO 治疗前后,患儿乳酸水平的变化可能预测死亡率。RSS 患儿早期血清中的乳酸水平明显升高,ECMO上机后第一个24 h 内的乳酸清除率,可以考虑是影响短期生存率的强有力因子,Scolari 等人发现[17]如果24 h 后仍未改善血清乳酸水平,死亡率接近100%。因此,建议在乳酸升高之前尽早进行ECMO 治疗评估。肝损伤标志物中的胆红素可能对预测死亡率具有临床意义。有研究[18]将血清总胆红素水平作为一个单变量因素,结果显示大于 > 513 μmol/L(30 mg/dl)的患者无一存活。因此,在ECMO 治疗RSS 患儿的过程中不能忽略血清胆红素的水平。
2 ECMO 治疗RSS 的难点
2.1ECMO 治疗RSS 患儿的时机 目前使用ECMO 的具体时机是一个难点,多项研究[10,19-20]认为RSS 的持续发展时间可能影响生存率。Anna Solé 等人[10]发现存活的患者进行ECMO 支持治疗的时间比死亡组更早。因此,建议RSS 患儿尽早进行ECMO 治疗评估,目前国内对ECMO 上机的具体时机还在探索中,有相关研究认为ECMO支持的指征包括[21-23](1)心血管功能衰竭:①严重心泵功能衰竭:左心室射血分数 < 35%、心脏排血指数 < 2.0 L/(m2·min)、使用2 种以上正性肌力药物和血管活性药物不能稳定循环持续3 h 以上;②心脏停搏、心肺复苏15 min 以上不能恢复自主循环;③需使用肾上腺素和(或)去甲肾上腺素 > 0.5 μg/(kg·min)高排低阻性休克。(2)呼吸衰竭或急性呼吸窘迫综合征患儿经呼吸机治疗出现以下情况:严重低氧血症[氧合指数 < 80 mmHg(1 mmHg = 0.133 kPa),高呼气末正压通气通常 > 15 cmH2O(1 cmH2O = 0.098 kPa)至少持续6 h 的潜在可逆性呼吸衰竭。结合患儿本身生长发育、不同病种临床表现的差异性,关于ECMO 使用时机的相关文献不多,很多学者对于最佳时机的选择有不同看法,目前仍是临床医生依据患儿病情以及临床经验做出决策,因此还需对数据进一步分析研究。
2.2ECMO 的流量难以满足RSS 患者的循环需要 治疗过程中ECMO 流量的控制目前仍然是难点,在脓毒性休克时,人体的氧气需求量大幅增加,常规外周ECMO 未能提供足够的血流量,不能完全满足人体循环中氧气的需求量。氧的消耗和输送之间的不匹配,导致组织持续的缺氧,甚至进一步出现多器官功能障碍。学者认为解决这种不匹配以及改善组织缺氧,需要严格控制心输出量、泵流量率和它们的比值。有研究发现氧合流量为150 ml /(kg·min)甚至更大的时候,患者的生存率几乎是常规治疗流量的两倍[24],提出在治疗中,可以尝试尽可能的提高流量。关于提升泵的流量方面,可以从转速、血管通道口径的大小、静脉回路的阻力,以及泵本身考虑进行调整,但是由于儿童的血管腔及ECMO 管道通路通常比较细小,较高的泵头转数、管路压力等又容易增加了溶血的风险,因此ECMO 治疗儿童RSS 过程中提供高流量支持困难重重。
2.3ECMO 的治疗过程中的出血和血栓形成 出血和血栓形成是ECMO 治疗过程中常见的并发症,见表3。出血部位可包括插管部位、近期手术切口、血管通路部位、肺、胃肠道、口、鼻、胸腔、腹腔和脑部,医师在查看患者的过程中,需多警惕上述方面的出血。其中以颅内出血最为严重,死亡率为32%~100%[25-26],因为它发生在一个密闭空间内,无法通过压迫出血部位来阻止出血。出血常见的病因[27]包括:肝素效应或过量、凝血功能障碍、血小板减少、血小板功能障碍、获得性血管性血友病综合征和高纤溶酶;血栓形成的常见病因包括:高纤维蛋白原、Ⅷ因子水平、肝素抵抗和血小板活化,因此,在治疗过程中需要多次定期监测血常规、凝血功能、DIC、肝肾功能等。其中,有研究认为[28]纤维蛋白原浓度应维持在 1.5 g/L,如果有出血或担心出血,可以使用更高的纤维蛋白原目标,如2.0 g/L或2.50 g/L[27]。在ECMO 患者中找到防止出血和血栓形成的最佳抗凝平衡点是极其艰难的,目前如何平衡患者的抗凝和止血是一个难题,尚有待解决。
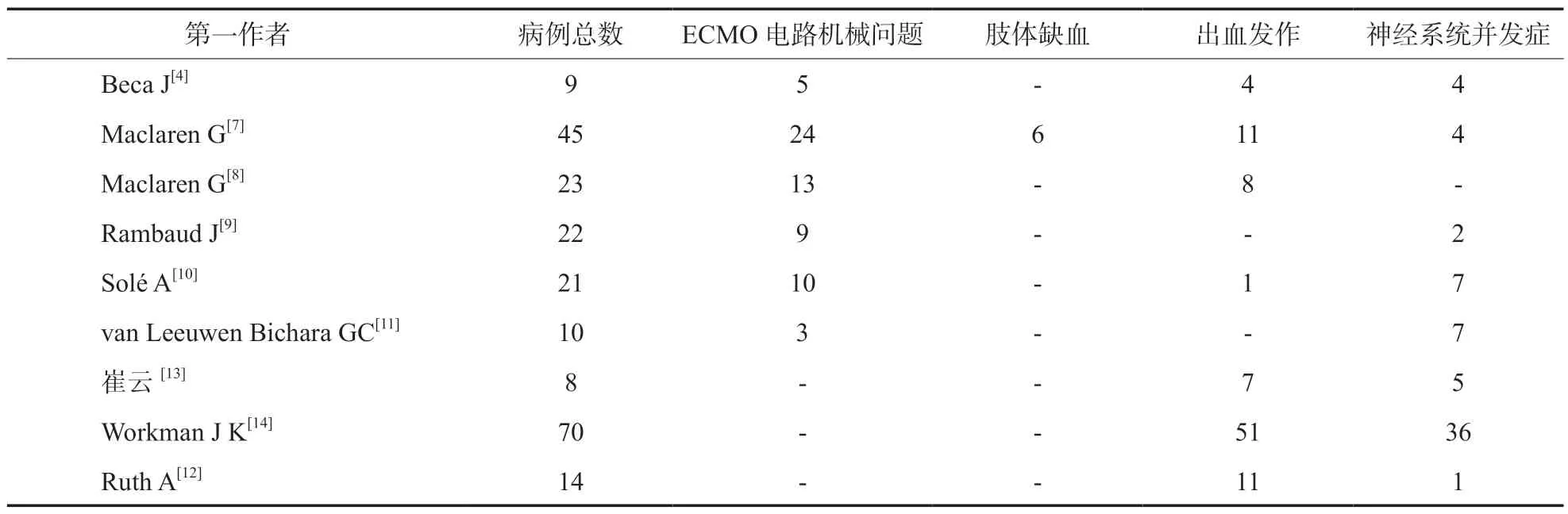
表3 体外膜氧合治疗难治性脓毒性休克不良事件(n)
3 ECMO 治疗RSS 患儿的探索
3.1ECMO联合连续性肾脏替代治疗 (continuous renal replacement therapy, CRRT)RSS 期间,急性肾损伤(acute kidney injury, AKI)和液体超负荷(fluid overload, FO)的发生率较高[29],使用ECMO 前和ECMO 治疗过程中过量的输液加重了AKI 的风险,有研究认为ECMO 联合使用CRRT 治疗RSS合并AKI 或FO 是安全有效的[30]。 在ECMO 治疗前或治疗期间,合并AKI 的患者常使用肾替代治疗(renal replacement therapy, RRT),最常见的是CRRT,CRRT 在患者血流动力学不稳定时可以提供肾脏支持,但是也可能对预后产生负面影响,目前使用ECMO 联合CRRT 治疗的开始时间、最佳血管通路以及治疗期间的抗凝方面存在争议。2019 年Dado 等人[31]发现:需要ECMO/CRRT 联合治疗的患者肾恢复率和总生存率更高,但该研究没有长期随访数据。在儿童RSS 患者接受ECMO 并联合使用CRRT 中,是否对肾功能有长期影响仍需进一步探索研究。
3.2ECMO 在移植术后并发RSS 中的使用 近年来ECMO 技术在肝移植术后患者中开始应用,Lee等人[32]认为成人在肝移植后出现RSS 的情况下,可以考虑使用外周V-A ECMO 进行挽救性治疗。关于儿童肝移植方面,也有研究[33]认为只要移植后肾功能允许,ECMO 可以是儿童接受肝移植后并发RSS 的一种治疗选择,中央ECMO 可作为器官恢复的桥梁,提供足够的流量使患儿复苏[34]。虽然该项技术在国际上陆续有报道,但是案例不多,技术尚不成熟,今后还需要进一步对该技术在治疗儿童RSS 的临床中,进行大样本、前瞻性的研究来论证其实际应用价值。
3.3ECMO 联合亚甲蓝(methylene blue, MB)在RSS 中的应用 部分RSS 是由血管麻痹综合征(vasoplegic syndrome, VS)引起,VS 指充分扩容及应用大剂量血管活性药物后仍存在持续性低血压的一组综合征[35],使用ECMO 治疗后,死亡率达80%[10],有病例报道[36]在临床最高剂量的多种血管加压药支持下,使用V-V ECMO 过程中延长MB 输注时间,可成功逆转RSS。但是目前关于脓毒症患者应用MB 的研究较少,有相关研究[37]认为MB 可增加VS 患者的动脉血压和全身血管阻力,但不影响预后。目前对于RSS 患者使用MB 的最佳剂量尚无共识,给药方案与治疗高铁血红蛋白血症(1 ~2 mg/kg)类似[38],没有证据支持MB 作为一线药物用于治疗RSS,但是临床工作中可考虑将其作为联合ECMO 治疗VS 所致RSS 的补救措施,同时未来也需要大量的实验对其疗效进行评估。
3.4ECMO 治疗中血流动力学对RSS 的监测RSS 的临床病程往往迅速恶化,有研究[39]提出血流动力学的复苏可以为识别脓毒症的严重程度、监测治疗反应提供客观价值。血流动力学常分为基本的心率、收缩压、平均动脉压、中心静脉压、中心静脉氧饱和度、灌注压和乳酸,高级的血流动力学评估如:心输出量、心脏收缩力、前负荷和后负荷。不过,近期有研究表明动脉压力衍生的血流动力学不能很好地预测儿科患者[40],可能与儿童动脉系统比成人具有更高的弹性、儿童的胸壁和肺顺应性高于成人、儿童的心室顺应性低于成人等因素有关[39],因此,在ECMO的治疗中,也需注意行高级血流动力学评估。
4 展望
目前我国ECMO 技术处于初级阶段,为提高ECMO 治疗RSS 患儿的存活率,治疗过程中仍有很多难点有待解决:①目前国内使用ECMO 治疗RSS 患儿的经验不多,如何快速识别建立ECMO最佳时机是一个难点。②ECMO 治疗RSS 患儿的技术参数,如最佳流量和最少并发症的平衡点等方面仍需更多的数据进行分析研究。③ECMO 联合使用其它技术治疗RSS,比如联合使用RRT、CRRT 技术、加用MB 药物等,都需要更多的研究进行探索。
国内甚至亚洲地区,关于使用ECMO 治疗儿童RSS 的研究报道不多,大多报道为成人案例,而且使用ECMO 的长期预后的随访结果未见报道,与成人不同的是儿童患者处于生长发育阶段,多数器官及系统处于不成熟状态,使用ECMO 及药物治疗后的副作用影响更大,治疗过程中更需警惕,但是相信未来对于ECMO 技术更深入的研究分析、设备以及各大医院插管技术的成熟、新药物及新技术的发现和使用,ECMO 治疗儿童RSS的成功率会大大提高,我们将探索出一条适合我国国情的最佳治疗策略。

