Zeste同源物2增强子在桥本甲状腺炎B淋巴细胞亚群中的表达及其抑制剂的治疗机制及效果研究
易圣果 曹业迪 赵雪 卢桂芝 张杨 丛铁川 张澜波 张继新 梁振威 屈晨雪 张俊清 高莹
基金项目:国家自然科学基金面上项目(8217030553)
引用本文:易圣果,曹业迪,赵雪,等. Zeste同源物2增强子在桥本甲状腺炎B淋巴细胞亚群中的表达及其抑制剂的治疗机制及效果研
究[J]. 中国全科医学,2024,27(21):2639-2645. DOI:10.12114/j.issn.1007-9572.2023.0623.[www.chinagp.net]
YI S G,CAO Y D,ZHAO X,et al. EZH2 expression in B cell lymphocyte subsets of Hashimoto's thyroiditis and the therapeutic mechanism and effect of its inhibitors[J]. Chinese General Practice,2024,27(21):2639-2645.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 甲状腺自身抗体是诊断桥本甲状腺炎(HT)的标志,B淋巴细胞在HT的发病机制中发挥重要作用。Zeste同源物2增强子(EZH2)是一种表观遗传学蛋白,在淋巴细胞的发育与功能调控中扮演重要角色。目的 本研究探讨EZH2在HT甲状腺组浆母细胞及浆细胞中的表达,进一步探讨EZH2抑制剂在实验性自身免疫甲状腺炎(EAT)模型中的治疗作用。方法 收集北京大学第一医院2010—2020年6例行甲状腺手术的患者,取肿瘤对侧的甲状腺组织(HT及正常甲状腺组织各3例),通过RNA-seq筛选B淋巴细胞相关基因的表达情况;收集16例HT患者的甲状腺组织和8例健康对照(HD)甲状腺组织,分别利用免疫组化及免疫荧光验证EZH2在HT甲状腺组织中B淋巴细胞中的表达;收集25例HT甲状腺细针穿刺液(FNA)、19例HT外周血以及12例健康人外周血样本应用流式细胞分析检测EZH2在浆母细胞及浆细胞中的表达改变。将15只7周龄NOD.H-2h4小鼠EAT模型分为对照组(n=5)、EAT无注射(n=5)或注射EZH2抑制剂GSK126处理组(10 mg/kg,腹腔注射3次/周,n=5),8周后观察甲状腺炎症程度及甲状腺球蛋白抗体(TgAb)水平的改变。结果 RNA-seq结果显示,相较于正常甲状腺组织,HT甲状腺组织中EZH2水平上调,一些与B淋巴细胞表型相关的基因例如CD19、CD27、CD38、CD52相应增加。免疫组化结果显示,16例HT甲状腺组织标本中EZH2免疫组化染色均可在生发中心(GC)见到阳性细胞,呈强阳性,8例正常甲状腺组织染色中未观察到阳性细胞。HT甲状腺组织中EZH2染色高表达在GC区,EZH2特异性地表达在CD19+B淋巴细胞中。流式细胞术检测结果显示HT FNA样本中CD19+B淋巴细胞、浆母细胞及浆细胞比例均高于HD外周血、HT外周血样本(P<0.01),HT FNA样本中EZH2在CD19+B淋巴细胞、浆母细胞中的阳性比例高于HT外周血(P<0.005)。小鼠实验中,EAT组甲状腺的淋巴细胞浸润较对照组增加。GSK126处理组炎症程度评分和TgAb水平高于对照组,低于EAT组(P<0.001)。结论 EZH2在HT甲状腺组织CD19+B淋巴细胞中表达异常升高,可能促進了B淋巴细胞分化成浆细胞进而促进自身抗体生成破坏甲状腺,EZH2抑制剂可以减缓EAT模型甲状腺炎症程度。浆母细胞中EZH2表达增加可能参与了HT的发病机制,EZH2可能成为治疗HT的新靶点,相关机制需要进一步深入研究。
【关键词】 桥本甲状腺炎;B淋巴细胞亚群;Zeste同源蛋白2增强子;甲状腺功能减退症;靶向治疗
【中图分类号】 R 581.4 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0623
EZH2 Expression in B Cell Lymphocyte Subsets of Hashimoto's Thyroiditis and the Therapeutic Mechanism and Effect of Its Inhibitors
YI Shengguo1,CAO Yedi1,ZHAO Xue1,LU Guizhi1,ZHANG Yang1,CONG Tiechuan2,ZHANG Lanbo3,ZHANG Jixin4,LIANG Zhenwei5,QU Chenxue6,ZHANG Junqing1,GAO Ying1*
1 Department of Endocrinology,Peking University First Hospital,Beijing 100034,China
2 Department of Otorhinolaryngology-Head and Neck Surgery,Peking University First Hospital,Beijing 100034,China
3 Department of Thyroid and Breast Surgery,Peking University First Hospital,Beijing 100034,China
4 Department of Pathology,Peking University First Hospital,Beijing 100034,China
5 Department of Ultrasound Medicine,Peking University First Hospital,Beijing 100034,China
6 Department of Clinical Laboratory,Peking University First Hospital,Beijing 100034,China
*Corresponding author:GAO Ying,Professor/Chief physician/Doctoral supervisor;E-mail:gaoyingpkufh@bjmu.edu.cn
【Abstract】 Background Thyroid autoantibody is a marker for the diagnosis of Hashimoto's thyroiditis(HT),and B cells are essential in the pathogenesis of HT. Enhancer of Zeste homolog 2(EZH2),which is an important epigenetic regulator,plays an important role in the regulation of lymphocytes development and function. Objective To investigate EZH2 expression in plasmoblasts and plasma cells in HT,and further explore the therapeutic effect of EZH2 inhibitors in experimental autoimmune thyroiditis(EAT) model. Methods The thyroid tissues from 6 patients who underwent thyroidectomy(3 HT patients with PTC,3 patients with PTC alone) in Peking University First Hospital between 2010 and 2020 were obtained from the contralateral lobe with thyroid cancer,and screened for the expression of B-lymphocyte-related genes by RNA-seq; thyroid tissues from 16 HT patients and 8 normal thyroid tissues were collected and verified for the the expression of EZH2 in B cells in HT thyroid tissues by immunohistochemistry or immunofluorescence,respectively. Fine-needle aspiration(FNA) samples from patients with HT(n=25),and peripheral blood from patients with HT(n=19) or healthy donors(n=12) were analyzed by flow cytometry to define altered EZH2 expression in plasmablasts and plasma cells. Fifteen seven-week-old NOD.H-2h4 mice were randomly divided into the control(n=5),EAT without injection group(n=5),and EZH2 inhibitor+ GSK126 injection group(10 mg/kg,intraperitoneal injection 3 times /week,n=5). The degree of thyroid inflammation and changes in TgAb levels were observed after 8 weeks. Results RNA sequencing analysis showed that EZH2 and genes associated with the B-cell phenotype such as CD19,CD27,CD38,CD52 were higher expressed in HT hyroid tissues compared with normal thyroid tissues. Immunohistochemical results showed that immunohistochemical staining for EZH2 in 16 HT thyroid tissue specimens was strongly positive with positive cells observed in the GC region,and no positive cells were observed in the staining of 8 normal thyroid tissues. EZH2 staining in HT thyroid tissue was highly expressed in the GC region,and EZH2 was specifically expressed in CD19+ B cells. The results of flow cytometry assay showed that the proportion of CD19+ B cells,plasmablasts and plasma cells in HT FNA samples was higher than that of HD peripheral blood and HT peripheral blood samples(P<0.01),and the proportion of EZH2 positivity in CD19+ B cells and plasma cells was higher in HT FNA samples than that of HT peripheral blood(P<0.005). In the mouse experiments,lymphocytic infiltration of the thyroid tissues was increased in the EAT group compared to the control group. In the GSK126 treatment groups,the thyroid inflammatory score and serum TgAb titer were significantly higher than the control group and lower than the EAT group. Conclusion EZH2 over-expression in CD19+ B cells of HT hyroid tissues may promote the differentiation of B cells into plasma cells and auto-antibody production,which leads to the destruction of thyroid tissues. EZH2 inhibitors can slow down the degree of thyroid inflammation in the EAT model. Increased EZH2 expression in plasmablasts may be involved in the pathogenesis of HT. EZH2 may serve as a therapeutic target for HT,although further studies are needed.
【Key words】 Hashimoto thyroiditides;B-lymphocyte subsets;Enhancer of Zeste homolog 2 protein; Hypothyroidism;Targeted therapy
桥本甲状腺炎(HT)是一种器官特异性的自身免疫性甲状腺疾病[1-2],是甲状腺功能减退(简称甲减)的主要病因,而甲减可造成患者生活质量低下甚至威胁生命[3]。目前HT临床治疗主要集中在对症及针对甲减的替代治疗。因此需要进一步深入探讨HT发病机制,开发新的治疗手段,减少甲减的出现。
HT的发病机制与浸润在甲状腺组织中的大量的淋巴细胞例如组织病理切片可见的生发中心(GC)中T淋巴细胞、B淋巴细胞等以及产生的自身抗体直接有关[2,4]。近年来越来越多的研究表明,除了遗传和环境因素外,表观遗传因子的调节协同作用也可以促进HT的发生[1,5-6]。Zeste同源物2增强子(EZH2)是一种重要的表观遗传学蛋白,在免疫系统如淋巴细胞的发育与功能调控中发挥重要作用[7]。有研究发现EZH2能通过表观遗传学作用参与如系统性红斑狼疮所致的狼疮肾炎、炎症性肠病等自身免疫疾病的发病过程,EZH2异常升高能够促进CD4+T淋巴细胞的黏附、迁移,激活B淋巴细胞及调控浆细胞分化,促进抗体产生[8-9],而EZH2抑制剂则能够抑制自身抗体形成[10-11],因而可能是未来治疗自身免疫性疾病的新靶点。本研究拟探讨EZH2在HT甲状腺组织中B淋巴细胞的表达情况,在体内试验中使用EZH2抑制剂探索缓解实验性自身免疫甲状腺炎(EAT)小鼠模型甲状腺炎的效果,为未来EZH2小分子抑制剂用于HT的治疗提供理论依据。
1 材料与方法
本研究过程:首先通过RNA-seq检测HT和正常甲状腺中基因表达差异,再通过对HT甲状腺病理切片进行免疫组化和免疫荧光探索EZH2在CD19+B淋巴细胞共定位表达模式;在此基础上,通过流式细胞术检测HT的甲状腺细针穿刺液和外周血的B淋巴细胞亚群分布差异以及EZH2的异常表达;最后在使用EZH2抑制剂的EAT小鼠模型上检测甲状腺组织淋巴细胞浸润程度、外周血TgAb水平变化。
1.1 实验材料
1.1.1 研究对象和标本采集:标本来源为北京大學第一医院,主要分3部分。第1部分,取甲状腺癌术后肿瘤对侧病理明确为HT(年龄35~51岁)、健康对照(HD)甲状腺组织(年龄22~59岁)各3例(2017年1月—2018年1月),提取RNA以备RNA-seq检测;第2部分,取16例HT患者甲状腺癌术后组织病理切片和8例HD甲状腺组织(以远离甲状腺乳头状癌的甲状腺组织作为病理对照)切片(2010年1月—2020年1月)用于免疫组化及免疫荧光检测EZH2在HT中的表达模式;第3部分,收集12例HD者(年龄22~62岁)及19例HT患者(年龄25~67岁)的外周血及25例HT患者(年龄27~74岁)甲状腺细针穿刺液(FNA),采用流式细胞技术,检测B淋巴细胞亚群及EZH2的表达(2019年1月—2020年1月)。本研究获得北京大学第一医院伦理委员会批准(编号:2020科研062)。
1.1.2 HT患者诊断标准:依据甲状腺自身抗体结合甲状腺B超、术后病理或者细针穿刺病理确诊为HT。排除标准:(1)病理检查显示合并其他甲状腺疾病;(2)患其他肿瘤等疾病,特别与EZH2相关的肿瘤,例如黑色素瘤、肺癌、膀胱癌等;(3)妊娠及影响甲状腺激素结合球蛋白水平的疾病;(4)白血病、淋巴瘤等B淋巴细胞异常的疾病;(5)系统性红斑狼疮、银屑病等其他甲状腺以外的自身免疫疾病。
健康对照者纳入标准:健康人群,甲状腺功能正常,甲状腺自身抗体阴性,甲状腺超声正常。排除标准:(1)有甲状腺疾病病史和家族史;(2)患自身免疫性疾病、肿瘤等其他疾病。
1.1.3 实验动物:NOD.H-2h4雌鼠均购置于赛业(苏州)生物科技有限公司,实验方案经北京大学第一医院动物管理委员会批准(编号:J2023021)。实验过程均符合中国卫生部动物管理规范。
1.1.4 实验主要试剂与仪器:EZH2抗体(Cell Signaling Technology,美国),CD19(Biolegend,美国),免疫组化试剂盒(PV9000,中杉金桥),FITC-CD19、BV510-CD27、PerCp-Cy5.5-CD38、APC-CD138、PE-Cy7-IgD、BV421-EZH2(Biolegend,美国),羊抗鼠/兔荧光二抗(Invitrogen,Alxaflour 488/595,美国),GSK126(Selleck,美国),裂解溶液(BD,美国),牛甲状腺球蛋白(bTg,Sigma-Aldrich,美国),激光共聚焦显微镜(Leica,德国),流式细胞仪(BD,FACS Canto Ⅱ,美国)。
1.2 实验方法
1.2.1 RNA-seq检测:使用商品化试剂盒提取新鲜甲状腺组织(第1部分)的RNA,由上海伯豪生物技术有限公司对生物样本进行检测,数据分析采用Fold-change(表达差异倍数)以及t检验统计学方法对差异基因进行筛选,筛选条件:Fold Change(linear)<0.5或者Fold Change(linear)>1.5。
1.2.2 免疫组化:将甲状腺标本(第2部分)的石蜡组织切片,进行烤片脱蜡,脱水、抗原修复、内源性过氧化物酶灭活和封闭后,EZH2(1∶100)或CD19(1∶100)的抗体孵育,用于免疫组织化学染色。二抗(PV9000,中杉金桥)在室温下孵育30 min进行显色,再经冲洗、复染、脱水、透明等步骤后封固。
1.2.3 免疫荧光与激光共聚焦:将制备的石蜡组织切片烤片脱蜡后进行脱水、柠檬酸盐缓冲液95 ℃修复
25 min,3%过氧化氢在室温下孵育15 min。EZH2(1∶400)和CD19(1∶500)一起孵育,用于免疫荧光。羊抗鼠/兔荧光二抗(Alxaflour 488/595)在室溫下孵育2 h,用含有DAPI的荧光染料封片。使用Leica激光共聚焦显微镜,选取405/488/543激光观察相应指标在目的细胞着色情况。
1.2.4 流式细胞染色:依据文献[12-13],通过流式细胞术检测(第3部分)B淋巴细胞比例以及EZH2表达。按照流式样品要求使用裂解溶液(BD,San Diego,CA,USA)裂解红细胞制备单细胞悬液。用FITC-CD19、BV510-CD27、PerCp-Cy5.5-CD38、APC-CD138、BV421-EZH2(均1∶100)、PE-Cy7-IgD(1∶200)在室温下染色30 min。同种型匹配的抗体用作阴性对照,再经过洗涤、重悬,FACS Canto Ⅱ流式细胞仪上机并用FACS Diva软件(BD,San Diego,CA,USA)进行分析。
1.2.5 实验动物分组:使用SPF级的7周龄NOD.H-2h4雌鼠15只,体质量20~25 g。采取随机数字表法将小鼠分为A、B、C 3组,每组5只,A组野生型对照组:无处理小鼠;B组EAT组:从饲喂碘水开始同时腹腔注射等体积0.9%氯化钠溶液,注射3次/周;C组EZH2抑制剂组:从饲喂碘水开始腹腔注射EZH2抑制剂GSK126,10 mg/kg,注射3次/周。B组和C组均饲喂0.05%碘化钠(NaI)高碘水8周,建立EAT小鼠模型[14]。实验进行8周后杀检,评估每组小鼠甲状腺炎症程度和甲状腺球蛋白抗体(TgAb)水平。
1.2.6 实验动物甲状腺炎症程度评估:留取小鼠甲状腺组织行免疫组化染色,组织4%甲醛固定,常规石蜡包埋,制作石蜡切片(5 μm)。HE染色,光学显微镜下观察,甲状腺淋巴细胞浸润程度以百分比表示,甲状腺炎症程度评分标准[14],0分为甲状腺无单个核细胞浸润;1分为2~3个滤泡间隙有单个核细胞浸润;2分为1个滤泡内有2~3个浸润灶;3分为10%~40%区域被浸润;4分为41%~80%区域被浸润;5分为>80%区域被浸润。对每组进行炎症程度评分。
1.2.7 TgAb测定:小鼠眼球采血留取血清,使用ELISA方法检测TgAb水平,用0.05 mol/L 碳酸盐缓冲液稀释商品化bTg终浓度为4 μg/mL进行包被,使用PBST洗涤、3%BSA封闭后,小鼠血清按1∶50比例PBST稀释加入96孔酶标板,经洗涤、二抗HRP 标记的山羊抗鼠IgG孵育以及显色后,用酶标仪在490 nm吸光度下测定各孔OD值,比较(检测组OD值-空白对照组OD值)绝对值。
1.3 统计学方法
应用GraphPad Prism 7(GraphPad Software,美国)进行数据处理、统计分析及作图,符合正态分布的计量资料采用(x-±s)表示,两组间比较采用独立样本t检验,多组间比较采用单向方差分析(ANOVA);不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 RNA-seq检测结果
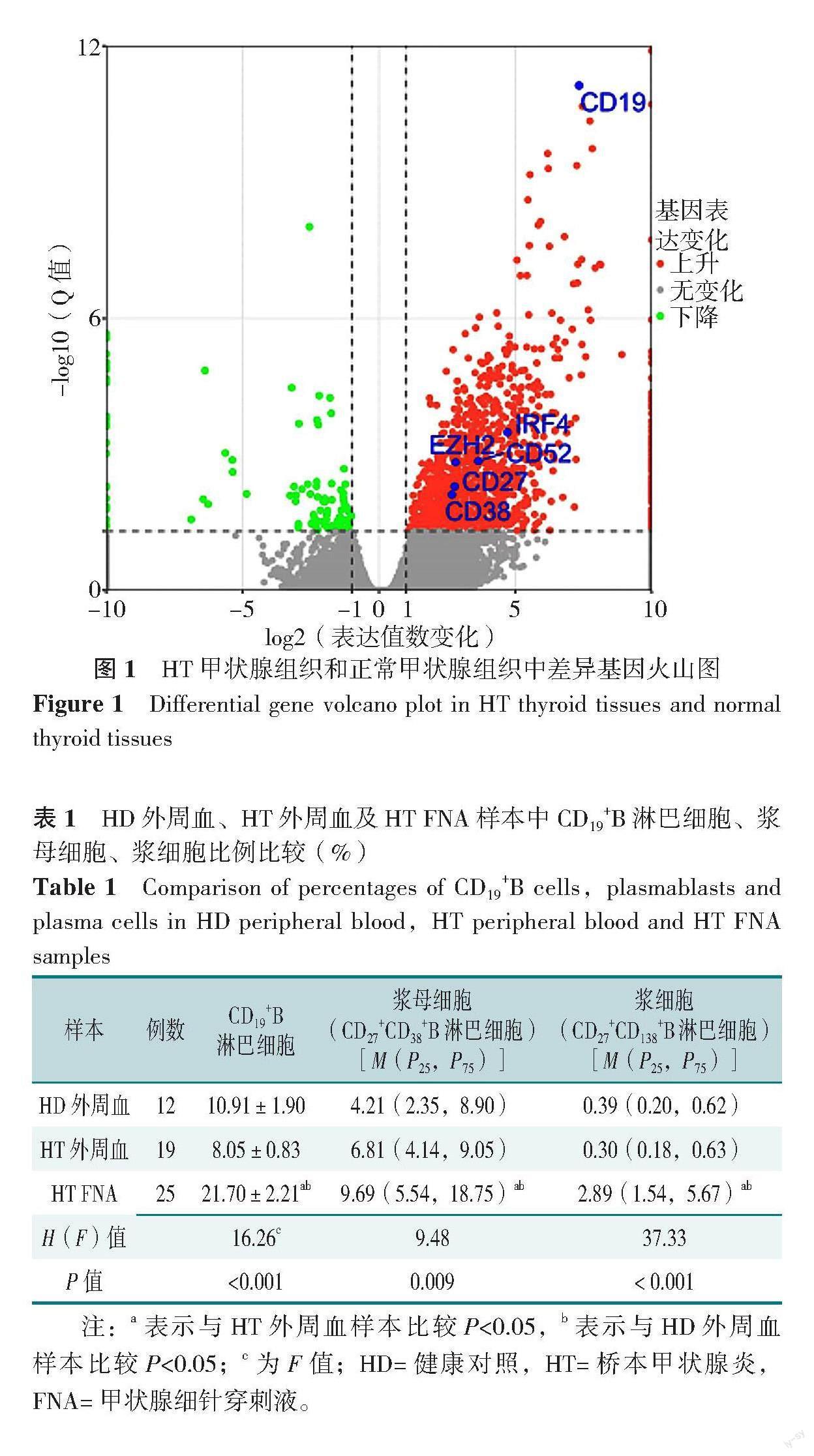
对HT、正常甲状腺组织进行RNA-seq检查结果显示,相较于正常甲状腺组织,HT甲状腺组织中EZH2水平上调,一些与B淋巴细胞表型相关的基因例如CD19、CD27、CD38、CD52相应增加,见图1。
2.2 免疫组化结果
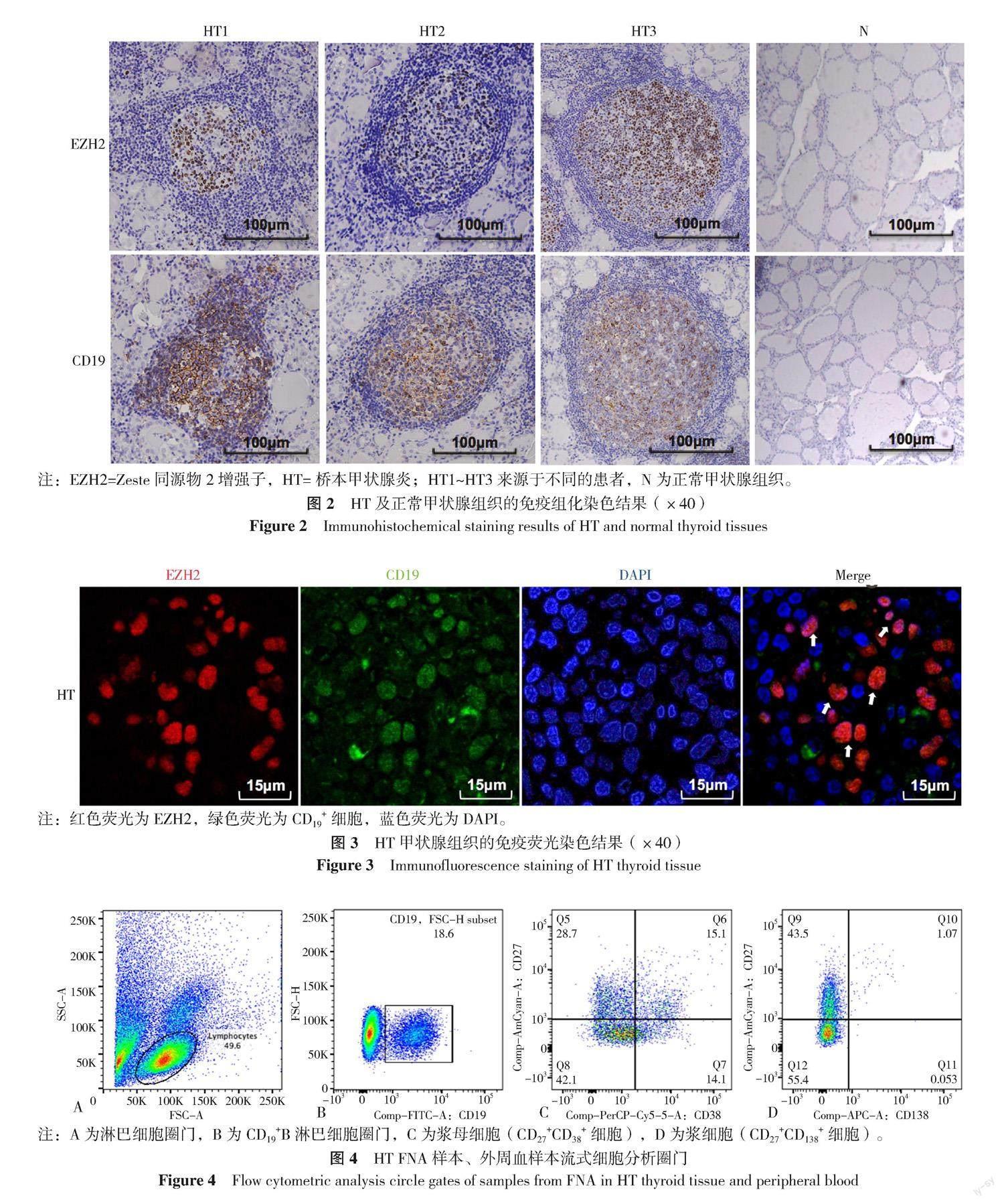
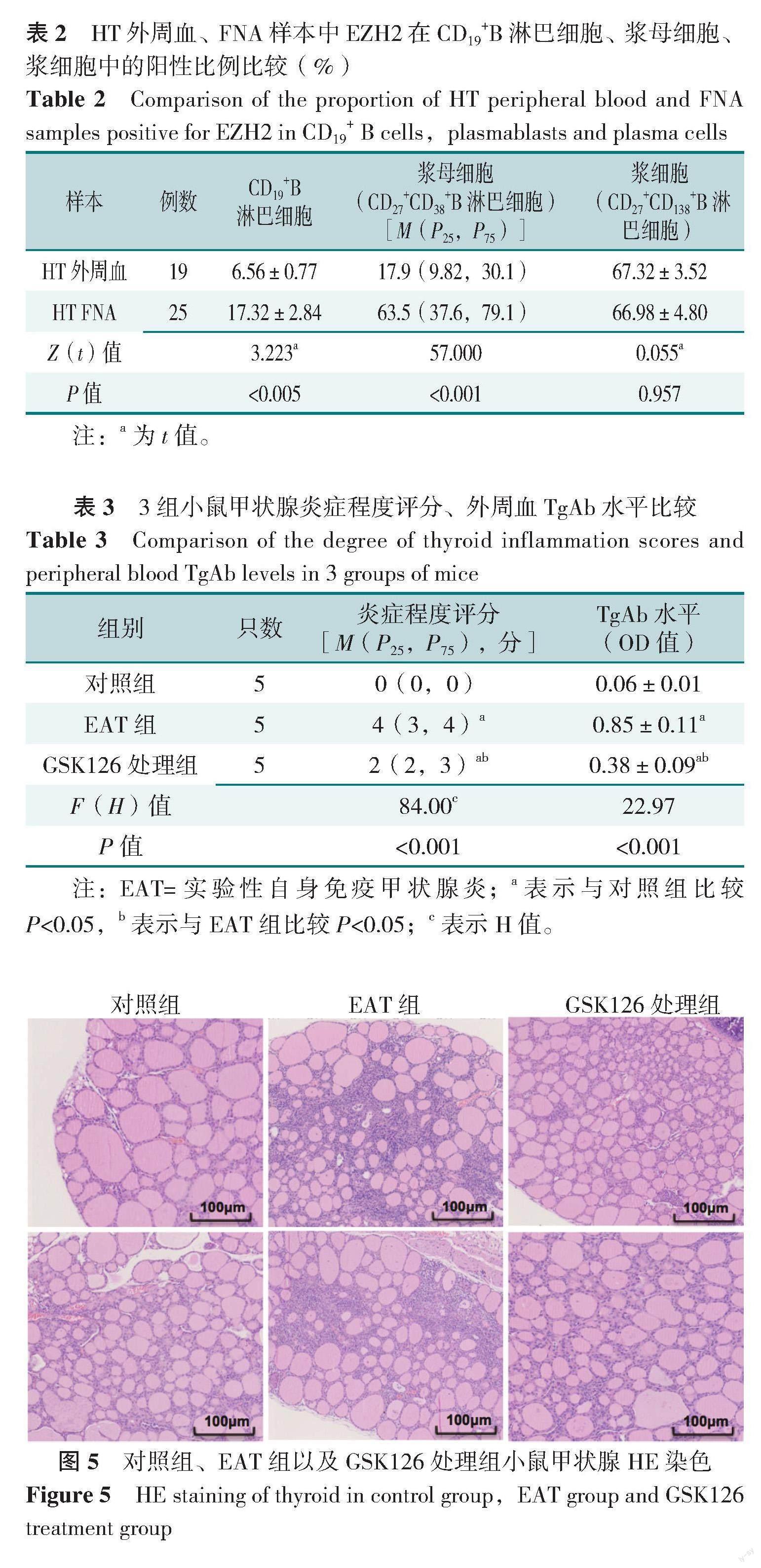
16例HT甲状腺组织标本中EZH2免疫组化染色均可在GC见到阳性细胞(图2),呈强阳性,8例正常甲状腺组织染色中未观察到阳性细胞。HT甲状腺组织中EZH2染色高表达在GC,而其他区域则未见阳性染色,连续切片进行CD19染色后,发现EZH2特异性地表达在CD19+B淋巴细胞中(图2)。进一步行免疫荧光EZH2和CD19的双重染色,显示EZH2在CD19+B淋巴细胞特异性高表达,见图3。
2.3 流式细胞术检测结果
HT FNA样本和外周血样本中B淋巴细胞亚群分布流式细胞圈门见图4。HT外周血样本中的CD19+B淋巴细胞在总淋巴细胞的比例,以及浆母细胞(CD27+CD38+细胞)、浆细胞(CD27+CD138+细胞)在CD19+B淋巴细胞的比例,与健康对照(HD)外周血样本比较,差异无统计学意义(P>0.05);HT FNA样本中CD19+B淋巴细胞在总淋巴细胞的比例,浆母细胞、浆细胞在CD19+B淋巴细胞的比例均高于HD外周血、HT外周血样本,差异有统计学意义(P<0.05),见表1。
HT FNA样本中EZH2在CD19+B淋巴细胞、浆母细胞中的阳性比例高于HT外周血,差异有统计学意义(P<0.005);EZH2在HT外周血和HT FNA样本浆细胞中的阳性比例比较,差异无统计学意义(P>0.05),见表2。
2.4 EAT小鼠模型结果
EAT组甲状腺的淋巴细胞浸润较对照组增加(图5)。GSK126处理组炎症程度评分和TgAb水平高于对照组,低于EAT组,差异有统计学意义(P<0.001),见表3。
3 讨论
B淋巴细胞和甲状腺自身抗体在HT发病机制中发挥重要作用。已有研究报道作为HT标志性抗体的TgAb和甲状腺过氧化物酶抗体(TPOAb)可通过抗体依赖细胞介导细胞毒作用(ADCC)和/或补体依赖细胞毒作用损伤甲状腺滤泡细胞。以B淋巴细胞为突破口,探索甲状腺自身抗体产生的机制,避免其对甲状腺组织的破坏可能是预防出现不可逆甲减的方向之一。有研究发现,多发性硬化患者使用选择性消耗B淋巴细胞的免疫治疗后能够有效减少疾病复发以及新发炎症[15-16],因此B淋巴细胞可能是自身免疫疾病治疗的新靶点。
本研究发现HT患者甲状腺中B淋巴细胞亚群例如浆母细胞及浆细胞分布异常,证实B淋巴细胞在HT发病机制中发挥重要作用。进一步结果提示HT患者甲状腺组织的GCs中,EZH2在CD19+B淋巴细胞上特异性過表达,且EZH2在浆母细胞中水平升高。EZH2属于多梳蛋白家族的一种,是多梳抑制蛋白复合物2(PRC2)催化活性的亚单位之一[17],也是表观遗传学中重要的调控蛋白。EZH2能通过组蛋白甲基转移酶的酶促反应调控染色体折叠从而抑制基因的表达[18],也能通过甲基化非组蛋白靶点或直接与其他蛋白相互作用这两种非依赖PRC2的方式,激活下游基因[19]。有文献报道,EZH2在免疫系统能够抑制B淋巴细胞分化基因表达,调控B淋巴细胞分化,其次能维持抗体基因随机突变,促进抗体多样化和亲和力成熟[7]。在系统性红斑狼疮、干燥综合征一些自身免疫疾病中EZH2发挥着重要作用,能够促进B淋巴细胞增殖、分泌抗体[8-9]。因此推测HT甲状腺组织中,EZH2在CD19+B淋巴细胞,尤其是浆母细胞中的异常表达升高,可能促进B淋巴细胞分化成浆细胞,进而促进甲状腺自身免疫抗体的生成,不断加速破坏甲状腺滤泡细胞,导致不可逆的甲减出现。因此EZH2在HT甲状腺组织中的B淋巴细胞分化过程中可能发挥重要作用,其可能是治疗HT的新靶点。
EZH2在不同的自身免疫疾病中致病机制不同,大部分研究证明EZH2通过表观遗传学作用抑制/激活下游基因或信号通路促进B淋巴细胞分化、功能以及抗体产生,但也有研究发现在结肠炎和实验性自身免疫性脑脊髓炎中,通过介导Toll样受体(TLR)诱导的促炎基因表达,促进了巨噬细胞和小胶质细胞激活从而促进自身免疫炎症反应;炎症性肠病中EZH2抑制髓源抑制细胞功能促进炎症发展[11,20]。因此EZH2在自身免疫疾病中扮演着不同的角色,需要更加深入挖掘其机制。本研究在EAT模型中应用8周EZH2抑制剂GSK126,甲状腺HE染色评估淋巴细胞浸润程度以及检测血清TgAb水平显示,EAT模型的甲状腺炎症程度明显缓解。既往有研究发现EZH2升高促进了多发性硬化症、狼疮患者自身抗体的生成[9,21],抑制EZH2能缓解自身免疫疾病如系统性红斑狼疮和炎症性肠病的进程[11,22]。本研究观察到了EZH2抑制剂在EAT模型中相似的免疫抑制作用。目前越来越多的特异性针对EZH2表观遗传作用的药物已进入临床试验阶段,GSK126是其中一个强有效的EZH2酶促抑制剂,在临床前和临床试验中被证实能够广泛地降低EZH2甲基化转移酶活性水平,能有效地抑制EZH2在疾病中致病作用[23],本研究提示EZH2抑制剂在HT的治疗中可能具有很大的发展前景及转化意义。
此外,本研究结果显示,与HD者相比,HT患者的外周血样本中B淋巴细胞亚群的分布没有改变,但HT患者FNA样本中CD19+细胞百分比明显增加,尤其是浆母细胞和浆细胞,支持HT是器官特异性自身免疫紊乱。本研究结果提示,FNA样本比外周血样本在表现HT自身免疫特点时,更具代表性。既往文献研究中也认为HT的特征是甲状腺的淋巴细胞包括B、T淋巴细胞浸润,而B淋巴细胞功能异常、自身抗体形成是自身免疫性甲状腺疾病中主要的免疫反应[6]。
本研究存在局限性:首先,仅研究了HT患者中EZH2的表达,并没有探讨HT患者中EZH2阳性细胞B淋巴细胞亚群的功能和可能的致病机制。未来,需要进一步的功能研究来证实EZH2在调节B淋巴细胞分化和刺激浆母细胞分化成浆细胞中的作用,在细胞水平及动物水平上进行验证。其次,EZH2异常升高的上游调控机制尚未明确,需要进一步探索。
总之,本研究发现EZH2在HT中异常表达升高有可能促进B淋巴细胞分化成浆细胞,从而促进甲状腺自身抗体生成,使用EZH2抑制剂则可以缓解小鼠模型甲状腺炎症程度。浆母细胞EZH2表达增加可能参与了HT的发病机制。EZH2可能作为未来HT的治疗靶点,相关机制需要进一步深入研究。
作者贡献:易圣果提出研究思路,设计研究方案,研究命题提出,部分实验方案实施,论文起草;曹业迪、赵雪负责样本采集,进行实验,研究过程的实施;卢桂芝、张杨负责数据收集、采集、清洗等;丛铁川、张澜波负责患者筛选、甲状腺样本收集;张继新负责甲状腺病理诊断;梁振威负责甲状腺B超及影像学选取、数据留存;屈晨雪负责临床检验指标化验与检测;张俊清负责文章的质量控制与审查,监督管理;高莹负责研究命题的设计、方案修正,最终版本修订,文章的审查,对文章整体负责。
本文无利益冲突。
参考文献
RALLI M,ANGELETTI D,FIORE M,et al. Hashimoto's thyroiditis:an update on pathogenic mechanisms,diagnostic protocols,therapeutic strategies,and potential malignant transformation[J]. Autoimmun Rev,2020,19(10):102649. DOI:10.1016/j.autrev.2020.102649.
MCLACHLAN S M,RAPOPORT B. Breaking tolerance to thyroid antigens:changing concepts in thyroid autoimmunity[J]. Endocr Rev,2014,35(1):59-105. DOI:10.1210/er.2013-1055.
DE LEO S,LEE S Y,BRAVERMAN L E. Hyperthyroidism[J]. Lancet,2016,388(10047):906-918. DOI:10.1016/S0140-6736(16)00278-6.
BRIX T H,HEGED?S L. Twin studies as a model for exploring the aetiology of autoimmune thyroid disease[J]. Clin Endocrinol,2012,76(4):457-464. DOI:10.1111/j.1365-2265.2011.04318.x.
CA?AS C A,CA?AS F,BONILLA-ABAD?A F,et al. Epigenetics changes associated to environmental triggers in autoimmunity[J]. Autoimmunity,2016,49(1):1-11. DOI:10.3109/08916934.2015.1086996.
WANG B,SHAO X Q,SONG R H,et al. The emerging role of epigenetics in autoimmune thyroid diseases[J]. Front Immunol,2017,8:396. DOI:10.3389/fimmu.2017.00396.
NUTT S L,KEENAN C,CHOPIN M,et al. EZH2 function in immune cell development[J]. Biol Chem,2020,401(8):933-943. DOI:10.1515/hsz-2019-0436.
HE C M,YANG Y L,CHEN Z L,et al. EZH2 promotes T follicular helper cell differentiation through enhancing STAT3 phosphorylation in patients with primary sj?gren's syndrome[J]. Front Immunol,2022,13:922871. DOI:10.3389/fimmu.2022.922871.
ZHANG M Z,IWATA S,HAJIME M,et al. Methionine commits cells to differentiate into plasmablasts through epigenetic regulation of BTB and CNC homolog 2 by the methyltransferase EZH2[J]. Arthritis Rheumatol,2020,72(7):1143-1153. DOI:10.1002/art.41208.
ZHEN Y X,SMITH R D,FINKELMAN F D,et al. Ezh2-mediated epigenetic modification is required for allogeneic T cell-induced lupus disease[J]. Arthritis Res Ther,2020,22(1):133. DOI:10.1186/s13075-020-02225-9.
ZHOU J,HUANG S,WANG Z Y,et al. Targeting EZH2 histone methyltransferase activity alleviates experimental intestinal inflammation[J]. Nat Commun,2019,10(1):2427. DOI:10.1038/s41467-019-10176-2.
DISANO K D,GILLI F,PACHNER A R. Memory B cells in multiple sclerosis:emerging players in disease pathogenesis[J]. Front Immunol,2021,12:676686. DOI:10.3389/fimmu.2021.676686.
SANZ I,WEI C,JENKS S A,et al. Challenges and opportunities for consistent classification of human B cell and plasma cell populations[J]. Front Immunol,2019,10:2458. DOI:10.3389/fimmu.2019.02458.
ZHAO N,WANG Z Z,CUI X J,et al. In vivo inhibition of microRNA-326 in a NOD.H-2h4 mouse model of autoimmune thyroiditis[J]. Front Immunol,2021,12:620916. DOI:10.3389/fimmu.2021.620916.
HAUSER S L,BAR-OR A,COHEN J A,et al. Ofatumumab versus teriflunomide in multiple sclerosis[J]. N Engl J Med,2020,383(6):546-557. DOI:10.1056/NEJMoa1917246.
HAUSER S L,BAR-OR A,COMI G,et al. Ocrelizumab versus interferon beta-1a in relapsing multiple sclerosis[J]. N Engl J Med,2017,376(3):221-234. DOI:10.1056/NEJMoa1601277.
RINGROSE L,PARO R. Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins[J]. Annu Rev Genet,2004,38:413-443. DOI:10.1146/annurev.genet.38.072902.091907.
HERVIOU L,CAVALLI G,CARTRON G,et al. EZH2 in normal hematopoiesis and hematological malignancies[J]. Oncotarget,2016,7(3):2284-2296. DOI:10.18632/oncotarget.6198.
KIM J,LEE Y,LU X D,et al. Polycomb- and methylation-independent roles of EZH2 as a transcription activator[J]. Cell Rep,2018,25(10):2808-2820.e4. DOI:10.1016/j.celrep.2018.11.035.
ZHANG X L,WANG Y,YUAN J,et al. Macrophage/microglial Ezh2 facilitates autoimmune inflammation through inhibition of Socs3[J]. J Exp Med,2018,215(5):1365-1382. DOI:10.1084/jem.20171417.
TSOU P S,COIT P,KILIAN N C,et al. EZH2 modulates the DNA methylome and controls T cell adhesion through junctional adhesion molecule A in lupus patients[J]. Arthritis Rheumatol,2018,70(1):98-108. DOI:10.1002/art.40338.
WU L L,JIANG X Y,QI C J,et al. EZH2 inhibition interferes with the activation of type I interferon signaling pathway and ameliorates lupus nephritis in NZB/NZW F1 mice[J]. Front Immunol,2021,12:653989. DOI:10.3389/fimmu.2021.653989.
DUAN R,DU W F,GUO W J. EZH2:a novel target for cancer treatment[J]. J Hematol Oncol,2020,13(1):104. DOI:10.1186/s13045-020-00937-8.
(收稿日期:2023-08-20;修回日期:2023-12-10)
(本文編辑:赵跃翠)

