颅咽管瘤相关下丘脑性肥胖危险因素及饮食运动干预研究进展
任英 汪潮湖 张南南 包贇 漆松涛 邓瑛瑛
基金项目:南方医科大学南方医院院长基金(2021H001)
引用本文:任英,汪潮湖,张南南,等. 颅咽管瘤相关下丘脑性肥胖危险因素及饮食运动干预研究进展[J]. 中国全科医学,2024,27(21):2672-2678. DOI:10.12114/j.issn.1007-9572.2022.0725.[www.chinagp.net]
REN Y,WANG C H,ZHANG N N,et al. Recent advances in diet and exercise interventions towards craniopharyngioma-related hypothalamic obesity[J]. Chinese General Practice,2024,27(21):2672-2678.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 颅咽管瘤相关下丘脑性肥胖已成为颅咽管瘤患者术后管理中的重要问题。有研究指出通过调整热量摄入、制订并实施运动计划能显著降低颅咽管瘤相关下丘脑性肥胖患者体质量,可将非药物治疗措施如饮食运动干预应用于颅咽管瘤患者的体质量管理中,但目前国内相关研究较少。因此,本文综述了颅咽管瘤相关下丘脑性肥胖现状、危害、危险因素和饮食运动干预策略,以期改善疾病预后、提高生存质量。建议临床医护人员应重视颅咽管瘤患者相关下丘脑性肥胖,开展颅咽管瘤相关下丘脑性肥胖患者体质量控制的前瞻性研究,并构建科学严谨的饮食运动干预方案,为全面提高颅咽管瘤患者的生存质量提供参考。
【关键词】 颅咽管瘤;下丘脑性肥胖;饮食运动干预;体质指数;综述
【中图分类号】 R 739.41 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2022.0725
Recent Advances in Diet and Exercise Interventions towards Craniopharyngioma-related Hypothalamic Obesity
REN Ying,WANG Chaohu,ZHANG Nannan,BAO Yun,QI Songtao,DENG Yingying*
Department of Neurosurgery,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China
*Corresponding author:DENG Yingying,Associate chief nurse;E-mail:13560359661@139.com
【Abstract】 Craniopharyngioma-related hypothalamic obesity(CHO) has become a key issue in postoperative management of craniopharyngioma. Modified low calorie diet and exercise interventions have been found by some studies to be effective in relieving CHO,and suggested to be used as non-pharmacological treatments for weight management of craniopharyngioma patients. However,there are few relevant studies in China. We reviewed the latest developments in prevalence,hazards and risk factors as well as diet and exercise interventions towards CHO,in order to improve the outcomes and quality of life of CHO patients. In addition,we put forward recommendations on comprehensively improving the quality of life of CHO patients,such as making efforts to value CHO clinically,carrying out prospective studies on weight control in CHO,and developing rigorous diet and exercise interventions.
【Key words】 Craniopharyngioma;Hypothalamic obesity;Diet and exercise intervention;Body mass index;Review
颅咽管瘤是起源于Rathke's囊的残存组织或化生而来的良性上皮性肿瘤,但由于其位置深在且生长方式复杂,常累及下丘脑、视交叉、垂体柄等重要结构,术后常出现内分泌代谢障碍、水电解质紊乱、认知功能障碍、下丘脑性肥胖等下丘脑-垂体功能障碍[1]。其中,下丘脑性肥胖是由于肿瘤侵袭、手术损伤等因素导致患者下丘脑受损,维持能量代谢平衡的相关神经元及其环路破坏,引起食欲亢进和体质量显著增加的综合征[2]。颅咽管瘤相关下丘脑性肥胖发生率在8.5%~82.7%[3-5],平均BMI在25.9~30.0 kg/m2[6-7],发生率高且程度严重,已成为颅咽管瘤患者术后管理中的重要问题。颅咽管瘤相关下丘脑性肥胖虽非直接致命,但体质量过度增加会严重降低患者生活质量,增加睡眠呼吸暂停综合征、代謝综合征、心血管疾病以及猝死风险[8],为间接致死性肥胖。此外,超重和肥胖导致的体相改变影响患者日常活动并使其产生自卑情绪,研究表明颅咽管瘤相关下丘脑性肥胖患儿相比于同龄儿童适应行为较差,包括运动、日常生活、社交和沟通等多方面[9]。目前,针对颅咽管瘤下相关丘脑性肥胖减重治疗的探索多集中于外科手术和药物治疗[10-12],但由于长期体质量控制效果尚不明确以及行减肥手术受制于伦理等因素,暂无治疗方式被普遍接受并广泛应用于颅咽管瘤患者的体质量管理中。有研究指出通过调整热量摄入、制订并实施运动计划能显著降低颅咽管瘤相关下丘脑性肥胖患者体质量[9,13],可将非药物治疗措施如饮食运动干预应用于颅咽管瘤患者的体质量管理中。因此,本文综述了颅咽管瘤相关下丘脑性肥胖现状、危害、危险因素和饮食运动干预策略等内容,以期为临床实践提供指导。
文献检索策略:在中国知网、万方数据知识服务平台、PubMed等中英文数据库中检索,中文检索词包括“颅咽管瘤、下丘脑性肥胖、饮食运动干预”,英文检索词包括“craniopharyngioma、hypothalamic obesity、diet and exercise intervention”,檢索时间为建库至2022-05-31。文献纳入标准:涉及颅咽管瘤相关下丘脑性肥胖危险因素和饮食运动干预的临床研究、综述、Meta分析。排除标准:与研究主题无关、无法获得全文及质量较差的文献。
1 颅咽管瘤相关下丘脑性肥胖现状及危害
1.1 颅咽管瘤相关下丘脑性肥胖现状
前期研究结果显示,颅咽管瘤相关下丘脑性肥胖与下丘脑损伤程度、发病年龄及术前BMI、患者饮食行为及运动频率、家庭环境等因素相关。目前,国内外学者针对颅咽管瘤相关下丘脑性肥胖的判断标准暂未统一。VAN IERSEL等[14]将成年颅咽管瘤患者BMI>30 kg/m2定义为下丘脑性肥胖、BMI>40 kg/m2为严重肥胖,针对儿童和青少年颅咽管瘤患者,下丘脑性肥胖则定义为BMI大于同年龄、同性别人群BMI的2倍标准差。考虑到不同人种之间身高、体质量情况存在差异,国内学者选择不同界定值,包括以BMI>25 kg/m2[3]、BMI>28 kg/m2[15]等为标准开展研究。在今后的研究中,研究者可根据中国肥胖工作组提出的BMI>24 kg/m2为超重、BMI>28 kg/m2为肥胖[16]进行界定,详细报告颅咽管瘤术后患者体质量情况。
国内外报道的颅咽管瘤相关下丘脑性肥胖发生率在8.5%~82.7%[3-5],平均BMI在25.9~30.0 kg/m2[6-7]。受颅咽管瘤挤压、炎症等影响,部分患者在术前即可出现下丘脑性肥胖。一项针对120例成年颅咽管瘤患者的调查研究显示,下丘脑性肥胖发生率术前为19.2%,术后增至29.2%[6]。其中,儿童患者常在术后6个月内BMI快速增加,成年患者常在术后1年内出现超重和肥胖[2]。据报道,患者术后体质量随时间变化明显增加,在两项长达10年的临床研究中,分别有45%[17]和54.3%[14]的颅咽管瘤患者在随访结束时发展为下丘脑性肥胖。
与此同时,部分学者详细报告了颅咽管瘤相关下丘脑性肥胖的严重程度。WU等[6]研究显示,40.8%的患者在随访期间内体质量增加≥5%,随访结束时该部分患者平均体质量增幅达17.59%,平均BMI为25.9 kg/m2。ANDEREGGEN等[17]对32例颅咽管瘤患者随访10年的研究结果显示,该组患者术后平均BMI为28.4 kg/m2,平均每年增加0.48 kg/m2,其中45%的患者BMI≥30 kg/m2,另有两例患者出现严重肥胖,BMI≥35 kg/m2。相比于前者的研究结果,茅江峰等[7]所调查的下丘脑性肥胖患者平均BMI高达30 kg/m2。在一项针对110例下丘脑损伤患者的随访研究中,超重或肥胖(BMI>25 kg/m2)高达82.7%,肥胖(BMI>30 kg/m2)占比57.2%,严重肥胖(BMI>40 kg/m2)达14.5%[4]。从已有研究可以得出,颅咽管瘤相关下丘脑性肥胖的发生率较高,是常见病理状况,易发展为肥胖和严重肥胖,早期干预并有效控制体质量增加十分重要。
1.2 颅咽管瘤相关下丘脑性肥胖危害
随着手术技术和影像学检查的不断进步,颅咽管瘤患者的生存率有效提高,但肥胖这一问题严重影响患者的长期生活质量。多项研究证实,超重和肥胖是心血管疾病、2型糖尿病以及癌症等非传染性疾病的危险因素[16]。ERFURTH等[18]通过对多项大样本队列研究进行综述后得出,颅咽管瘤患者发生心血管疾病的死亡率是正常人群的3~19倍。一项针对1 014例垂体功能减退患者开展的队列研究结果显示,在排除术后1个月内死亡的患者后,相比于垂体瘤患者,颅咽管瘤患者死亡率可高达9倍,且两组患者死亡的具体原因(即呼吸系统疾病、心血管系统疾病)无差异,可能与颅咽管瘤组下丘脑损伤程度、代谢异常并由此导致的肥胖密切相关[19]。WIJNEN等[20]在1987—2014年开展的队列研究同样证实了这一观点,颅咽管瘤患者患2型糖尿病、脑梗死、总死亡率和因循环和呼吸系统疾病死亡的风险较高,肥胖是增加死亡率的重要危险因素。
与此同时,有研究表明患者肥胖程度越重,其遭受的偏见和歧视行为更为严重,且对自身的态度更消极[21]。在一项个案报道中,颅咽管瘤相关下丘脑性肥胖患儿惧怕因肥胖遭受他人歧视,拒绝参加户外活动[13]。一项横断面调查结果显示,颅咽管瘤相关下丘脑性肥胖患儿在运动、日常生活、社交和沟通等多方面表现比同龄儿童较差[9]。从上述两项研究可以看出,肥胖危害颅咽管瘤术后患者心理健康,影响其社会适应能力。此外,当严重肥胖时,患者肢体活动受限,并因此形成“肥胖-活动减少-肥胖加重”的恶性循环,进而发展为生活不能自理[13]。颅咽管瘤的2个发病高峰期为5~9岁和55~69岁[22],分别对应学习和退休2个阶段,良好的生活自理和社会适应能力对于患者重新进入学校或转变自身角色尤为关键。因此,及时识别出颅咽管瘤相关下丘脑性肥胖高危人群并提供有效干预,对降低下丘脑性肥胖发生率、提高颅咽管瘤术后患者生存质量具有十分重要的意义。目前欧美国家针对颅咽管瘤患者开展的长期随访较多,今后可开展针对亚洲人群的大样本研究,以全面探讨亚洲人群中颅咽管瘤相关下丘脑性肥胖患者术后生存质量。
2 颅咽管瘤术后患者下丘脑性肥胖发病影响因素
2.1 下丘脑损伤程度
前期研究发现,颅咽管瘤相关下丘脑性肥胖的形成因素离散,其发生发展由下丘脑损伤这一因素主导。导致颅咽管瘤患者下丘脑损伤主要有两方面原因,一是肿瘤本身因素,二是治疗相关因素。为评估患者的预后,多位学者根据影像学结果对下丘脑损伤程度进行分级[23-25]。其中,PUGET等[23]将术前和术后各分为3级,但李子吉[15]研究结果显示,Puget分级为2级的颅咽管瘤患者术后永久性尿崩症发生率较高,但下丘脑性肥胖发生率的差异无明显统计学意义,可能与Puget分级未与众多核团直接联系有关,因此单纯采用Puget分级进行预测下丘脑性肥胖不可取。此外,漆松涛[26]根据术前核磁共振成像(MRI)和术中所见判断肿瘤与下丘脑结构的关系:(1)0度,无下丘脑受累及,MRI扫描肿瘤后缘锐利,矢状位肿瘤后上部与抬高的三脑室底间可见蛛网膜下腔间隙,肿瘤与下丘脑间为毗邻关系。(2)1度,下丘脑受压移位但下丘脑乳头体等结构仍可辨认,MRI显示肿瘤后上部与脑室壁间分界不清,肿瘤囊壁与三脑室壁间无明显的分界面,粘连紧密。(3)2度,明显的下丘脑损害(下丘脑结构难以辨认),MRI扫描发现肿瘤后上部与脑室壁间结构毛糙并出现肿瘤边缘条索状强化影,肿瘤与下丘脑结构有交叉性生长关系。分级越高代表下丘脑累及程度越严重,可用于指导评估下丘脑损伤程度及患者预后。
2.1.1 肿瘤原发因素:多项研究表明,颅咽管瘤患者肿瘤的位置、大小、类型与下丘脑性肥胖的严重程度相关,肿瘤累及下丘脑后方、前部、内侧、第三脑室底部和乳头体,以及病理分型为造釉型颅咽管瘤的患者体质量增加較为明显[24,27-28]。根据肿瘤起源位置和周边膜性结构分布规律,颅咽管瘤可分为鞍膈下型(Q型)、鞍上三脑室外型(S型)及三脑室底内型(T型)3种类型[29],其中T型颅咽管瘤常占据第三脑室间,该型颅咽管瘤患者术后下丘脑性肥胖程度更为严重,而Q型和S型颅咽管瘤累及下丘脑程度较轻,严重肥胖发生率相对较低[30]。
2.1.2 治疗方式及并发症:目前,手术是颅咽管瘤最主要的治疗方式。有研究指出,相比于颅咽管瘤次全切术,全切术后患者下丘脑性肥胖的发生率明显增高[14]。然而,因肿瘤未根治性切除导致复发将会给二次治疗带来极大风险,故肥胖亦难免,为降低肿瘤复发率,通常在保护下丘脑功能前提下的肿瘤全切除是治疗的首选。与此同时,随着内镜设备和技术的发展,内镜经鼻蝶入路(endoscopic endonasal approach,EEA)因具有可清晰地辨认肿瘤、垂体柄、下丘脑等结构,以及便于直视下行显微分离等优势,在颅咽管瘤手术治疗中得到推广应用。在一项针对113例行EEA切除颅咽管瘤患者的研究显示,术后肥胖发生率为23%[31]。一项回顾性研究对比了开颅和扩大经蝶入路两种术式对颅咽管瘤患者术后体质量的影响,结果显示两组患者术后肥胖发生率、严重肥胖发生率、平均BMI、BMI变化百分比均无显著差异[32]。但该研究样本量较小,仅59例,有必要在今后的研究中进一步探索不同手术入路间下丘脑性肥胖发生率。对于粘连严重、全切除困难的颅咽管瘤,有研究者采用次全切加放疗的策略,以保护下丘脑。ELOWE-GRUAU等[33]开展的前后对照显示,与全切术相比,次全切结合放疗组患者平均BMI较低、严重肥胖发生率低且重复手术次数无差异,该研究者也指出这可能与该组的随访时间较短有关。另一项研究结果与之相反,接受次全切结合放疗的颅咽管瘤患者复发率较低,而肥胖发生率更高[34]。针对这一差异,研究者有必要在前期研究的基础上收集随访数据,以明确颅咽管瘤的最佳治疗方案。值得注意的是,放疗可能引起肿瘤周围的下丘脑、视交叉、腺垂体、垂体柄等相邻部位的损伤[1],可采用立体定向放射治疗可精确定位肿瘤,降低周围正常结构的放射性损伤。一项采用立体定向囊内放疗治疗颅咽管瘤的研究纳入了141例颅咽管瘤患者,随访结果显示肥胖的发生率为8.5%[5]。但由于该研究仅纳入囊性颅咽管瘤患者,限制其研究结果的推广,仍需进一步临床对照研究以探究放疗对下丘脑性肥胖的影响。此外,由于术中易损伤下丘脑、垂体柄等重要结构,可导致内分泌功能障碍,其中中枢性尿崩症较为常见。在一项针对661例儿童脑肿瘤患者的随访研究结果显示,33.1%的患者体质量显著增加,其中尿崩症与体质量增加具有相关性[35]。另一项研究得出相同结论,尿崩症是颅咽管瘤术后下丘脑性肥胖的预测因素之一,研究者指出这可能与尿崩症提示下丘脑损伤、而下丘脑损伤是肥胖发生的主导因素有关[36]。在今后的研究中,可重点关注尿崩症的发生情况,以早期识别、干预颅咽管瘤术后下丘脑性肥胖。
2.2 发病年龄和术前BMI
除下丘脑损伤程度外,颅咽管瘤相关下丘脑性肥胖还受多种因素影响,包括发病年龄和术前BMI等。在发病年龄方面,儿童颅咽管瘤患者术后下丘脑性肥胖发病率显著高于成年人,其中起病年龄<10岁的颅咽管瘤患者术后肥胖、失明和垂体功能减退的发生率更高[37]。GUO等[38]回顾性分析了335例颅咽管瘤术后患者资料发现,在手术方式无差异的前提下,儿童组术后下丘脑性肥胖发病率为87.5%,显著高于成年人组的55.5%。GAUTIER等[37]在法国开展的多中心研究同样证实了这点,起病年龄<10岁的颅咽管瘤患者其术后肥胖、失明和垂体功能减退的发生率更高。此外,有学者开展颅咽管瘤相关下丘脑性肥胖预测工具的探索性研究后指出,颅咽管瘤患者术前BMI>26.08 kg/m2为预测术后下丘脑性肥胖发生的最佳临界值[6]。该研究也指出术前即出现肥胖的颅咽管瘤患者术后体质量并未出现明显增加,可能与其术前下丘脑已受到瘤性损害,体质量增加达到平台期有关,这与另一研究结果相似[39]。然而,这一结论目前存在争议,有研究指出术前BMI与术后体质量增加并无相关性[24],需要进一步大样本研究验证两者关系。
2.3 患者饮食行为及运动频率
饮食行为和运动频率改变导致的能量摄入过多与消耗降低,也是颅咽管瘤患者体质量增加的原因之一。由于颅咽管瘤术后代谢相关并发症,包括空腹血糖、瘦素、胃饥饿素水平异常,常导致患者出现食欲调节紊乱,其在饱腹状态下看到高热量食物图片时,脑功能MRI中内侧眶额皮质的神经活动比健康对照组更为明显[40]。HSU等[41]报道了1例儿童期起病的颅咽管瘤患者在全切术后出现病态饮食行为,包括经常抱怨饥饿、半夜寻找食物、偷食物和囤积食物。HOFFMANN等[42]对101例儿童期起病的颅咽管瘤患者进行调查后发现,相比于正常体质量和中度肥胖的颅咽管瘤患者,在严重肥胖的颅咽管瘤患者中病态饮食行为出现频率更高,表明颅咽管瘤相关下丘脑性肥胖与其生理结构及功能改变有关。
在运动频率方面,HARZ等[43]对比27例颅咽管瘤患者与1 027名普通人1周内的饮食和活动情况后发现,颅咽管瘤相关下丘脑性肥胖患者日常活动量明显降低,体质量增加可能与其活动量明显降低相关,MULLER等[44]的研究同样支持这一观点。颅咽管瘤患者日常活动量降低可能由日间嗜睡、昼夜节律紊乱等因素导致。多次小睡睡眠潜伏期试验结果显示,81.8%的颅咽管瘤患者出现日间过度嗜睡,相比于普通肥胖患者,颅咽管瘤相关下丘脑性肥胖患者日间嗜睡程度得分更高[45]。M?LLER[46]研究发现,颅咽管瘤患者夜间褪黑素水平下降是导致日间嗜睡和昼夜节律紊乱的原因。此外,神经和视觉缺陷[47-48]、社会心理障碍[49]等因素也可导致患者活动量降低。
2.4 家庭环境
颅咽管瘤相关下丘脑性肥胖的发生由病理因素主导,但有研究指出家庭环境对控制体质量增长也极为重要。儿童时期超重和肥胖的发展是由不同影响因素共同作用产生的结果,包括个人、社会、环境各个层面[50]。环境因素如体育活动设施、获得健康或不健康食品的便利程度影响儿童的饮食行为特征,如对食物的反应和饮食偏好等,从而对肥胖形成产生影响[51]。在1例颅咽管瘤相关下丘脑性肥胖的个案报道中[13],由于患者家人不健康的饮食习惯、锻炼区域受限以及患者父母允许摄入过量食物等因素影响,该患者出现难以控制的体质量增长并入院接受减重治疗。住院期间内严格执行饮食和锻炼方案后体质量显著下降,但出院后体质量再次增加。该案例表明制订合理的饮食和日常活动方案,将单纯的放任式管理转变为积极主动、目的明确的居家护理模式,对于颅咽管瘤患者维持体质量合理增长有重要
意义。
3 饮食运动干预研究现状
3.1 饮食运动干预形式及内容
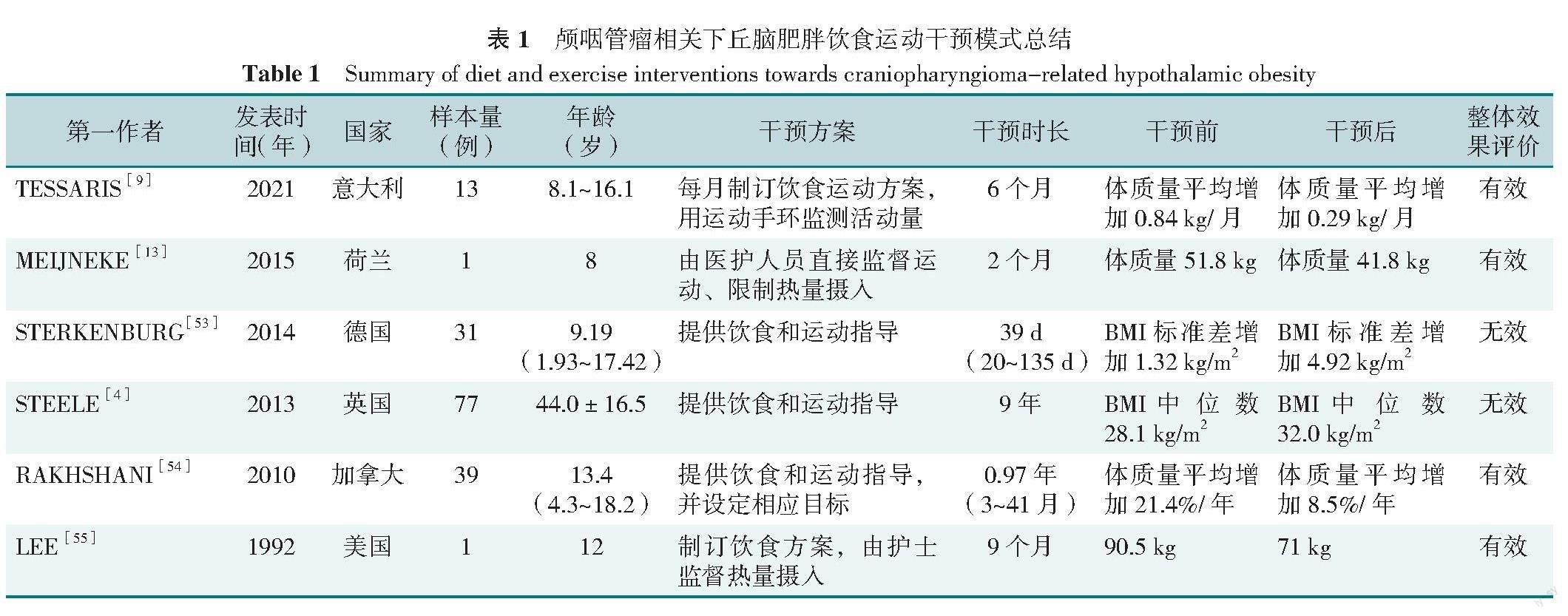
为治疗颅咽管瘤相关下丘脑性肥胖,有学者采用腹腔镜下可调节胃束带术、Roux-en-Y胃分流术、胆胰分流术、袖状胃切除术和催产素等外科和药物干预方式,在短期内取得一定成效,但长期体质量控制效果尚不明确[52]。与此同时,行减肥手术需重点考量伦理因素,因此并无被普遍接受并广泛应用于颅咽管瘤患者体质量控制的治疗方式。为多途径控制患者体质量,国外学者尝试将非药物治疗措施如饮食运动干预应用于颅咽管瘤患者的体质量管理[4,9,13,53-55](表1)。TESSARIS等[9]通过组建包括儿童内分泌、营养学、心理、运动医学等在内的多学科团队,对患者进行膳食、身心和运动评估,并构建基于评估数据制订个性化饮食方案、采用加速计进行活动监测、辅以心理评估的综合治疗方案,该方案实施6个月后患者体质量增幅明显下降。在一项个案报道中,研究者同样运用多学科团队制订综合性饮食和运动干预方案的方式,将允许患者过度进食调整为限制每日热量摄入并1周运动3次,在严格执行该方案期间内患者的体质量增长得到有效控制[13]。在英国[4]和加拿大[54],有医院分别通过内分泌专科门诊和多学科门诊为下丘脑性肥胖患者提供综合指导,在测量每位患者体质量指标以及患者提供近期饮食和活动情况的基础上提供调整饮食和运动的建议,目标是通过逐步控制饮食摄入量和提高锻炼强度控制体质量增长。此外,有研究证实依托互联网提供饮食和运动指导,在控制代谢手术肥胖患者的体质量增长中有一定的效果[56],今后可考虑引入此模式应用于颅咽管瘤相关下丘脑性肥胖患者管理中,提供即时、个性化、全方位的医疗指导。
3.2 饮食运动干预有效性
目前,饮食运动干预策略在控制颅咽管瘤患者体质量的疗效尚未达成共识。部分研究结果显示,传统的生活方式干预如调整饮食和加强运动对控制下丘脑性肥胖的效果并不理想[4,53],可能是因为饮食及运动治疗无法从根本上恢复机体能量分解代谢水平。相反的是,也有研究指出通过调整热量摄入、制订并实施运动计划能显著降低颅咽管瘤相关下丘脑性肥胖患者体质量[9,13,54-55]。从整体而言,通过严格限制热量摄入、完成设定运动目标能够取得良好的体质量控制效果,其有效性与干预方案执行力度、患者依从性、干预方案的可持续性等因素有关。相比于药物和手术治疗,饮食和运动干预无创、易于推广且更为经济。尽管饮食运动干预策略效果不尽人意,但干预实施过程中有利于全程随访患者病情变化,并及时给予相应支持。定期随访监测并与患者家属充分沟通,对颅咽管瘤相关下丘脑性肥胖患者的随访治疗产生积极影响[57]。
4 小结
本文总结了颅咽管瘤相关下丘脑性肥胖现状、危害、危险因素和饮食运动干预策略等内容,为该群体的体质量管理提供参考资料。受颅咽管瘤患者这一群体人数相对较少以及下丘脑性肥胖成因极其复杂等因素影响,现有研究仍存在一些局限。首先,目前围绕下丘脑性肥胖饮食运动干预研究的样本多来自某一单中心,样本例数较少,且大多为回顾性研究,限制了研究结果的推广,今后有条件可开展多中心、前瞻性的随机对照研究进一步验证研究结论;其次,开展饮食运动干预时需重点考虑患者及其家属的依从性,构建严谨的干预方案和保证干预方案的良好执行同样重要。
作者贡献:任英负责文章的构思与设计、论文撰写;汪潮湖、包贇负责论文的修訂及审校;张南南负责资料的收集与整理;漆松涛、邓瑛瑛负责最终版本修订,对论文负责。
本文无利益冲突。
参考文献
中华医学会神经外科学分会小儿神经外科学组,颅咽管瘤治疗专家共识编写委员会. 颅咽管瘤治疗专家共识(2016)[J]. 中华医学杂志,2017,97(17):1283-1289. DOI:10.3760/cma.j.issn.0376-2491.2017.17.002.
颅咽管瘤治疗专家共识编写委员会,中华医学会神经外科学分会小儿神经外科学组. 颅咽管瘤患者长期内分泌治疗专家共识(2017)[J]. 中华医学杂志,2018,98(1):11-18. DOI:10.3760/cma.j.issn.0376-2491.2018.01.004.
SHI X E,ZHOU Z Q,WU B,et al. Outcome of radical surgical resection for craniopharyngioma with hypothalamic preservation:a single-center retrospective study of 1054 patients[J]. World Neurosurg,2017,102:167-180. DOI:10.1016/j.wneu.2017.02.095.
STEELE C A,CUTHBERTSON D J,MACFARLANE I A,et al. Hypothalamic obesity:prevalence,associations and longitudinal trends in weight in a specialist adult neuroendocrine clinic[J]. Eur J Endocrinol,2013,168(4):501-507. DOI:10.1530/EJE-12-0792.
于新,胡晨浩,张剑宁,等. 立体定向囊内放射治疗囊性颅咽管瘤的远期疗效[J]. 中华神经外科杂志,2017,33(11):1119-1123. DOI:10.3760/cma.j.issn.1001-2346.2017.11.009.
WU W,SUN Q Y,ZHU X M,et al. Risk factors for hypothalamic obesity in patients with adult-onset craniopharyngioma:a consecutive series of 120 cases[J]. Front Endocrinol (Lausanne),2021,12:694213. DOI:10.3389/fendo.2021.694213.
茅江峰,王曦,熊舒煜,等. 重组人生长激素替代治疗对颅咽管瘤术后成人患者代谢指标的影响[J]. 中华医学杂志,2017,97(42):3286-3290. DOI:10.3760/cma.j.issn.0376-2491.2017.42.003.
M?LLER H L. Craniopharyngioma and hypothalamic injury[J]. Curr Opin Endocrinol Diabetes Obes,2016,23(1):81-89. DOI:10.1097/med.0000000000000214.
TESSARIS D,MATARAZZO P,TULI G,et al. Multidisciplinary approach for hypothalamic obesity in children and adolescents:a preliminary study[J]. Children (Basel),2021,8(7):531. DOI:10.3390/children8070531.
LOMENICK J P,BUCHOWSKI M S,SHOEMAKER A H. A 52-week pilot study of the effects of exenatide on body weight in patients with hypothalamic obesity[J]. Obesity (Silver Spring),2016,24(6):1222-1225. DOI:10.1002/oby.21493.
M?LLER H L. Bariatric interventions in craniopharyngioma patients-best choice or last option for treatment of hypothalamic obesity? [J]. J Clin Endocrinol Metab,2022,107(1):e426-428. DOI:10.1210/clinem/dgab567.
NI W M,SHI X E. Interventions for the treatment of craniopharyngioma-related hypothalamic obesity:a systematic review[J]. World Neurosurg,2018,118:e59-71. DOI:10.1016/j.wneu.2018.06.121.
MEIJNEKE R W,SCHOUTEN-VAN MEETEREN A Y,DE BOER N Y,et al. Hypothalamic obesity after treatment for craniopharyngioma:the importance of the home environment[J]. J Pediatr Endocrinol Metab,2015,28(1/2):59-63. DOI:10.1515/jpem-2014-0338.
VAN IERSEL L,MEIJNEKE R W H,SCHOUTEN-VAN MEETEREN A Y N,et al. The development of hypothalamic obesity in craniopharyngioma patients:a risk factor analysis in a well-defined cohort[J]. Pediatr Blood Cancer,2018,65(5):e26911. DOI:10.1002/pbc.26911.
李子吉. 顱咽管瘤患者下丘脑损伤puegt分级术后并发症相关性研究[D]. 青岛:青岛大学,2021.
PAN X F,WANG L M,PAN A. Epidemiology and determinants of obesity in China[J]. Lancet Diabetes Endocrinol,2021,9(6):373-392. DOI:10.1016/S2213-8587(21)00045-0.
ANDEREGGEN L,HESS B,ANDRES R,et al. A ten-year follow-up study of treatment outcome of craniopharyngiomas[J]. Swiss Med Wkly,2018,148:w14521. DOI:10.4414/smw.2018.14521.
ERFURTH E M,HOLMER H,FJALLDAL S B. Mortality and morbidity in adult craniopharyngioma[J]. Pituitary,2013,
16(1):46-55. DOI:10.1007/s11102-012-0428-2.
TOMLINSON J. Association between premature mortality and hypopituitarism[J]. Lancet,2001,357(9254):425-431. DOI:10.1016/S0140-6736(00)04006-X.
WIJNEN M,OLSSON D S,VAN DEN HEUVEL-EIBRINK M M,et al. Excess morbidity and mortality in patients with craniopharyngioma:a hospital-based retrospective cohort study[J]. Eur J Endocrinol,2018,178(1):93-102. DOI:10.1530/EJE-17-0707.
王传翠,赖金玲,钱珊珊. 肥胖人群相关病耻感的研究进展[J]. 护理研究,2018,32(13):2001-2005. DOI:10.12102/j.issn.1009-6493.2018.13.003.
MOMIN A A,RECINOS M A,CIOFFI G,et al. Descriptive epidemiology of craniopharyngiomas in the United States[J]. Pituitary,2021,24(4):517-522. DOI:10.1007/s11102-021-01127-6.
PUGET S,GARNETT M,WRAY A,et al. Pediatric craniopharyngiomas:classification and treatment according to the degree of hypothalamic involvement[J]. J Neurosurg,2007,106(1 Suppl):3-12. DOI:10.3171/ped.2007.106.1.3.
ROTH C L,ESLAMY H,WERNY D,et al. Semiquantitative analysis of hypothalamic damage on MRI predicts risk for hypothalamic obesity[J]. Obesity (Silver Spring),2015,
23(6):1226-1233. DOI:10.1002/oby.21067.
DE VILE C J,GRANT D B,HAYWARD R D,et al. Obesity in childhood craniopharyngioma:relation to post-operative hypothalamic damage shown by magnetic resonance imaging[J]. J Clin Endocrinol Metab,1996,81(7):2734-2737. DOI:10.1210/jcem.81.7.8675604.
漆松濤. 颅咽管瘤[M]. 北京:人民卫生出版社,2018:259-260.
M?LLER H L,GEBHARDT U,FALDUM A,et al. Xanthogranuloma,Rathke's cyst,and childhood craniopharyngioma:results of prospective multinational studies of children and adolescents with rare sellar malformations[J]. J Clin Endocrinol Metab,2012,97(11):3935-3943. DOI:10.1210/jc.2012-2069.
VAN GOMPEL J J,NIPPOLDT T B,HIGGINS D M,et al. Magnetic resonance imaging-graded hypothalamic compression in surgically treated adult craniopharyngiomas determining postoperative obesity[J]. Neurosurg Focus,2010,28(4):E3. DOI:10.3171/2010.1.FOCUS09303.
LIU Y,QI S T,WANG C H,et al. Pathological relationship between adamantinomatous craniopharyngioma and adjacent structures based on QST classification[J]. J Neuropathol Exp Neurol,2018,77(11):1017-1023. DOI:10.1093/jnen/nly083.
HU W F,QIU B H,MEI F,et al. Clinical impact of craniopharyngioma classification based on location origin:a multicenter retrospective study[J]. Ann Transl Med,2021,
9(14):1164. DOI:10.21037/atm-21-2924.
童志高. 内镜经鼻蝶入路治疗颅咽管瘤的远期随访结果研究[D]. 南昌:南昌大学,2021.
GALLOTTI A L,BARZAGHI L R,ALBANO L,et al. Comparison between extended transsphenoidal and transcranial surgery for craniopharyngioma:focus on hypothalamic function and obesity[J]. Pituitary,2022,25(1):74-84. DOI:10.1007/s11102-021-01171-2.
ELOWE-GRUAU E,BELTRAND J,BRAUNER R,et al. Childhood craniopharyngioma:hypothalamus-sparing surgery decreases the risk of obesity[J]. J Clin Endocrinol Metab,2013,98(6):2376-2382. DOI:10.1210/jc.2012-3928.
SARKAR S,CHACKO S R,KORULA S,et al. Long-term outcomes following maximal safe resection in a contemporary series of childhood craniopharyngiomas[J]. Acta Neurochir
(Wien),2021,163(2):499-509. DOI:10.1007/s00701-020-04591-4.
VAN SCHAIK J,VAN ROESSEL I M A A,SCHOUTEN-VAN MEETEREN N A Y N,et al. High prevalence of weight gain in childhood brain tumor survivors and its association with hypothalamic-pituitary dysfunction[J]. J Clin Oncol,2021,39(11):1264-1273. DOI:10.1200/JCO.20.01765.
YUEN K C,KOITOWSKA-H?GGSTR?M M,COOK D M,et al. Primary treatment regimen and diabetes insipidus as predictors of health outcomes in adults with childhood-onset craniopharyngioma[J]. J Clin Endocrinol Metab,2014,
99(4):1227-1235. DOI:10.1210/jc.2013-3631.
GAUTIER A,GODBOUT A,GROSHENY C,et al. Markers of recurrence and long-term morbidity in craniopharyngioma:a systematic analysis of 171 patients[J]. J Clin Endocrinol Metab,2012,97(4):1258-1267. DOI:10.1210/jc.2011-2817.
GUO F Y,WANG G Q,SURESH V,et al. Clinical study on microsurgical treatment for craniopharyngioma in a single consecutive institutional series of 335 patients[J]. Clin Neurol Neurosurg,2018,167:162-172. DOI:10.1016/j.clineuro.2018.02.034.
DUAN D,WEHBEH L,MUKHERJEE D,et al. Preoperative BMI predicts postoperative weight gain in adult-onset craniopharyngioma[J]. J Clin Endocrinol Metab,2021,
106(4):e1603-e1617. DOI:10.1210/clinem/dgaa985.
ROTH C L,AYLWARD E,LIANG O,et al. Functional neuroimaging in craniopharyngioma:a useful tool to better understand hypothalamic obesity? [J]. Obes Facts,2012,5(2):243-253. DOI:10.1159/000338695.
HSU E A,MILLER J L,PEREZ F A,et al. Oxytocin and naltrexone successfully treat hypothalamic obesity in a boy post-craniopharyngioma resection[J]. J Clin Endocrinol Metab,2018,103(2):370-375. DOI:10.1210/jc.2017-02080.
HOFFMANN A,POSTMA F P,STERKENBURG A S,et al. Eating behavior,weight problems and eating disorders in 101 long-term survivors of childhood-onset craniopharyngioma[J]. J Pediatr Endocrinol Metab,2015,28(1/2):35-43. DOI:10.1515/jpem-2014-0415.
HARZ K J,M?LLER H L,WALDECK E,et al. Obesity in patients with craniopharyngioma:assessment of food intake and movement counts indicating physical activity[J]. J Clin Endocrinol Metab,2003,88(11):5227-5231. DOI:10.1210/jc.2002-021797.
M?LLER H L,HANDWERKER G,GEBHARDT U,et al. Melatonin treatment in obese patients with childhood craniopharyngioma and increased daytime sleepiness[J]. Cancer Causes Control,2006,17(4):583-589. DOI:10.1007/s10552-005-9012-7.
CRABTREE V M,KLAGES K L,SYKES A,et al. Sensitivity and specificity of the modified epworth sleepiness scale in children with craniopharyngioma[J]. J Clin Sleep Med,2019,15(10):1487-1493. DOI:10.5664/jcsm.7982.
M?LLER H L. Increased daytime sleepiness in patients with childhood craniopharyngioma and hypothalamic tumor involvement:review of the literature and perspectives[J]. Int J Endocrinol,2010,2010:519607. DOI:10.1155/2010/519607.
DRIMTZIAS E,FALZON K,PICTON S,et al. The ophthalmic natural history of paediatric craniopharyngioma:a long-term review[J]. J Neurooncol,2014,120(3):651-656. DOI:10.1007/s11060-014-1600-5.
PRIETO R,PASCUAL J M,BARRIOS L. Optic chiasm distortions caused by craniopharyngiomas:clinical and magnetic resonance imaging correlation and influence on visual outcome[J]. World Neurosurg,2015,83(4):500-529. DOI:10.1016/j.wneu.2014.10.002.
M?LLER H L. Consequences of craniopharyngioma surgery in children[J]. J Clin Endocrinol Metab,2011,96(7):1981-1991. DOI:10.1210/jc.2011-0174.
LIPEK T,IGEL U,GAUSCHE R,et al. Obesogenic environments:environmental approaches to obesity prevention[J]. J Pediatr Endocrinol Metab,2015,28(5/6):485-495. DOI:10.1515/jpem-2015-0127.
OBREG?N A M,PETTINELLI P P,SANTOS J L. Childhood obesity and eating behaviour[J]. J Pediatr Endocrinol Metab,2015,28(5/6):497-502. DOI:10.1515/jpem-2014-0206.
M?LLER H L,MERCHANT T E,WARMUTH-METZ M,et al. Craniopharyngioma[J]. Nat Rev Dis Primers,2019,5(1):75. DOI:10.1038/s41572-019-0125-9.
STERKENBURG A S,HOFFMANN A,GEBHARDT U,et al. Childhood craniopharyngioma with hypothalamic obesity - no long-term weight reduction due to rehabilitation programs[J]. Klin Padiatr,2014,226(6/7):344-350. DOI:10.1055/s-0034-1387747.
RAKHSHANI N,JEFFERY A S,SCHULTE F,et al. Evaluation of a comprehensive care clinic model for children with brain tumor and risk for hypothalamic obesity[J]. Obesity (Silver Spring),2010,18(9):1768-1774. DOI:10.1038/oby.2009.491.
LEE Y J,BACKELJAUW P F,KELLY P D,et al. Successful weight loss with protein-sparing modified fast in a morbidly obese boy with panhypopituitarism,diabetes insipidus,and defective thirst regulation[J]. Clin Pediatr (Phila),1992,31(4):234-236. DOI:10.1177/000992289203100409.
廖婧,印義琼,文曰. 移动互联网技术在代谢手术肥胖患者自我管理中的应用研究进展[J]. 中国护理管理,2019,19(8):1219-1221. DOI:10.3969/j.issn.1672-1756.2019.08.021.
NEMERGUT D R,TOWNSEND A R. The importance of interdisciplinary communication with patients about complex,chronic illnesses:our experiences as parents of a child with a craniopharyngioma[J]. J Pediatr Endocrinol Metab,2015,
28(1/2):3-5. DOI:10.1515/jpem-2014-0445.
(收稿日期:2022-08-26;修回日期:2022-11-20)
(本文编辑:毛亚敏)

