藤椒果实成熟期麻味物质及其挥发性香气组分的变化规律
闫紫玮,谢天芳,王佳琳,尤霜,张家余,2,张逸飞,赵麟,2,朱翔*
1(幺麻子食品股份有限公司,四川 眉山,620360)2(四川幺麻子生物科技有限公司,四川 成都,611430)
藤椒(ZanthoxylumarmatumDC.,学名竹叶花椒),属芸香科(Rutaceae)花椒属(Zanthoxylum)植物,具有独特的“清、香、鲜、麻”风味,同红花椒(Z.bungeanumMaxim.)、青花椒(Z.schinifoliumSieb.Et Zucc.)并称为花椒属调味料“三巨头”,其富含挥发油、酰胺、生物碱、木质素、香豆素等多种活性化合物[1-2],是一种特色的药食同源资源。
目前对藤椒化学成分分析已有多份报道[3-4],其中,以山椒素为代表成分的链状不饱和脂肪酸酰胺类物质,是藤椒麻味的主要来源,其通过介导肉桂醛、辣椒素激活受体而成为主要刺激性物质[5],根据YANG[6]的报道,高温、光照等环境因素会导致羟基-α-山椒素含量下降,从而使麻木、刺痛感觉显著减弱。具有广泛生物活性的山椒素,还可通过线粒体依赖性途径有效抑制细胞生长,发挥抗癌活性;通过靶向作用Aδ机械感受器达到麻醉作用以及通过激活腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)途径改善葡萄糖和脂质代谢[5]。
植物精油含有大量挥发性风味化合物,通过改变细菌细胞膜的通透性,导致细菌细胞内细胞质和电解质大量渗出,从而发挥抗菌活性,也可通过清除超氧阴离子自由基发挥抗氧化活性[7]。与此同时,挥发性化合物作为藤椒芳香气味的主要表征成分,是其品质评价的主要指标[8],而目前研究集中于不同品种[9]、不同产地[8, 10]、不同提取方法[11]藤椒挥发油以及不同加工工艺[12]藤椒油的风味组成和相对含量,对于不同成熟期藤椒风味组分的变化研究相对较少,杜钢等[13]对绵阳藤椒甲醇提取液中的芳樟醇、柠檬烯进行了准确定量分析,发现两者随采收时间的延长均呈现先增加后降低的趋势,并于六月底达到最高含量,分别为14.98、4.87 mg/g。吴素蕊等[14]采用蒸馏法提取重庆花椒精油,结果表明芳樟醇随采收时期的延长而增加,后期伴随乙酸芳樟酯的生成。相较之下,缺乏整个成熟期藤椒麻味和香气变化规律的系统研究,以及对藤椒挥发油中关键风味化合物的探究。
藤椒于每年六月至八月采收,较长的采摘周期使藤椒果实化学成分和生物活性随生长时间而发生变化,尤其是精油挥发性风味化合物,已有研究报道不同成熟期的柠檬果实[15]、枳壳果实[16]精油中柠檬烯含量高低不同,周丽免等[17]表明木姜子果精油中萜烯类物质含量在未成熟期较高,醛类物质在成熟后期逐渐积累。由此可见,藤椒的挥发性风味化合物在不同成熟期具有不同的含量,进而影响产品质量的稳定性,因此根据不同利用目标选择不同成熟期的藤椒,将大大提升藤椒资源的最大化利用。实验以洪雅藤椒——国家地理标志保护产品的四川洪雅止戈镇某藤椒基地的藤椒为研究对象,对比分析了不同成熟期麻味物质及其挥发油香气成分的组成及含量差异,为藤椒的适时采摘提供依据,也为藤椒资源的质量评价标准建立以及藤椒的生产加工提供理论指导。
1 材料与方法
1.1 材料与试剂
羟基-α-山椒素标准品(>98% HPLC),成都普思生物科技股份有限公司;正构烷烃混合标准品(C7~C40,色谱纯);实验用新鲜藤椒样品采自四川省眉山市洪雅县止戈镇某藤椒标准化种植基地,共计9批样品分别于2022年4月21日、5月11日、5月31日、6月20日、6月30日、7月10日、7月20日、7月30日、8月9日采样,编号依次为JD01~JD09。
1.2 仪器与设备
ME-204分析天平,上海梅特勒-托列多仪器有限公司;LG-02高速中药粉粹机,浙江瑞安市百信制药机械有限公司;DIGITAL PRO+超声波清洗器,山东鑫贝西科学仪器有限公司;SHSL调温电热套,上海坤诚科学仪器有限公司;CR-10手持色差仪,柯尼卡美能达;L6S紫外可见分光光度计,上海仪电分析仪器有限公司;1260高效液相色谱仪、8890-5977B气相色谱-质谱联用仪,美国Agilent。
1.3 实验方法
1.3.1 基础指标测试
藤椒色泽、粒径分别采用手持色差仪、粒度计测定。
1.3.2 总酰胺测定
藤椒色泽按照GH/T 1290—2020《花椒及花椒加工产品 花椒酰胺总含量的测定 紫外分光光度法》测定藤椒的酰胺总含量。试样中藤椒酰胺总含量以mg/g表示,按照公式(1)计算:
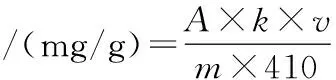
(1)
式中:A,270 nm处测定的吸光度值;v,甲醇稀释样品的体积,mL;k,稀释系数;m,样品质量,g。
1.3.3 羟基-α-山椒素测定
1.3.3.1 样品处理
准确称取5.000 0 g粉碎混匀后的藤椒,加25 mL色谱级甲醇,于超声波中浸提30 min后过滤,滤液转入50 mL棕色容量瓶中定容。制得的样品在进样前稀释10倍后,使用0.22 μm的有机相过滤膜过滤至进样瓶中,-20 ℃冷冻保藏待用。
1.3.3.2 色谱条件
色谱柱:Eclipse Plus C18(4.6 mm×150 mm, 5 μm),检测器:VWD,流动相:水(A)-乙腈(B),检测波长268 nm,柱温35 ℃,流速1.0 mL/min,进样量10 μL。洗脱程序见表1。
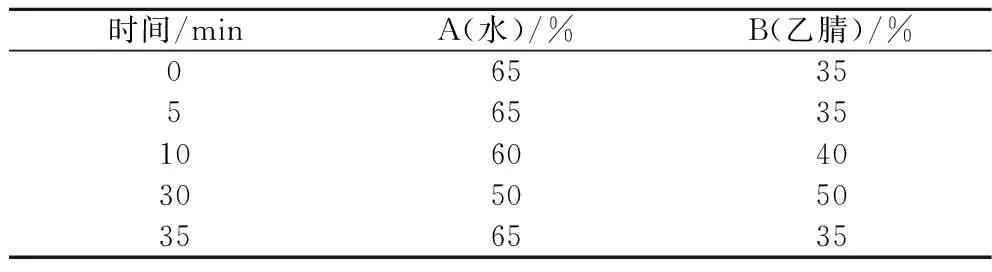
表1 HPLC洗脱程序Table 1 HPLC elution procedure
1.3.3.3 标准曲线的绘制
准确称取羟基-α-山椒素标准品0.010 0 g,用色谱级甲醇溶液定容于10 mL的棕色容量瓶中,配制成质量浓度为1 000 μg/mL的对照品储备液。储备液经甲醇稀释成一系列质量浓度(10、50、100、200、400、600 μg/mL)的羟基-α-山椒素溶液。各浓度分别取10 μL进行HPLC检测,以峰面积为Y轴,浓度为X轴,绘制得到藤椒麻味物质中羟基-α-山椒素的标准曲线为y=28.347x-185.72(R2=0.999 2)。
1.3.3.4 方法的回收率和精密度考察
将质量浓度为200 μg/mL的标准溶液连续进样6次,得到相应的响应值,计算相对标准偏差(relative standard deviation,RSD)为0.86%,表明仪器精密度良好,能够满足样品分析。
选择JD07样品,以加标质量浓度为100 mg/mL做加标回收实验,平行测定6次计算样品的加标回收率。计算RSD为4.77%,回收率为99.48%,表明该方法准确度较好。
1.3.3.5 羟基-α-山椒素含量的计算
根据样品峰面积从标准曲线中计算出羟基-α-山椒素的浓度,再根据公式(2)计算出藤椒中羟基-α-山椒素的含量:
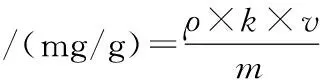
(2)
式中:ρ,根据标准曲线计算的羟基-α-山椒素质量浓度,mg/mL;v,甲醇稀释样品的体积,mL;k,稀释系数;m,样品质量,g。
1.3.4 香气成分测定
1.3.4.1 藤椒挥发油的提取
采用水蒸气蒸馏法提取藤椒挥发油,取100 g藤椒颗粒置于蒸馏烧瓶中,按照料液比1∶10加入去离子水,加热并保持微沸状态萃取4 h,至挥发油含量不再增加,冷却至室温后读取挥发油体积并收集挥发油于4 ℃下保存。根据公式(3)计算挥发油含量:
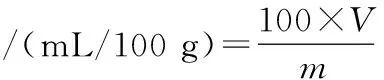
(3)
式中:V,所得挥发油体积,mL;m,藤椒质量,g。
1.3.4.2 样品处理
将收集得到的挥发油用正己烷溶解、稀释100倍,并加入无水硫酸钠于-20 ℃下保存过夜。进样前需要将样品用0.22 μm有机相滤膜过滤即得到供试样品溶液。
1.3.4.3 色谱条件
色谱条件:色谱柱:HP-5 MS(30 m×0.25 mm×0.25 μm);程序升温:初始柱温50 ℃,保持2 min,以3 ℃/min升至110 ℃,保持3 min,以3 ℃/min升至140 ℃,保持10 min,以6 ℃/min升至220 ℃,保持2 min;载气为高纯He;进样口温度250 ℃,检测器温度260 ℃,进样量1 μL,分流比10∶1;溶剂延迟时间3 min。
质谱条件:70 eV EI离子源,离子源温度230 ℃,四级杆温度150 ℃,扫描范围(m/z)40~550;质谱检索图库:NIST11.1谱库。
1.3.4.4 定性和定量
定性方法:C7~C40正构烷烃混标在相同GC/MS条件下液体上样分析。采用NIST 20标准谱库检索,选择匹配度>85%的挥发性风味成分,通过与标准品的保留指数值对比分析,进一步对挥发性物质进行定性[18]。
定量方法:采用内标法定量,以环己酮(10 mg/mL)为内标,利用总离子流峰面积定量其他化合物。
1.3.4.5 相对气味活度值(relative odor activity value,ROAV)法确定藤椒主体风味物质
参考郝旭东等[19]采用ROAV法对大红袍花椒的挥发性风味成分的贡献大小进行评价,进而确定主体风味物质。定义对藤椒总体风味贡献最大的组分ROAVmax=100,其他组分ROAV的计算如公式(4)所示:
(4)
式中:C为挥发性组分的相对含量,%;T为挥发性组分的感觉阈值,μg/kg;Cmax为对藤椒总体风味贡献最大的挥发性组分的相对含量,%;Tmax为对藤椒总体风味贡献最大的挥发性组分的感觉阈值,μg/kg。
1.3.5 数据统计与分析
采用SPSS 26.0对数据进行统计分析,实验数据表示为平均值±标准偏差,使用方差分析和邓肯多重范围检验对数据进行显著性分析(P<0.05),以Origin 2022软件、Heat Map with Dendrogram v2.00进行分析及作图。
2 结果与分析
2.1 不同成熟期藤椒的基础指标变化
藤椒的色泽参数随生长期的变化如表2所示,明度值L逐渐减小,表明藤椒变暗,色度值a为负值且逐渐增大,表明藤椒为绿色且逐渐偏向红色,色度值b为正值且逐渐减小。这与其外观变化相一致,藤椒在结果至成熟过程中,色泽由青绿色转为暗绿色再转至暗红。以JD01为标准计算不同生长期藤椒的总色差ΔE,可以发现,JD01~JD05藤椒的总色差ΔE值均在10以下,人体肉眼不容易观察到颜色变化,表明该采摘周期藤椒色泽变化较小;而JD06总色差ΔE值超过10,藤椒开始转红。
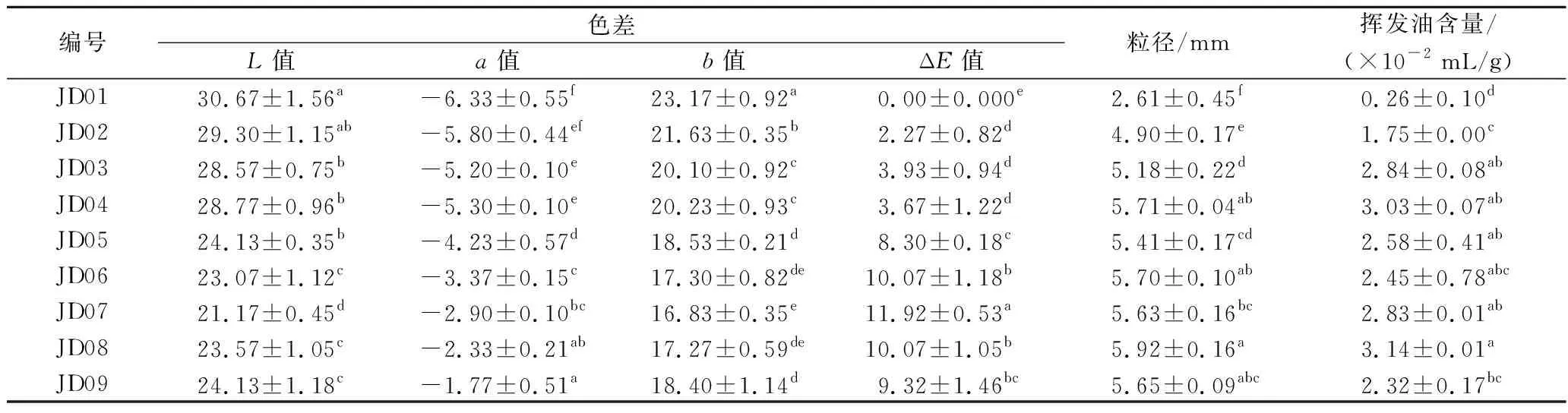
表2 不同成熟期藤椒各项基础指标的变化Table 2 Variation of indexes of Z.armatum at different maturity stages
藤椒粒径在生长过程逐渐增大,随着藤椒进入成熟期,JD04藤椒粒径显著增加至5.71 mm。同样地,JD01藤椒所得挥发油含量为0.26 mL/100 g,此时藤椒油腺还未完全长出导致挥发油含量较低;随着生长期的延长,挥发油含量显著增加并在成熟期(JD03~JD07)保持相对稳定,此时段采收的藤椒次生代谢占主导地位,次生代谢产物不断积累,至JD08挥发油含量达到最大值,为3.14 mL/100 g[20];然而,JD09藤椒挥发油含量显著降低,这是由于该时期藤椒完全成熟,活性成分达到“饱和”,并且受持续高温的影响导致了挥发油的损失[21]。挥发油与藤椒的芳香气味密切相关,后续试验进一步采用GC-MS对香气物质进行定性定量分析。
2.2 不同成熟期藤椒总酰胺、羟基-α-山椒素含量的变化
总酰胺含量能够快速反映藤椒中的麻味成分,羟基-α-山椒素在藤椒麻味物质中占主导地位,可以决定藤椒整体山椒素的含量变化[22]。如图1所示,不同采收期藤椒总酰胺、羟基-α-山椒素含量的变化趋势基本一致,并且两者具有较好的线性相关性(R2=0.986)。对于JD01~JD08,总酰胺、羟基-α-山椒素含量在生长过程中呈现先急速增加后缓慢增加的趋势,至JD08达到最大值,此时总酰胺、羟基-α-山椒素含量分别为5.55、48.25 mg/g,该结果与朱建朝[23]报道的林州大红袍花椒在生长过程中麻味物质含量的变化趋势一致,其他研究[24-25]也表明花椒在生长过程中,花椒酰胺物质由椒叶逐渐转移至果皮,并不断积累。与此同时,JD04~JD08藤椒麻味物质含量缓慢增加的原因是受连续高温影响,藤椒水分含量略有降低,相同质量的藤椒所含麻味物质略有增加。然而JD09藤椒的总酰胺、羟基-α-山椒素含量相比于JD08显著降低(P<0.05),即成熟后期藤椒的麻味物质减少,李佩洪等[26]研究表明,“青花椒”麻味素总量随青花椒果实成熟度增加呈先增后减趋势。该结果表明6月中下旬至8月初,尤其是7月下旬采收的藤椒能够为生产藤椒油提供更多的麻味物质。
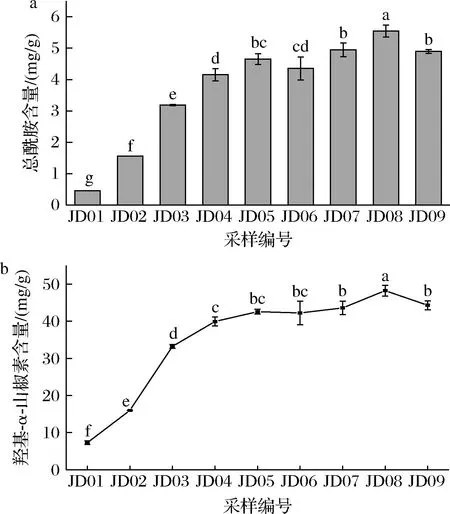
a-总酰胺;b-羟基-α-山椒素含量图1 不同成熟期藤椒的总酰胺、羟基-α-山椒素含量Fig.1 The content of alkylamides and hydroxy-α-sanshool of Z.armatum at different maturity stages注:不同字母表示差异显著(P<0.05)。
2.3 藤椒挥发性风味组分分析
2.3.1 不同成熟期藤椒挥发性风味物质种类及其含量分析
从不同成熟期的藤椒挥发油中共鉴定出93种化合物,其中烯类32种、醇类20种、酯类13种、醛类15种、酮类5种、其他化合物8种。不同成熟期藤椒挥发性风味组分的种类有所差异,JD01、JD02分别鉴定出47、44种化合物,JD04~JD08鉴定的化合物显著增加至50~79种,JD09共鉴定出40种化合物,这与精油提取率的变化趋势一致,说明精油含量随成熟度的增加而增加,风味也愈发浓郁饱满[27]。
藤椒挥发性风味组分的种类及其相对百分含量随成熟期变化的规律如图2所示,在整个成熟期,藤椒挥发油中烯类、醇类物质含量较高,两者总占比高达96%~99%,即藤椒挥发油的主要成分为烯类和醇类物质[18, 28]。
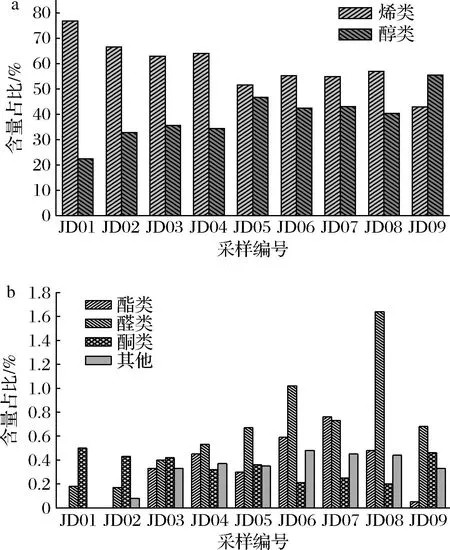
图2 不同成熟期藤椒挥发性风味组分的种类和相对百分含量Fig.2 Types and relative percentage content of flavor components in volatile oil of Z.armatum at different maturity stages
此外,藤椒挥发油中烯类物质含量随生长期的延长逐渐降低,由于萜类具有较强的生物活性,因此JD01~JD04的藤椒挥发油可用于制备杀虫剂等;随着生长期的延长,醇类物质含量不断增加,以JD05~JD09醇类物质占主导,同时酯类、醛类物质的个数及含量均显著增加,其中,醛类具有明显的木味、柑橘香味、桉叶香味,酯类具有果香味、花香味、清苦香味,从而使得藤椒风味更佳浓郁、香味越发饱满,因此可用于香料的开发。
2.3.2 不同成熟期藤椒各挥发性风味物质含量的分析
选择共有且组分含量较高的成分进一步分析,9组藤椒挥发油样品中共检测出54种挥发性风味组分,如表3所示。其中稀类是种类最多且含量最高的组分,为16~22种,含量变化范围500~1 413 mg/mL,其中D-柠檬烯(610.2 mg/mL)、桧烯(351.0 mg/mL)、(1S)-β-蒎烯(147.1 mg/mL)、β-石竹烯(120.6 mg/mL)、β-胡椒烯(88.8 mg/mL)均有连续性检出,且相对含量较高。随着采收时间的延长,烯类物质的含量呈现先降低后略有升高的趋势,研究表明以D-柠檬烯为代表的萜烯类物质随果实成熟度的提高逐渐减少,有相关报道[11, 29],D-柠檬烯在未成熟果实香气中含量较高,随着果实成熟度的提高,含量显著降低。
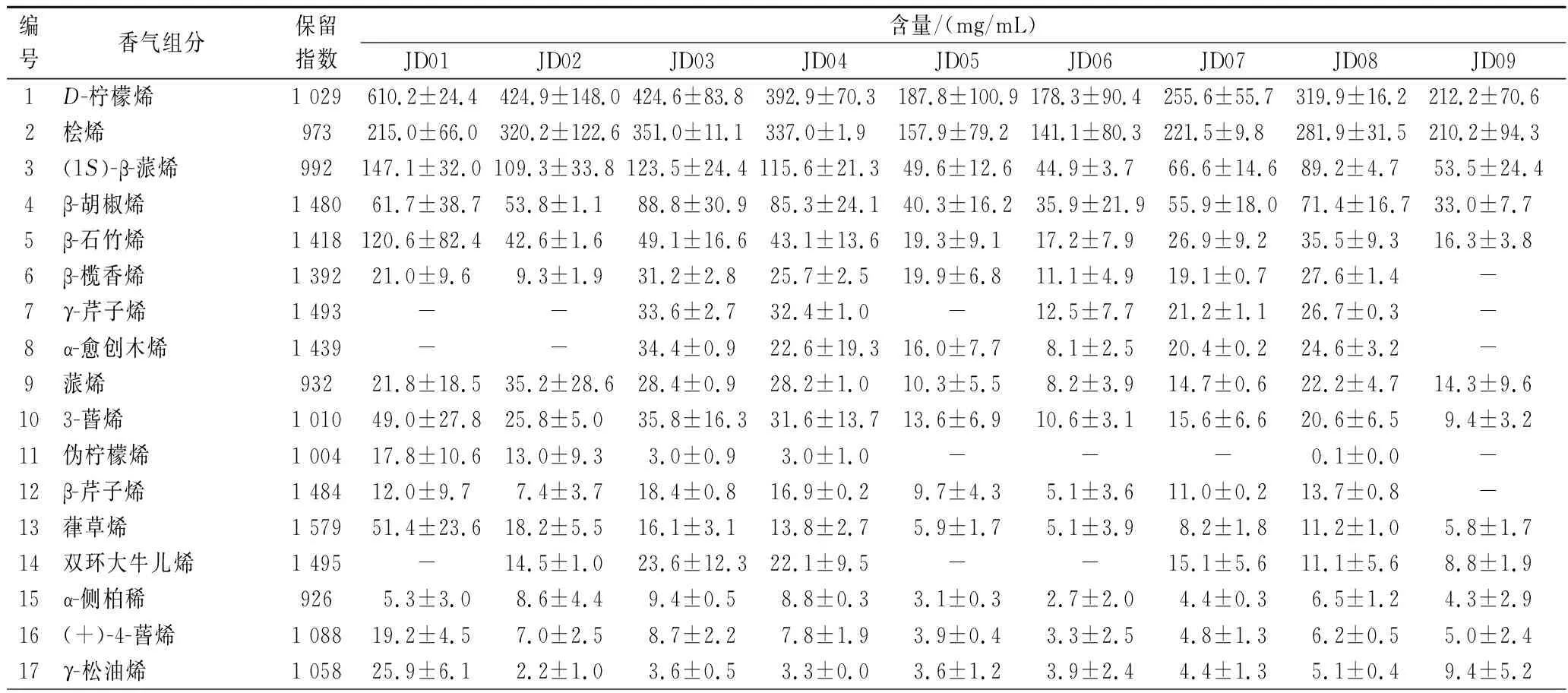
表3 不同成熟期藤椒挥发油各香气组分的相对含量Table 3 Relative content of flavor components in volatile oil of Z.armatum at different maturity stages
不同成熟期藤椒挥发油中醇类化合物的种类及相对含量居第二位,其中含量最高的成分是芳樟醇(706.8 mg/mL),LIU等[30]研究表明超临界CO2藤椒果皮萃取油中芳樟醇含量最高,是其最有效的气味活性化合物。随着生长期的延长,醇类物质的相对含量呈现升-降-升的趋势,至JD09达到最大值779.3 mg/mL,芳樟醇占该时期醇类物质总量的91%。研究表明以芳樟醇为代表的醇类物质随果实成熟度的提高逐渐积累,与吴素蕊等[14]报道的芳樟醇随着采收时间的延长而增加结论一致。
醛类化合物阈值低,作为水果香气的主要贡献成分,可以为藤椒提供浓郁的果香、鲜香及青叶香等[29]。随着采收时间的延长,醛类物质的相对含量呈现先升高后降低的趋势,至JD08达到最大值,柠檬醛、(Z)-3,7-二甲基-2,6-辛二烯醛、癸醛占该时期醛类物质总量的65%。研究表明以柠檬醛为代表的醛类物质随果实成熟度的提高逐渐积累。
酯类化合物主要存在于成熟果实中,JD01、JD02未检出,而随着生长期的延长,在藤椒挥发油中逐渐检出乙酸苯乙酯、左旋乙酸冰片酯等3种酯类化合物,但含量极微(0.7~10.9 mg/mL),吴素蕊等[14]研究发现藤椒果实在成熟后期产生了乙酸芳樟酯。
酮类、烷烃类化合物在不同成熟期藤椒挥发油中有检出,其中,2-十一烷酮、胡椒酮在JD01检出,含量相对较高,(-)-宁酮在JD02~JD09均有检出;与此同时,烷烃类物质在藤椒成熟过程中有所积累,但相对含量无明显规律。根据相关文献报道[25],果实在生长过程中,各挥发性风味化合物受风味物质及其形成前体调控基因的影响,导致其含量存在动态变化差异,整体上表现为无规则变化积累。
2.3.3 不同成熟期藤椒关键风味组分分析
藤椒的总体风味由挥发性组分的含量及其感觉阈值共同决定,即香气物质含量较高而阈值也较高的组分对藤椒风味的贡献不大,而某些含量较低的组分对藤椒整体风味的影响较大[31]。为进一步研究不同成熟期藤椒挥发性香气组分的差异并确定藤椒关键风味成分,通过计算ROAV进行分析。通过查阅资料得到各风味成分的阈值,并计算ROAV,结果如表4所示,其中,芳樟醇是整个成熟期藤椒风味贡献最大的组分,D-柠檬烯、蒎烯对藤椒风味的贡献较大,在整个成熟期间ROAV分别为5.29~14.37、1.86~6.35。
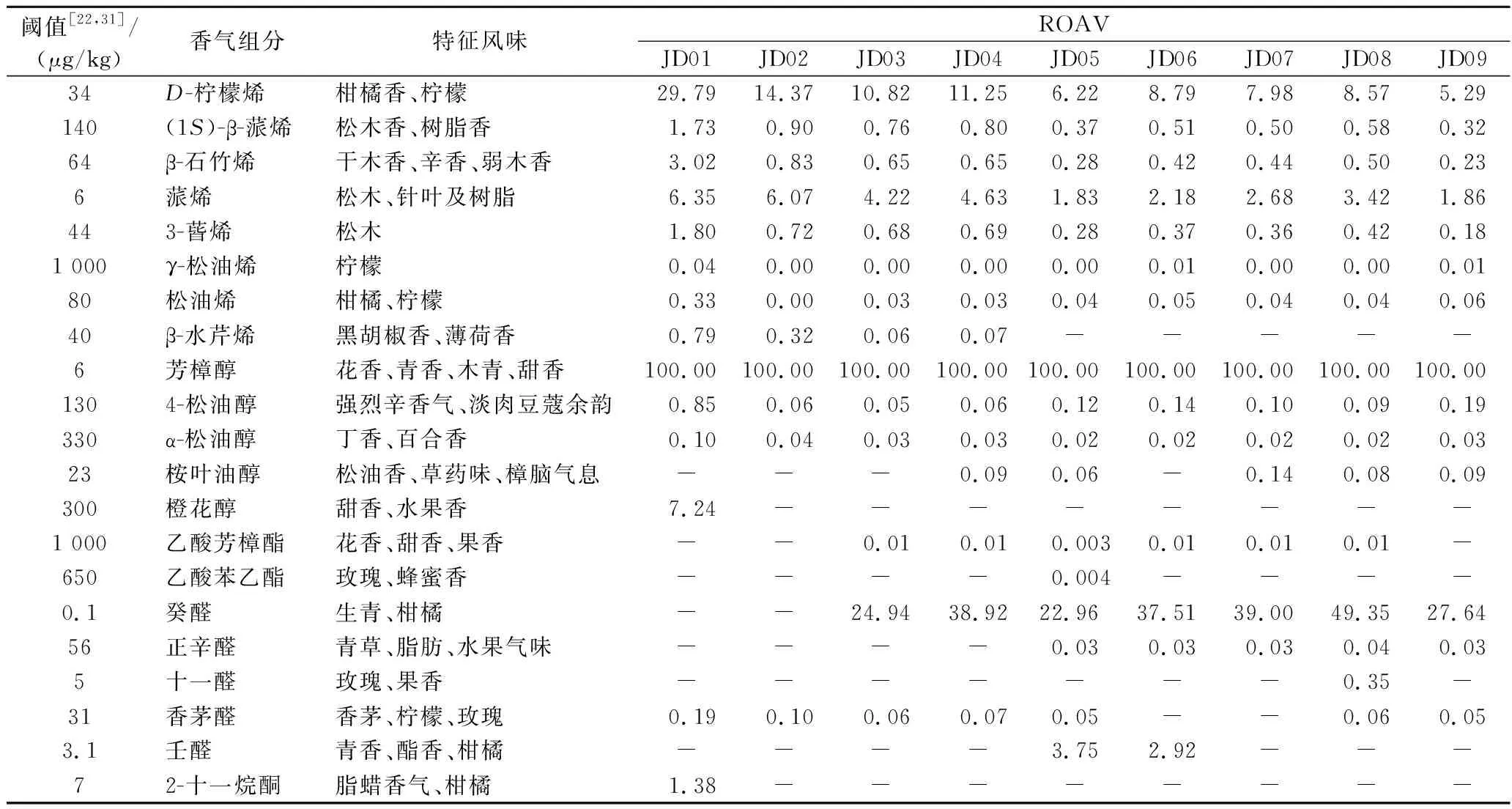
表4 不同成熟期藤椒的关键挥发性物质及其ROAVTable 4 Key flavor components and their ROAV in volatile oil of Z.armatum at different maturity stages
不同成熟期藤椒的关键风味化合物存在差异,JD01关键呈味组分(ROAV≥1)有8种,分别是芳樟醇、D-柠檬烯、橙花醇、蒎烯、β-石竹烯、3-蒈烯、(1S)-β-蒎烯、2-十一烷酮;同时4-松油醇、水芹烯、松油烯、香茅醛、L-α-松油醇对藤椒风味有修饰作用(0.1≤ROAV<1)。JD02关键呈味组分有3种,分别是芳樟醇、D-柠檬烯、蒎烯;同时(1S)-β-蒎烯、β-石竹烯、3-蒈烯、水芹烯、香茅醛对藤椒风味有修饰作用。JD03、JD04、JD08关键呈味组分有4种,分别是芳樟醇、癸醛、D-柠檬烯、蒎烯;同时(1S)-β-蒎烯、β-石竹烯、3-蒈烯对藤椒风味有修饰作用。JD05、JD06关键呈味组分有5种,分别是芳樟醇、癸醛、D-柠檬烯、壬醛、蒎烯;同时(1S)-β-蒎烯、β-石竹烯、3-蒈烯、4-松油醇对藤椒风味有修饰作用。JD07、JD09关键呈味组分有4种,分别是芳樟醇、癸醛、D-柠檬烯、蒎烯;同时(1S)-β-蒎烯、β-石竹烯、3-蒈烯、4-松油醇对藤椒风味有修饰作用。郝旭东等[19]利用顶空固相微萃取气质联用结合ROAV和主成分分析确定了大红袍花椒的主体风味物质,共测出芳樟醇、3-蒈烯、水芹烯、壬醛等9种关键挥发性香气组分,γ-松油烯、4-松油醇、十一醛等对大红袍花椒香气起修饰作用,与本研究结果有所不同的原因在于藤椒与红花椒的品种差异。
可以发现,芳樟醇、D-柠檬烯、蒎烯是藤椒整个生长期的关键风味化合物,芳樟醇具有花香、木香、花甜香味及微弱的柑橘香,柠檬烯具有柑橘香及清淡的香脂香气,蒎烯具有特有松木香气;橙花醇、β-石竹烯、3-蒈烯、(1S)-β-蒎烯、2-十一烷酮赋予未成熟藤椒特有干木香、辛香风味;癸醛则是藤椒成熟期的关键风味化合物,具有生青、柑橘香气,可将其应用于食品行业中多种食用香精配方。
3 结论
本文研究了不同成熟期藤椒麻味物质含量的变化及其挥发油香气成分的组成及含量差异,结果为藤椒的适时采收及其加工提供了科学指导。
1)藤椒总酰胺类物质、羟基-α-山椒素含量随成熟度的增加显著增加,对于4月、5月采收的藤椒,麻味成分较低;6月中下旬至7月底含量较高且保持相对稳定,能够为藤椒油生产提供足够的麻味物质。
2)不同成熟期藤椒风味化合物的种类和含量均存在差异:4月至6月中旬采收的藤椒挥发性风味组分以稀类为主,且随果实成熟度的提高逐渐减少;醇类物质含量逐渐增加;醛类、酯类物质在6月开始积累,且随果实成熟度的提高逐渐增加。ROAV分析结果表明,芳樟醇、D-柠檬烯、蒎烯对藤椒风味的贡献较大;早期藤椒挥发油的关键风味化合物较多,而以癸醛为代表的醛类物质成为成熟期藤椒的关键风味化合物。
3)针对不同用途选择藤椒采收期:对于医药行业为主的利用以及食品行业藤椒油的生产,可选择6月中下旬至7月底采收的藤椒,此时藤椒麻度较高、风味组分相对较多;4月采收的藤椒挥发性风味组分以稀类、酮类为主,可用于制备杀虫剂等;对于6月下旬采收的藤椒,作为香气重要来源的醛类、酯类物质逐渐积累,因此可用于香料的开发。
——藤椒种植的应用前景分析

