川南地区4 157例不孕不育患者异常染色体核型及临床表现分析*
成洋,刘星,张晖,周攀,罗庆,文霞,周家红
(1.西南医科大学附属医院医学检验部,四川泸州646000;2.西南医科大学医学检验系,四川泸州646000)
不孕不育是一个重大的全球公共卫生问题,影响8%至12%的育龄夫妇(超过1.86亿人)[1]。导致不孕不育的原因包括遗传、环境、解剖和内分泌等多种因素,其中染色体异常是重要原因之一,无论夫妻任何一方还是双方染色体异常均可能导致不孕。研究表明,一般人群中染色体异常率为0.37%~1.86%[2],而在不孕不育人群中则高达3.95%~14.3%[3]。染色体异常可能会降低男性生育潜能,并增加女性不良妊娠或分娩风险。因此,对不孕不育患者进行染色体核型分析十分必要。本研究回顾性分析了川南地区4 157例不孕不育患者的外周血染色体核型和临床表现,旨在准确了解该地区不孕不育患者的染色体异常类型及发生率,为临床检查项目的选择和生育指导提供理论依据。
1 对象和方法
1.1研究对象 纳入2018年7月至2021年6月于我院生殖医学中心就诊的不孕不育患者4 157例,年龄20~51岁,其中男性2 044例,女性2 113例。本研究经西南医科大学附属医院临床试验伦理委员会批准(批准文号:KY2023067)。
1.2主要仪器及试剂 Metasystems Ikaros染色体核型分析系统(德国Zeiss公司);计算机辅助精子分析(CASA)系统(广州友宁生物科技公司);Aixplorer型彩色多普勒超声诊断仪(法国SuperSonic Imagine公司);精子DNA碎片检测试剂盒(深圳华康生物医学工程公司)。
1.3方法
1.3.1核型分析 0.35 mL肝素抗凝外周血接种于外周血淋巴细胞培养液(上海乐辰公司)中,37 ℃培养72 h,收获前加入80 μL(终浓度10 μg/mL)秋水仙素。常规制片,玻片使用2.5 g/L胰蛋白酶消化25 s,经生理盐水和纯净水冲洗后,置于吉姆萨染液中染色3 min。采用Metasystems Ikaros染色体核型分析系统进行全片扫描,每例计数20个分裂相,分析5个核型,异常者加倍计数分析;对嵌合型至少分析20个核型。依据《人类细胞遗传学国际命名体制ISCN2016》进行核型描述及诊断。
1.3.2精液分析 嘱患者禁欲2~7 d,采用手淫法取精,将全部精液收集于清洁干燥容器内,于30 min内37 ℃保存送检。精液置于37 ℃恒温水浴箱内液化,采用CASA分析方法,根据WHO《人类精液检查与处理实验室手册》第5版标准[4]分组。(1)正常精液同时满足:精液量≥1.5mL、pH≥7.2、精子浓度≥15×106/mL、精子活动率≥40%、前向运动精子百分率≥32%、精子存活率≥58%、正常形态精子百分率≥4%、无凝集、白细胞<1×106/mL;(2)少精子症:精子浓度<15×106/mL;轻度为精子浓度(10~15)×106/mL,中度(5~10)×106/mL,重度(1~5)×106/mL,极度少精子症精子浓度<1×106/mL;(3)弱精子症:精子活动率<40%或前向运动精子百分率<32%;(4)少弱精子症: 精子浓度<15×106/mL且精子活动率<40%或前向运动精子百分率<32%;(5)无精子症:3次检查均未见精子。
1.3.3超声检查 采用经阴道彩色多普勒超声检查子宫大小(包括子宫纵径、横径及前后径),按照Aixplorer型彩色多普勒超声诊断仪及配套试剂说明书操作。
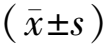
2 结果
2.1染色体异常率 4 157例外周血样本中检出染色体多态性239例(5.75%);染色体异常核型137例(3.30%);总体染色体异常率为9.04%(表1)。异常核型中,男性检出率高于女性(χ2=23.07,P<0.01)。

表1 不孕不育患者染色体异常率[n(%)]
2.2染色体异常核型分布 见表2、3。137例异常核型包括:性染色体数目异常57例(41.61%),罗伯逊易位6例(4.38%),平衡易位32例(23.36%),染色体倒位21例(15.33%),嵌合体9例(6.57%),未知来源染色体8例(5.84%),性反转3例(2.19%),性染色体缺失1例(0.73%)。

表2 不孕不育患者常染色体异常核型分布

表3 不孕不育患者性染色体异常核型分布
常染色体异常中,男女最常见均为易位;性染色体异常中,男性最常见为克氏综合征核型,女性为特纳综合征核型。
2.3男性不育患者染色体核型与临床表现 95例异常染色体核型和140例染色体多态性核型不育男性的精液分析结果显示(表4):91.58%异常染色体核型患者精液参数异常,以性染色体数目异常最为显著。43例性染色体数目异常中,31例(72.09%)为无精子症,9例(20.93%)为严重/极度少精子症,3例(6.98%)为少弱精子症。

表4 不育患者染色体异常及其精液状态
140例多态性核型患者中,63例(45%)精液正常,18例(12.86%)无精子症,11例(7.86%)严重/极度少精子症,8例(5.71%)轻中度少精子症,21例(15%)弱精子症,19例(13.57%)少弱精子症。
2.4女性不孕患者染色体核型与临床表现 见表5。携带常染色体易位和多态性核型患者子宫各径线与健康人差异无统计学意义(P>0.05),而特纳综合征患者子宫纵径、横径和前后径均低于正常对照组(P<0.01)。

表5 不孕患者染色体核型及其子宫大小
3 讨论
染色体核型分析是不孕不育患者必要的检测项目。尽管不同地区染色体异常率存在差异,但不孕不育夫妇的异常率均显著高于健康人群(0.37%~1.86%)[5]。陈美佳等[6]报道广西地区不孕不育人群染色体异常率为9.39%(异常核型1.46%,多态性7.93%);而华中地区大样本研究显示14 965对不孕夫妇异常率为3.84%(异常核型2.58%,多态性1.26%)[7]。本研究中,川南地区4 157例不孕不育患者染色体异常率为9.05%(异常核型3.30%,多态性5.75%),差异可能源于地区和纳入标准。本研究对象为2018年7月至2021年6月就诊的所有不孕不育患者,可较准确反映该人群染色体异常情况。
男性染色体异常与精液质量密切相关。克氏综合征是导致男性不育最常见的原因。本研究43例克氏综合征患者均表现为无精子症、极度少精子症或严重少精子症,这是由于性染色体不分离导致生精小管发育不良及生精细胞减少所致[8]。常染色体异常也可影响生精细胞减数分裂,进而导致男性不育和不良孕产[9]。因此,对不孕不育男性进行染色体核型和精液分析十分必要。
既往研究表明,大部分青春期和育龄期特纳综合征患者存在子宫发育不全[10],这是由于X染色体异常导致卵巢发育异常及生长发育紊乱所致[11]。本研究22例特纳综合征患者子宫各径线均小于正常对照组,部分出现幼稚子宫,与文献报道一致。
染色体多态性在人群中发生率为1%~3%[12],本研究检出率为5.75%(239/4 157),高于健康人群。其中9号常染色体倒位最常见,文献报道此类多态性可导致习惯性流产、死胎及不育等生育异常[13]。本研究中,多态性核型患者伴有55%的精液异常,提示多态性与不孕不育密切相关。
综上所述,染色体异常是不孕不育的重要原因,核型分析是不可或缺的诊断手段。将其与基因测序和染色体微阵列技术相结合,将为不孕不育诊断提供更全面准确的依据,降低出生缺陷发生风险。

