LC-MS/MS法测定大鼠血浆中雷公藤甲素浓度及其药代动力学研究
王静,王彤,刘航,苏天宏,崔瑞琴
雷公藤最早记载于《神农本草经》,味苦辛,性寒,入肝、脾二经,有大毒,可祛风湿、活血通络、清热解毒、消肿止痛[1]。雷公藤多苷是从植物雷公藤根心部提取的一种混合物,被广泛应用于炎性反应性疾病、自身免疫性疾病、器官移植及肿瘤的治疗。雷公藤甲素(TP)是目前公认的雷公藤多苷的主要药效成分,具有抗炎、免疫抑制、抗增殖、促凋亡等多种药理作用[2-3];但是,因其具有较强的药物毒性,包括引发器质性损害和严重的功能障碍,甚至死亡,导致其在临床应用中严重受限[4]。因此,如何才能在保持TP生物活性且不影响疗效的基础上来降低或者消除TP的毒性作用是该领域亟待解决的关键性科学问题。监测TP的体内代谢是提高临床用药安全性的重要手段之一。
1 材料与方法
1.1 实验动物 8周龄SPF级SD雄性大鼠24只(宁夏医科大学实验动物中心提供),体质量200~220 g[许可证号:SCXK(宁)2020-0001]。所有大鼠均在温度(22±2)℃、相对湿度50%~60%、12 h明暗交替的环境下饲养,自由进食、饮水。
1.2 药品与试剂 TP标准品(货号B20709,HPLC≥98%)购自上海源叶生物科技有限公司;内标泼尼松龙标准品(货号P829930,纯度:98%)购自上海麦克林生化科技有限公司;利福平胶囊(国药准字H51020786)购自成都锦华药业有限责任公司;琥乙红霉素片(国药准字H61022359)购自西安利君制药有限责任公司;雷公藤多苷片(国药准字Z32021007)购自江苏美通制药有限公司。羧甲基纤维素钠(CMC-Na)购自天津凯通化学试剂有限公司;乙酸乙酯购自德国Eppendorf公司;乙腈、甲醇(色谱醇)、甲酸购自美国millipore公司;乙酸铵购自美国Sigma公司。
1.3 主要仪器 QTRAP5500质谱仪(美国AB SCIEX公司)、Nexera X2 LC-30AD超高压液相色谱仪(日本Shimadzu公司)、Waters XBrige C18column色谱柱(美国Waters公司)、Bioruptor超声波系统(比利时Diagenode公司)、5430R冷冻离心机(德国Eppendorf Centrifuge公司)等。
1.4 给药方法与血样采集 24只SD雄性大鼠适应性喂养3 d,给药前禁食不禁水12 h,分别于灌胃给药前后30 min 与1、2、3、4 h自大鼠眼眶后静脉丛采血0.2~0.3 ml,置于肝素钠试管中,以3 000 r/min离心10 min,分离出血浆,置于-80 ℃冰箱保存,备用。
1.5 溶液配制
1.5.1 标准品储备液的配制:称取TP标准品5 mg,于10 ml容量瓶中用乙腈溶解定容后得到0.5 mg/ml的TP储备液,-20 ℃保存。
1.5.2 内标储备液的配制:称取泼尼松龙标准品3 mg,于10 ml容量瓶中用乙腈溶解定容后得到0.3 mg/ml的泼尼松龙储备液,-20 ℃保存。
1.5.3 标准溶液的配制:取适量TP储备液,用乙腈溶解并定量稀释,制成质量浓度分别为2.5、5、10、50、200、500 ng/ml的系列标准溶液, -20 ℃保存。
1.5.4 内标工作液的配制:取泼尼松龙储备液4 μl,加596 μl乙腈稀释,制成质量浓度为2 μg/ml的工作液,-20 ℃保存。
1.6 测定方法
1.6.1 色谱条件:Waters XBrige C18column色谱柱(3.5 μm,2.1 mm×50 mm);柱温为40 ℃;流速为300 μl/min,流动相为A相:2 mmol乙酸铵+0.5‰甲酸;B相:甲醇(0~0.1 min:30%,2.5~4 min:95%,4.1~5 min:30%),进样量为10 μl。
1.6.2 质谱条件:电喷雾离子源,正离子模式,多级反应监测(MRM);离子化温度为550 ℃;加热辅助气为30 psi;雾化气为30 psi;气帘气为10 psi;离子喷雾电压为5 500 V。TP和泼尼松龙用于定量分析的离子对分别为m/z 378.4→361.2和m/z 361.2→147.1,去簇电压分别为45 eV和100 eV,碰撞能量分别为15 eV和30 eV。
1.6.3 血浆样品处理:取空白大鼠血浆100 μl,加10 μl内标液(泼尼松龙2 μg/ml)涡旋30 s混匀,加1 ml乙酸乙酯,涡旋混匀3 min,4 ℃,高速冷冻离心机以12 000 r/min离心10 min,取上清液800 μl,氮气吹干,用80%甲醇溶液100 μl复溶,4℃,20 000 r/min离心10 min,取上清液80 μl,60 μl进样。
2 方法学评价
2.1 各组血浆样品HPLC图 取空白大鼠血浆,加入TP标准品工作溶液,加入内标液(泼尼松龙2 μg/ml),按上述“1.6.3血浆样品处理”操作,记录色谱图,见图1。
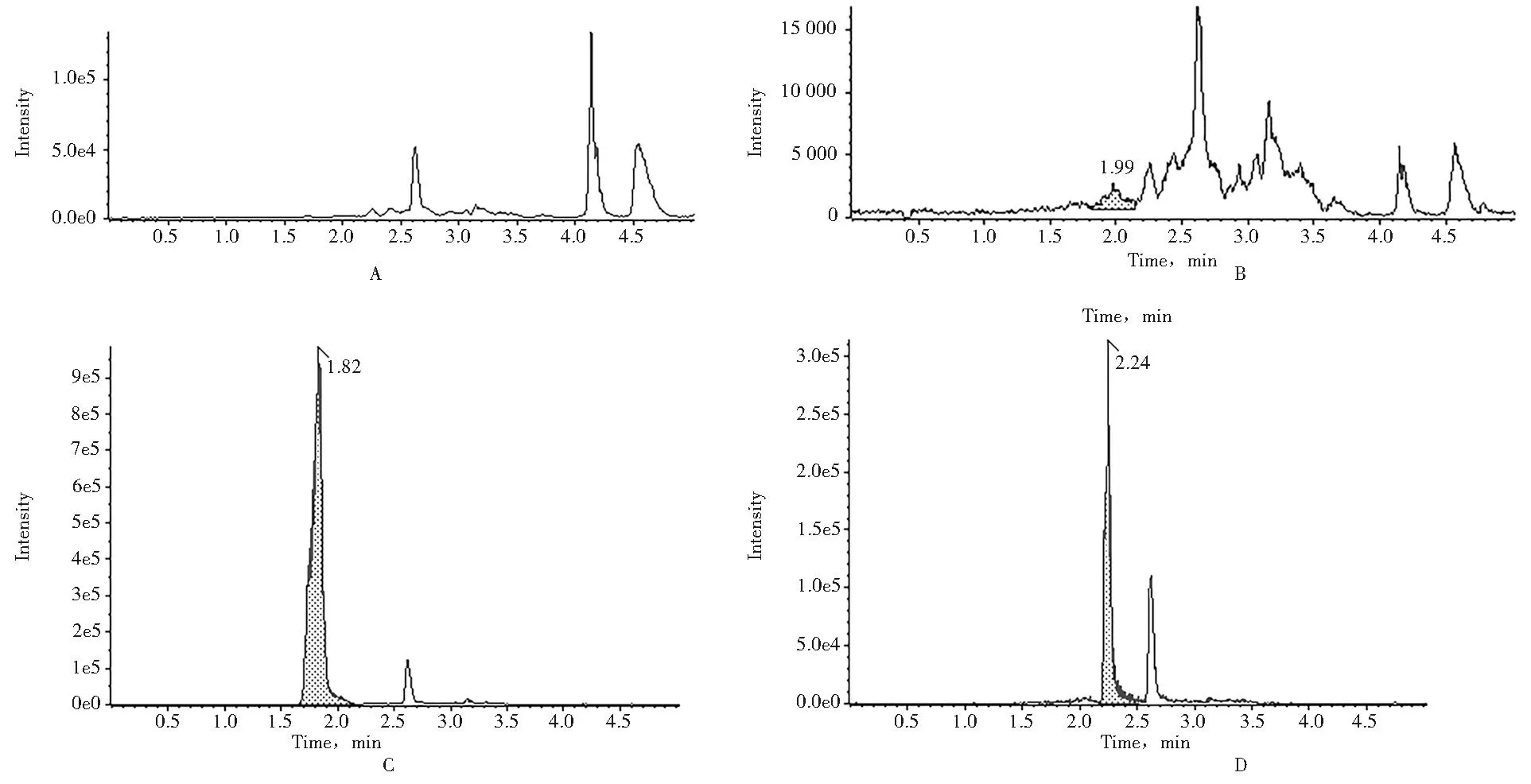
A.空白血浆;B.空白血浆+对照品+内标;C.TP;D.泼尼松龙(内标)
2.2 标准曲线及定量下限 吸取大鼠空白血浆100 μl,加入泼尼松龙10 μl,分别加入不同浓度的TP系列标准品溶液10 μl,按上述“1.6.3血浆样品处理”操作。得到TP标准品溶液终浓度分别为0.25、0.5、1、5、20、50 ng/ml的溶液。分析记录样品及内标峰面积。利用TP浓度对样品峰和内标峰面积的比值作线性回归,权重系数1/X,得标准曲线方程Y=0.019 4X-0.001 6(r=0.999 2)。结果表明,在0.25~50 μg/L浓度范围内,TP与泼尼松龙峰面积比与血药浓度呈良好线性关系,定量下限为0.25 μg/L。
2.3 精密度和准确度 分别移取10 μl的TP和泼尼松龙储备液,用100 μl大鼠空白血浆稀释。得到TP低、中、高3个浓度(0.5、5、50 ng/ml)的质量监控溶液,按上述“1.6.3血浆样品处理”操作,每个浓度样品各5份,依次测定。连续测定3个批次,以同批标准曲线计算样品浓度及日内、日间的相对标准偏差RSD,考察方法的精密度与准确度。结果见表1。
表1 TP在大鼠血浆中日内、日间的精密度与准确度
2.4 提取回收率与稳定性 吸取大鼠空白血浆后加入TP和内标溶液,得到低、中、高3个浓度(0.5、5、50 ng/ml)的样品,每种质量浓度5个样本,表示100%回收率,通过比较空白生物样品中添加被测物并经样品处理后的检测信号与血浆处理后加药的相应浓度的标准溶液的检测信号比较,以每种质量浓度处理方法测得的TP峰面积和内标峰面积比值计算百分比,计算TP平均加样回收率分别为97.49%、97.14%和95.87%,RSD分别为3.16%、1.09%和1.66%,见表2。同法将3个浓度的质控样品平分5份,按照“1.6.3血浆样品处理”后,分别进行反复冻融3次,4 ℃及室温下放置24 h的稳定性考察,结果见表3。
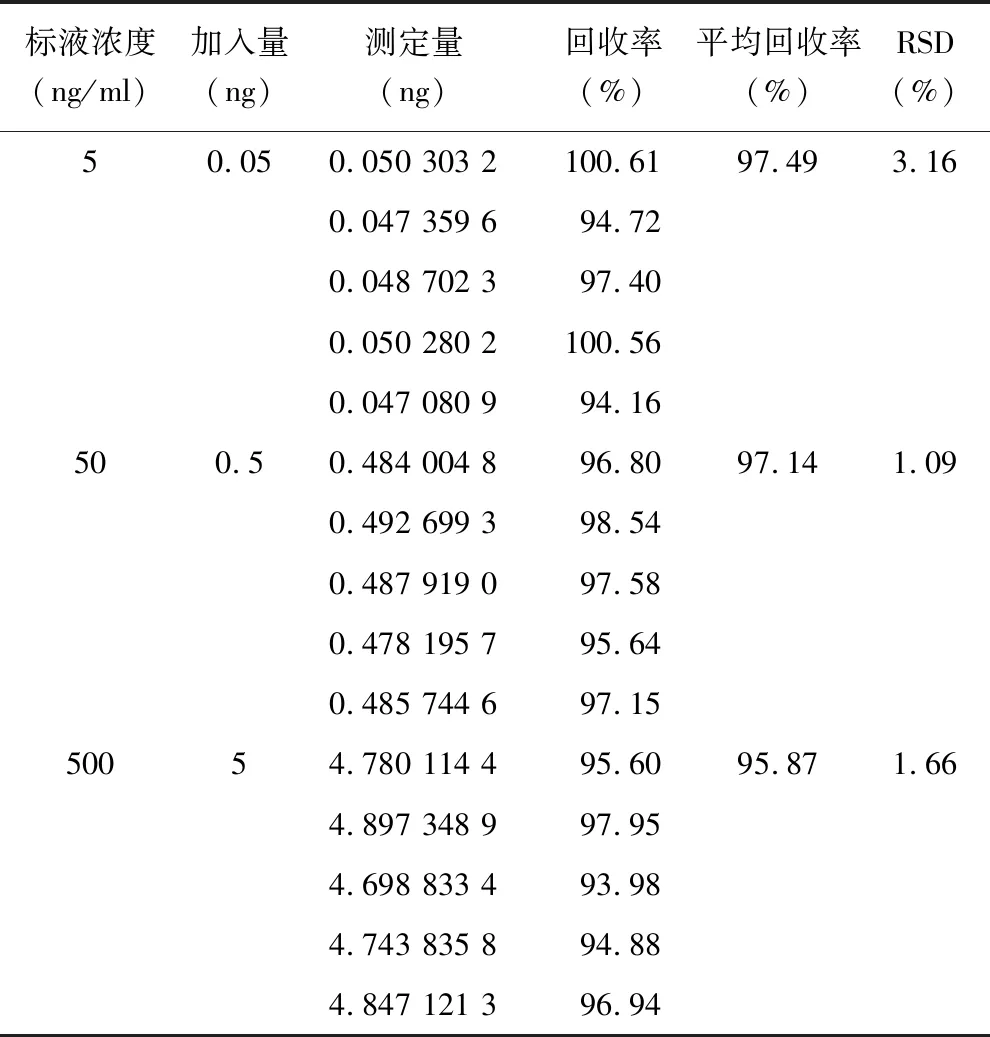
表2 TP血样高中低浓度加样回收率测定结果 (n=15)
表3 TP在大鼠血浆中的稳定性
2.5 药代动力学参数研究
2.5.1 动物给药与取血:SD雄性大鼠24只,采用随机数字表法将24只大鼠随机分为空白对照组、抑制剂组和诱导剂组,每组8只,药液均用CMC-Na溶液配制成混悬液,参考雷公藤多苷片口服给药剂量。空白对照组给予生理盐水灌胃,抑制剂组和诱导剂组分别给予琥乙红霉素药液168 mg/kg和利福平药液52.5 mg/kg灌胃给药;间隔1 h后,3组分别给予12.6 mg/kg的雷公藤多苷药液灌胃(根据大鼠体重剂量6.3倍换算)。在灌胃给药前及给药后的30 min
与1、2 、3、4 h分别进行大鼠眼眶后静脉丛采血500 μl,按照“血浆样品处理”处理后进样测定。


表4 TP在大鼠体内的主要药动学参数
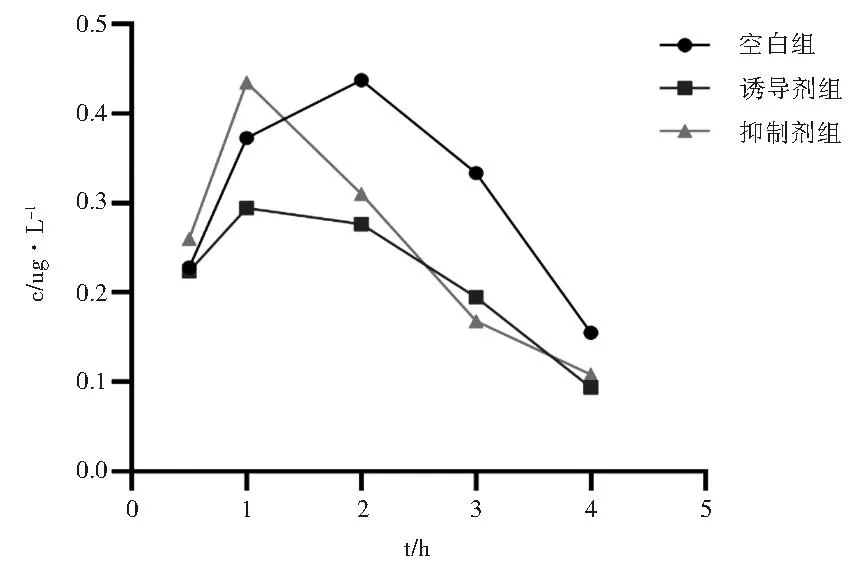
图2 灌胃给药后血浆中TP的药—时曲线(n=8)
3 讨 论
药物临床应用能否发挥药效,一定程度上取决于胃肠道吸收和靶器官浓度。因此,分析TP的药物动力学过程,对提高药物疗效和安全性,理解药物的药理作用机制及作用过程,均具有重要意义。本实验首次采用高效液相色谱—串联质谱检测法(LC-MS/MS)研究TP的药动学过程,探讨此化合物体内的吸收特性,为今后剂型选择及药物开发应用奠定基础。
CYP3A4是CYP3A亚族中最先从人体肝脏中分离出来的,可被许多结构无关的化合物所诱导或抑制,影响该酶系的活性,从而引起药物间的相互作用[5]。研究发现,肝脏P450酶决定了体内TP的清除效率和组织分布,其对TP的生物转化主要通过代谢作用[6]。CYP450的活性决定了TP在体内的药物浓度水平,以及与之相关的药效和毒性[7]。因此,任何影响肝脏CYP450活性的因素都可能增加TP在临床应用中的不良风险。利福平作为CYP3A4的经典诱导剂,具有广谱抗菌活性,研究证实利福平对CYP3A4有较强的诱导作用。在培养的人肝细胞中,利福平可增加超过50倍的CYP3A4。琥乙红霉素抑制CYP3A4,其机制可能是CYP3A4形成P450-MI络合物而抑制CYP3A4活性,从而降低部分也经CYP3A4代谢的并用药物的清除。本研究结果表明,酶诱导剂利福平增加TP的生物转化率,降低TP的浓度,毒性作用降低;而酶抑制剂琥乙红霉素减少TP转化,增加TP的浓度,延长药理作用时间,使TP毒性反应增加。
临床中雷公藤制剂多采用口服的给药方法,因TP水溶性差,治疗窗较窄,对消化系统和血液系统等均有较大的毒性作用,因此其临床开发研究受到极大限制。加之TP的毒性较大,给药量较小,吸收进入体内的药物相对较少,因而对于该药物的分析,需采用检测血浆中药物浓度较为灵敏和特异的LC-MS/MS测量。同时为保证检测更加准确与稳定,选择泼尼松龙作为内标对体内药物进行分析。通过建立方法学和分析,发现在本实验建立的质谱色谱条件下,TP保留时间在1.82 min左右,内标泼尼松龙保留时间在2.24 min左右,TP与内标分离良好,无内源干扰物,基线平稳(图1)。本方法具有较高特异性,能准确测定血浆中TP的浓度,重现性较好,TP在0.25~50 μg/L浓度范围内线性关系良好。
灌胃给药后,从药—时曲线可以看出TP在大鼠体内吸收较快,半衰期为1.341 h,Cmax为0.437 μg/L。诱导剂利福平进入体内后也能快速分布和代谢,t1/2为2.25 h,表明药物在体内分布很广。与空白组相比,诱导剂组t1/2增加,Cmax、Tmax显著降低(P<0.05);MRT明显延长。提示利福平能在大鼠体内吸收并加快其代谢,降低TP毒性作用,降低用药风险。研究显示,TP在大鼠体内Tmax约为20 min,t1/2为40 min。相比小鼠,大鼠吸收和代谢速率较缓慢,这可能与种属差异有关。本研究结果显示大鼠体内Tmax为2 h,后续考虑设置更长时、更密集的采样点,并对不同给药方式以及大鼠性别差异等情况进行探究。
综上所述,本研究通过LC-MS/MS法测定大鼠血浆中TP的药动学参数,成功建立并验证了一种准确可靠的测定大鼠血浆中TP浓度的方法,其灵敏度高、专属性强。文章主要针对TP体内的药代学特性进行了动物实验研究,从而对靶组织药物浓度进行有效控制,降低TP的毒性作用,为雷公藤多苷的临床安全应用提供了科学依据。
利益冲突所有作者声明无利益冲突

