布地奈德联合肺表面活性物质经气管插管注入治疗新生儿呼吸窘迫综合征的临床效果
杨彩平,肖秋江,王麒铧
新生儿呼吸窘迫综合征(NRDS)为新生儿出生后不久出现的进行性呼吸困难、青紫、呼气性呻吟、吸气性三凹征和呼吸衰竭,是导致新生儿死亡的重要原因之一,约占新生儿死亡的30%[1]。该症病因与发病机制尚未明确。目前主要认为是肺泡Ⅱ型细胞产生的肺表面活性物质(PS)分泌不足所导致,但部分患儿单纯补充PS不能完全缓解所有NRDS的临床进展,提示NRDS的发生除了PS缺乏外,还存在其他机制的参与[2]。目前基础及临床研究较多考虑的是炎性反应机制的参与,即炎性反应在NRDS的发病与进展中有着重要的作用[3-5]。本研究观察布地奈德联合PS——猪肺磷脂注射液经气管插管注入治疗NRDS的临床效果,报道如下。
1 资料与方法
1.1 临床资料 选取2021年10月—2023年10月东莞市虎门医院收治的NRDS早产儿共46例,采用随机数字表法分为观察组和对照组,各23例。观察组男10例,女13例;胎龄29+5~36+1(32.16±1.49)周;出生体质量1 200~2 450(1 853.79±237.46)g;10 min Apgar评分平均(5.23±1.12)分。对照组男11例,女12例;胎龄30~36(32.21±1.45)周;出生体质量1 210~2 450(1 871.62±241.53)g;10 min Apgar评分平均(5.18±1.09)分。2组患儿临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会核准,患儿家长已知晓研究内容并签署知情同意书。
1.2 病例选择标准 入选标准:(1)出生后6 h内早产儿;(2)符合第五版《实用新生儿学》[2]中早产儿及新生儿呼吸窘迫综合征相关诊断标准;(3)需要行气管插管机械通气的患儿。排除标准:(1)B族溶血性链球菌感染者;(2)湿肺及吸入性肺炎患儿;(3)严重先天性发育异常的患儿;(4)合并颅内出血患儿;(5)死亡或家属要求放弃治疗者。
1.3 治疗方法 对照组予猪肺磷脂注射液(Chiesi Farmaceutici S.p.A.生产)治疗,剂量150 mg/kg经气管插管注入。观察组在对照组基础上加用吸入用布地奈德混悬液(AstraZeneca Pty Ltd生产)治疗,剂量0.25 mg/kg,加入预温好的猪肺磷脂注射液经气管插管注入。
1.4 观察指标与方法
1.4.1 症状消失及机械通气时间:记录患儿呼吸困难、紫绀症状消失时间及机械通气时间。
1.4.2 血气指标:于用药前与用药24、48 h时采集患儿动脉血行血气分析,包括动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、pH值,并计算氧合指数(OI)。
1.4.3 炎性因子:于用药前与用药3、7 d时采集患儿静脉血3 ml,置于EDTA抗凝管中混匀,离心分离血浆,置于2~8 ℃环境中进行保存,采用Luminex液相芯片方法,测定白介素-6(IL-6)、白介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)。

2 结 果
2.1 症状消失及机械通气时间比较 观察组呼吸困难、紫绀消失明显早于对照组,机械通气时间短于对照组(P均<0.01),见表1。
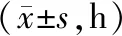
表1 对照组与观察组症状消失及机械通气时间比较
2.2 血气指标比较 用药前,2组患者PaO2、PaCO2、pH值、OI比较差异无统计学意义(P>0.05);用药24、48 h时,2组PaO2、OI较治疗前上升,PaCO2较治疗前下降,且观察组上升/下降幅度大于对照组(P<0.05或P<0.01);2组pH值用药后逐渐升高(P<0.05或P<0.01),但组间pH值各时点比较差异均无统计学意义(P>0.05),见表2。

表2 对照组与观察组用药前后血气指标比较
2.3 炎性因子比较 治疗前,2组患者IL-6、IL-8、TNF-α水平比较差异无统计学意义(P>0.05);用药3、7 d时,2组IL-6、IL-8、TNF-α水平均较治疗前降低,且观察组低于对照组(P<0.05或P<0.01),见表3。
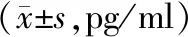
表3 对照组与观察组用药前后炎性因子比较
3 讨 论
NRDS最重要的病因是由于缺乏肺泡Ⅱ型细胞产生的PS引起,早产儿因肺发育不成熟导致PS分泌不足,因此,NRDS多见于早产儿。PS经气管插管肺内滴入是NRDS治疗常规用药,可以迅速缓解致死性、进行性加重的呼吸困难症状,效果显著,降低了NRDS病死率[4]。但单纯补充PS并不能使NRDS的临床进展得到完全控制,提示除肺发育不成熟致PS缺乏外,还有其他机制参与了NRDS的发生;且并非全部早产儿都发生NRDS,这一现象也提示着NRDS的发生除肺发育不成熟外,还有其他机制参与。目前,炎性反应机制在NRDS的发病与进展中的作用,是众多学者的研究方向[5]。细胞炎性因子与NRDS密切相关,其中IL-6、IL-8、TNF-α是目前基础研究及临床研究较为关注的因子[3-5]。
TNF-α是导致NRDS发病的关键因子。NRDS患儿肺部损伤后肺泡巨噬细胞释放大量TNF-α,其可启动、放大全身及局部炎性反应,进一步加重组织细胞受损,加重NRDS病情。此外TNF-α还可进一步诱导IL-6等分泌,加重炎性反应。NRDS患儿血清TNF-α水平明显随NRDS病情严重程度的提升而增加,表明TNF-α可能参与NRDS炎性反应过程,且与患儿病情进展存在密切关联[6]。IL-6是重要炎性递质之一,可诱导T细胞、B细胞增殖与分泌免疫球蛋白,从而增加细胞毒作用。有临床研究报道发现,NRDS的早产外周血IL-6在生后第1、3、7天均显著高于对照组,说明NRDS早期已存在肺部炎性反应,IL-6等炎性细胞因子参与了肺部炎性反应,从而促进了NRDS的发生发展[7]。IL-8是一种重要的中性粒细胞趋化因子,对于中性粒细胞的激活具有诱导作用,能提高其结合的活性,促进多形核白细胞在内皮细胞上的黏附,加速其脱粒,并促进超氧阴离子的产生,启动炎性反应[5,8]。另有研究称,氧暴露、机械通气、低氧、感染、营养不良以及IL-6、IL-8、TNF-α等促炎细胞因子等因素可干扰肺泡化进程和毛细血管发育,使肺泡化延迟而影响肺功能[9]。以上众多研究表明,炎性反应参与了NRDS病生理过程,其在发病与病情进展中起着重要的作用。临床科学的合理的给予抗炎治疗,减轻肺组织炎症,更好地改善肺功能。
糖皮质激素(GC)是临床常用的抗炎药物,在NRDS患儿防治中,GC可以促进患儿肺成熟,促进肺泡Ⅱ型细胞成熟及合成、分泌PS。但因其可能会增加患儿感染和气胸、肺出血、神经系统疾病等不良反应,出生后早期应用全身GC存在一定争议[10]。值得注意的是,有关新生儿应用GC促肺成熟的不良后果均基于产前母体给药或者产后新生儿早期全身用GC方式。因此,吸入性GC或气道内给药方案可能成为一个更为有效的、且更为安全的GC给药途径[11]。布地奈德混悬液是高效、局部抗炎作用的吸入性GC,同时具备较强的水溶性和脂溶性,糖皮质受体亲和力高,可充分与激素受体结合,局部应用后便可以发挥作用,不需要肝酶代谢,起效时间快;抗炎效果较显著,直接对靶细胞起作用,增加细胞膜稳定性,改善细胞渗透压及抑制炎性产物释放(如降低IL-6、IL-8、TNF-α等水平),促进NRDS病情改善,减少氧疗和机械通气并发症。还可促进肺泡细胞的成熟及合成、分泌PS,进一步改善临床症状;且布地奈德很少进入循环系统,不易引发全身性不良反应,布地奈德经氧气驱动雾化抛射进入气道治疗儿童哮喘是指南用药,其有效性和安全性已经得到了充分的证实[12];受限于新生儿气道狭窄,在非气管插管状态下约2/5的药物沉积在口咽部,全身绝对生物利用度较低。本研究以PS为载体,将布地奈德一同经气管插管滴入肺内,以达到肺内局部抗炎作用,减少全身糖皮质激素用药的不良反应。结果显示,观察组呼吸困难、紫绀消失明显早于对照组,机械通气时间短于对照组;用药24、48 h时,2组PaO2、OI较治疗前上升,PaCO2较治疗前下降,且观察组上升/下降幅度大于对照组,2组pH值差异无统计学意义;用药3、7 d时,2组IL-6、IL-8、TNF-α水平较治疗前降低,且观察组低于对照组。说明布地奈德联合PS气管内滴入治疗NRDS较单独使用PS更有助于改善肺功能、缩短吸氧时间,促使NRDS患儿促炎因子表达下调。布地奈德联合PS治疗NRDS的原理可能与外源性PS能显著增加糖皮质激素的肺内沉积,减轻肺部的炎症有关,而且这种联合给药方案并不会改变PS的理化特性[13]。
综上所述,布地奈德联合PS经气管插管注入治疗NRDS的临床效果肯定,有助于改善患儿症状、缩短机械通气时间并改善血气与炎性指标,值得临床推广应用。
利益冲突所有作者声明无利益冲突

