细胞培养液中细菌、真菌多重荧光定量PCR检测方法的建立及验证
孙锈锈,徐逸梦,周宇荀,李凯,肖君华
东华大学生物与医学工程学院,上海 201620
细胞培养是现代分子生物学和细胞生物学常用的一种技术,但在细胞培养过程中,易出现细胞污染现象,主要为细菌和真菌污染[1-2],因此,在细胞培养过程中对细菌和真菌的检测成为现代检测开发技术的主要研究内容,是确保细胞正常生长和增殖的关键环节[3]。在细胞培养过程中常见的细菌污染是金黄色葡萄球菌(Staphylococcus aureus,S.aureus)和生孢梭菌(Clostridium spore,C.spore),常见真菌是白色念珠菌(Candida albicans,C.albicans)[4]。传统的细菌、真菌检测方法主要为培养法[5-6],该方法周期长、效率低、过程复杂,且仅能用于定性[7-8]。菌种的检测还可采用Sanger 测序法[9-10],即针对目的菌种的特异性基因设计引物,进行PCR反应,并进行Sanger测序,通过序列比对确定污染菌株种类。该方法步骤繁琐,测序周期较长[11],不能及时有效解决细胞污染问题。与传统方法比较,实时荧光定量PCR 法操作简便、稳定性高、特异性强、灵敏度高、用时短,能同时实现定性和定量检测[12-17],在菌种检测方面具有明显优势。
本研究基于多重荧光定量PCR 技术,建立细胞培养液中细菌、真菌的快速检测方法,并引入辣椒UBI3基因作为外标基因,与金黄色葡萄球菌、生孢梭菌基因组混合进行细菌三重检测;与白色念珠菌基因组混合进行真菌两重检测,并对方法进行验证,以期建立一种针对细胞培养液中金黄色葡萄球菌、生孢梭菌和白色念珠菌的快速定量检测方法。
1 材料与方法
1.1 样本 100 份293T 细胞培养液上清样本由上海翼和应用生物技术有限公司提供。
1.2 基因、菌株、细胞及质粒 金黄色葡萄球菌的标准菌株基因组DNA(BNCC186335)及其定量菌液(BNCC-186335,108CFU/mL)、生孢梭菌标准菌株基因组DNA(BNCC104015)及其定量菌液(BNCC-104015,108CFU/mL)、白色念珠菌标准菌株基因组DNA(BNCC186382)及其定量菌液(BNCC299343,108CFU/mL)、大肠埃希菌菌株(BNCC336902)、酵母菌菌株(BNCC185724)均购自苏州北纳创联生物技术有限公司;支原体基因组DNA(51-0112)购自北京缔一生物科技有限公司;人源293T细胞(CL-0003)购自武汉普诺赛生物科技有限公司;辣椒基因组DNA(含UBI3基因)购自南京钟鼎生物技术有限公司;含有目的序列NUC的金黄色葡萄球菌标准品质粒pUC19(NC_007795.1,853~971 位,119 bp)、含有目的序列COLA的生孢梭菌标准品质粒pUC19(NC_CP011663.1,2 199 501~2 199 615位,115 bp)、含有目的序列ITS-2区段的白色念珠菌标准品质粒pUC19(NC_032096.1,1 893 355~1 893 472 位,118 bp)由通用生物(安徽)股份有限公司合成。
1.3 主要试剂及仪器溶菌酶(A694342-0001)购自生工生物工程(上海)股份有限公司;2×NovoStart®Probe qPCR Super Mix(E091-01A)购自苏州近岸蛋白科技有限公司;快速磁珠法大体积基因组DNA 抽提试剂盒(M104T)及Purifier HT 全自动核酸提取纯化仪均购自济凡生物科技(北京)有限公司;7500 Real Time PCR System 购自美国Applied Biosystems 公司;Nano-Drop2000C 微量分光光度计购自美国Thermo Fisher公司;全自动凝胶成像分析系统购自上海复日科技有限公司。
1.4 引物、探针设计及合成选取金黄色葡萄球菌NUC基因、生孢梭菌COLA基因、白色念珠菌ITS-2区段基因和外标基因(植物辣椒UBI3基因)的编码序列(coding sequence,CDS),应用Oligo 7 软件设计特异性引物和探针,引物和探针序列见表1,均由通用生物(安徽)股份有限公司合成。

表1 特异性引物和探针序列Tab.1 Specific sequences of primers and probes
1.5 多重荧光定量PCR 反应体系的建立 以金黄色葡萄球菌、生孢梭菌、白色念珠菌标准菌株基因组DNA(105copies/μL)为模板,相应引物及探针浓度均稀释为10 μmol/L,进行多重荧光定量PCR 扩增。金黄色葡萄球菌、生孢梭菌、外标基因的三重PCR反应体系为:2×NovoStart®Probe qPCR Super Mix 15 μL,Rox 0.6μL,上、下游引物各0.7 μL,探针0.5 μL,DNA模板2 μL,双蒸水补足至30 μL;白色念珠菌、外标基因的两重PCR 检测体系为:2×NovoStart®Probe qPCR Super Mix 15 μL,Rox 0.6 μL,上、下游引物各0.7 μL,探针0.5 μL,DNA 模板2 μL,双蒸水补足至30 μL。PCR反应条件为:95 ℃预变性2 min;95 ℃变性15 s,58 ℃退火45 s,72 ℃延伸45 s,共40 个循环;72 ℃延伸时收集荧光。
1.6 方法的验证
1.6.1 引物特异性 以金黄色葡萄球菌、生孢梭菌和白色念珠菌标准菌株基因组DNA 为模板,进行常规PCR 反应。PCR 反应体系为:2×PCR mix 10 μL,上、下游引物(10 μmol/L)各2 μL,基因组DNA 模板2 μL,加4 μL 无菌水补至20 μL。PCR 反应条件为:95 ℃预变性5 min;94 ℃变性30 s,分别于56、57、58、59 ℃退火30 s,72 ℃延伸45 s,共35 个循环;72 ℃再延伸5 min。PCR产物经2%琼脂糖凝胶电泳检测。
1.6.2 线性范围 用ddH2O 将金黄色葡萄球菌、生孢梭菌和白色念珠菌标准品质粒pUC19 稀释为105、104、103、102、101copies/μL,采用建立的方法进行检测,每个样本重复检测3 次,以标准品质粒的拷贝数为横坐标、Ct为纵坐标,绘制标准曲线,建立标准曲线方程。标准曲线由7500 Real Time PCR System自动生成,R2应>0.99,扩增效率范围应为90%~110%。
1.6.3 检测限 使用ddH2O 将PUC19 质粒稀释为102copies/μL,采用建立的方法重复检测3次。为与“金标准”培养法比较,需确定购买菌液的检测限。将3种菌的定量菌液10倍系列稀释(105~101cfu/mL),以1 ng 辣椒基因组DNA 作为Carry DNA,与各稀释梯度的菌液混合,用Purifier HT 全自动核酸提取纯化仪提取基因组DNA,以辣椒基因组DNA 为内参基因,将各浓度的3 种菌液基因组DNA 进行双重荧光定量PCR检测,确定3种菌液的检测限。
1.6.4 专属性 用含1 ng 外标基因组DNA 稀释液将金黄色葡萄球菌、生孢梭菌、白色念珠菌、大肠埃希菌、酵母菌、293T 细胞和支原体基因组DNA 分别稀释至105copies/μL,采用建立的方法进行检测,观察针对金黄色葡萄球菌、生孢梭菌和白色念珠菌分别设计的3 组特异性引物及探针在其他6 种基因组DNA 上的非特异性扩增情况,每种探针共检测7 次。
1.6.5 抗干扰性 将293T细胞、大肠埃希菌、酵母菌及支原体4种干扰基因组DNA(终浓度100 pg/μL)分别加至108和102CFU/mL的金黄色葡萄球菌、生孢梭菌和白色念珠菌菌液中,同时设对照组(不含干扰基因组DNA 的待测菌基因组),以这5 组基因组DNA为模板,采用建立的方法进行检测。
1.6.6 精密性
1.6.6.1 重复性 将金黄色葡萄球菌、生孢梭菌和白色念珠菌菌液用1×PBS溶液分别稀释至105、104、103CFU/mL,以其为模板,采用建立的方法进行检测,每个稀释度重复检测5次。
1.6.6.2 中间精密性 将金黄色葡萄球菌、生孢梭菌和白色念珠菌菌液用1 × PBS 溶液分别稀释至105、104、103CFU/mL,并以其为模板,由3 名实验员采用建立的方法进行检测,每个样品独立重复检测5次。计算均值(x),标准差(SD)和变异系数(CV),CV应<15%。
1.7 方法的应用 100 份293T 细胞培养液上清样本各取1 mL,用Purifier HT 全自动核酸提取纯化仪提取基因组DNA,以其为模板,采用建立的方法进行检测,评价金黄色葡萄球菌、生孢梭菌和白色念珠菌污染情况。从检测样本中随机挑选3 个阳性样本和2个阴性样本,再采用普通PCR 法进行检测(同1.6.1项),并将PCR产物送生工生物工程(上海)股份有限公司测序。
1.8 数据采集及分析 应用GraphPad Prism 8 软件进行数据采集及分析。
2 结果
2.1 多重荧光定量PCR反应体系的建立 金黄色葡萄球菌、生孢梭菌和外标基因的三重反应及白色念珠菌和外标基因的两重反应均显示出良好的扩增曲线,见图1。

图1 细菌三重(A)和真菌两重(B)荧光定量PCR 反应的扩增曲线Fig.1 Amplification curves of bacteria triple reaction(A)and fungi double reaction(B)of fluorescent quantitative PCR
2.2 方法的验证
2.2.1 引物特异性 3 对引物于不同退火温度(56、57、58、59 ℃)下均可扩增出对应3 种菌约100 bp 的特异性基因条带,大小与预期相符,见图2。外标基因辣椒基因组DNA 设计引物及探针的最佳退火温度为58 ℃,因此,选择58 ℃作为多重荧光定量PCR的最适退火温度。
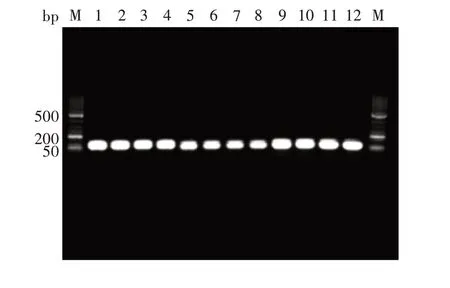
图2 引物特异性验证结果Fig.2 Verification for primer specificity
2.2.2 线性范围 金黄色葡萄球菌、生孢梭菌、白色念珠菌标准品质粒在5.80×106~5.80×102copies/μL范围内,与Ct均呈良好的线性关系,标准曲线方程分别为:Y= -3.373X+ 37.48、Y= -3.557X+ 36.59、Y=-3.536X+39.78,R2分别为0.996、0.992、0.995,扩增效率分别为0.912、0.979、0.917。见图3。

图3 线性范围的确定Fig.3 Determination of linear range
2.2.3 检测限 3次重复检测金黄色葡萄球菌、生孢梭菌、白色念珠菌标准品质粒Ct均值分别为32.27、33.4、33.18,均为阳性,CV分别为1.07%、0.98%、0.35%。因此,确定该方法对3种菌的检测限均为102copies/μL。加入外标基因菌液的多重荧光定量PCR 反应检测的检测限为101CFU/mL,从而计算获得金黄色葡萄球菌、生孢梭菌和白色念珠菌的检测限分别为40、10 和20 CFU/mL。见表2。
2.2.4 专属性 3 种菌的引物探针均仅对相应的目的菌株产生扩增曲线,对其他种类细胞基因组DNA均未产生扩增曲线,见图4。表明该方法具有良好的专属性。
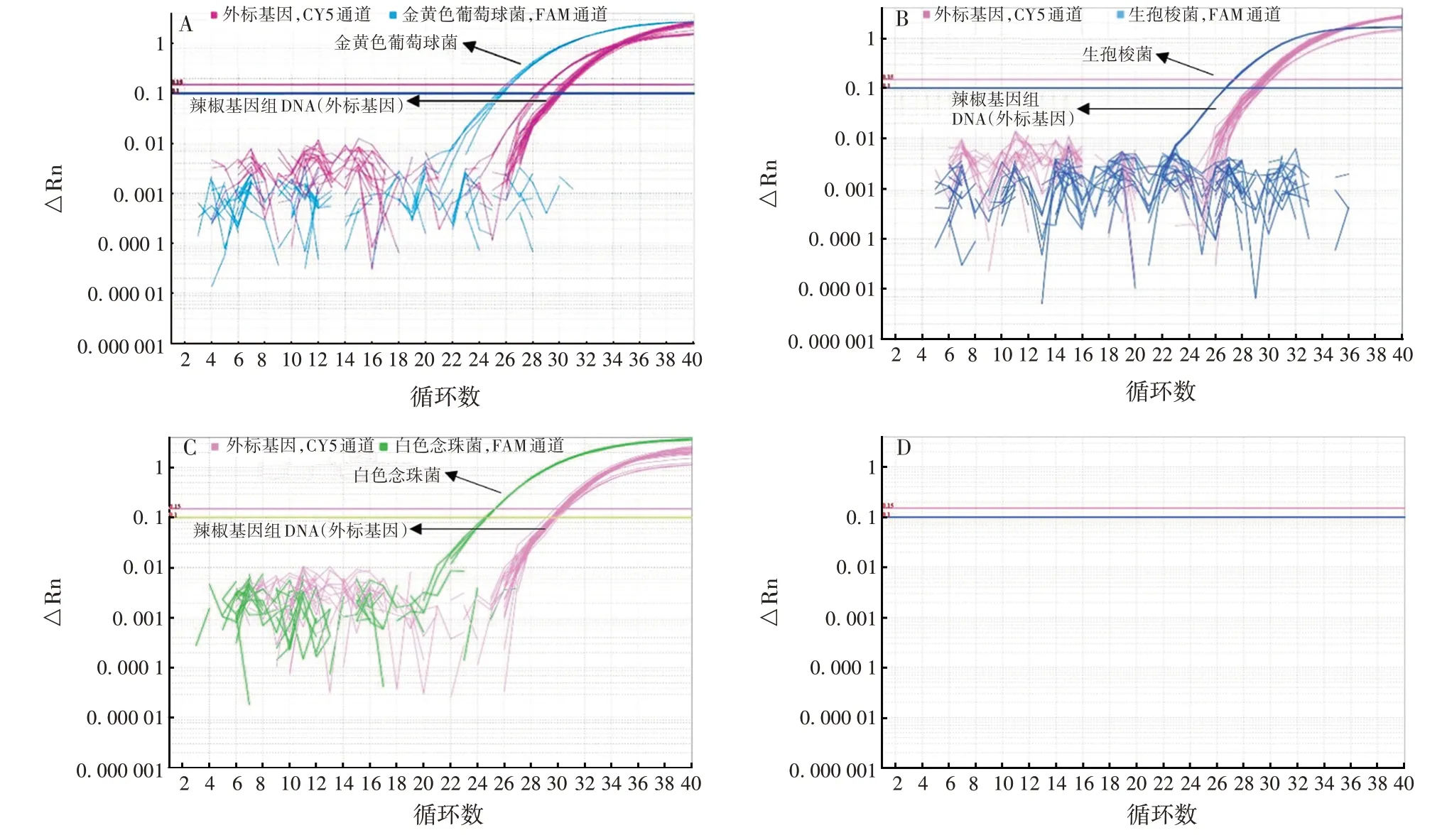
图4 专属性的验证结果Fig.4 Verification for specificity
2.2.5 抗干扰性 较高浓度(108CFU/mL)或较低浓度(102CFU/mL)的菌液中,对照组与其他4 组间Ct差异较小,见图5。表明其他细胞基因组DNA 对目的菌株扩增无明显干扰。
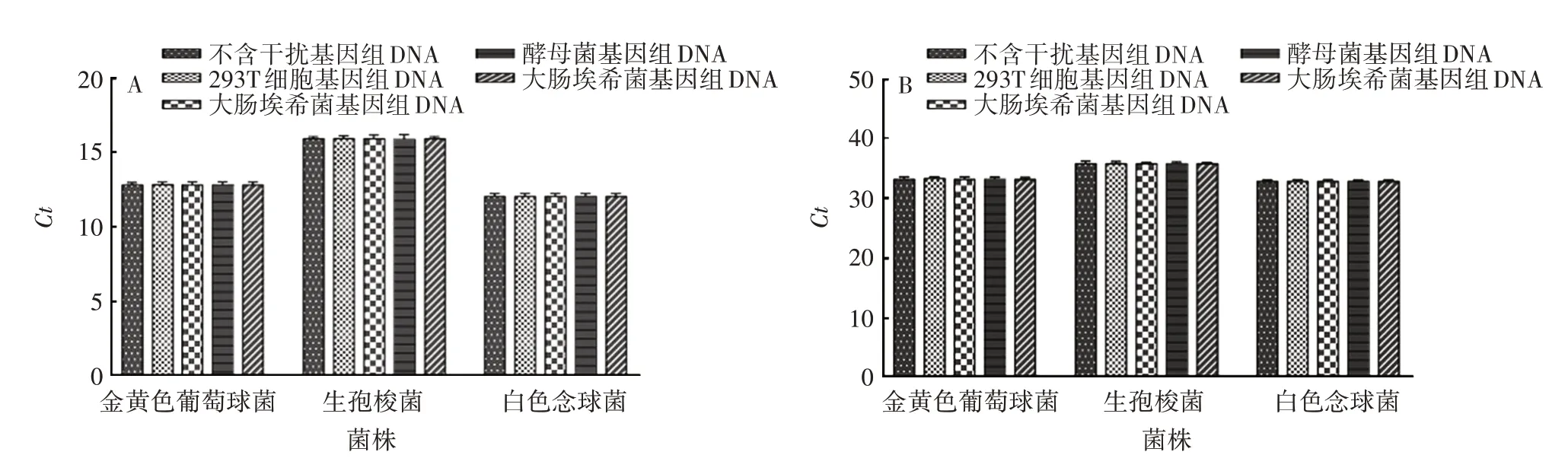
图5 抗干扰性验证结果Fig.5 Verification for anti-interference performance
2.2.6 精密性 3 种菌株重复性和中间精密性验证结果CV均<15%,见表3。表明该方法具有良好的精密性。
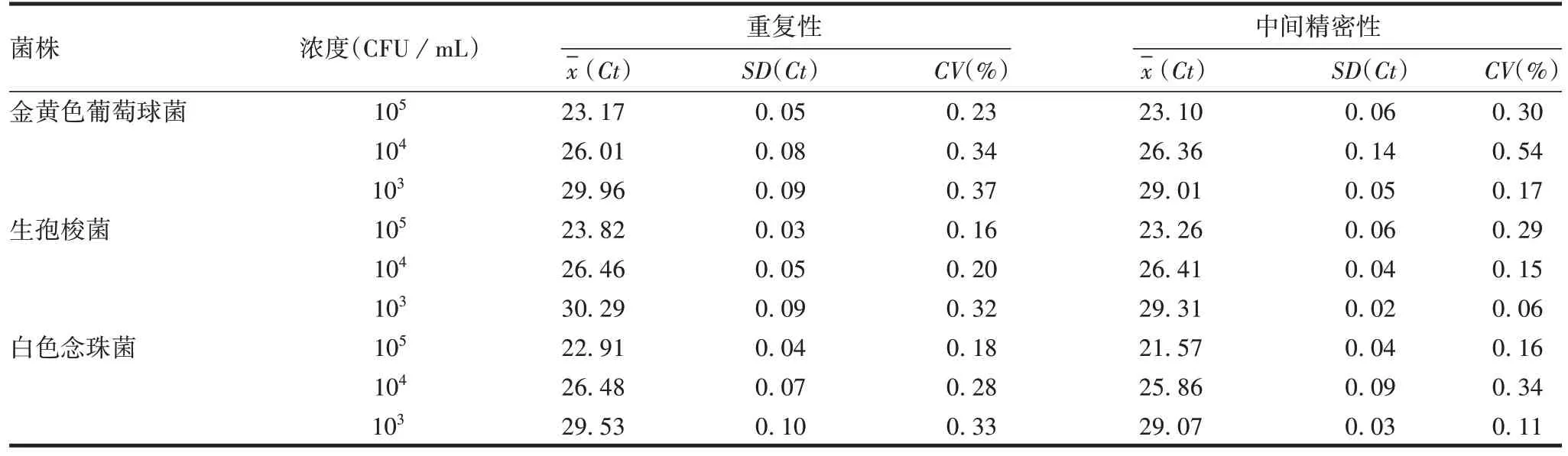
表3 精密性验证结果Tab.3 Verification for precision
2.3 方法的应用 100 份293T 细胞培养液上清样本中,14份呈阳性,86份呈阴性。随机挑选3个阳性样本和2 个阴性样本进行普通PCR 检测,结果与建立的方法相符(电泳图略),测序结果与目的扩增序列结果一致。
3 讨论
为实现多重荧光定量PCR法能够同时检测细菌和真菌污染,本研究选取金黄色葡萄球菌的NUC基因、生孢梭菌的COLA基因和白色念珠菌的ITS-2区段序列,用辣椒UBI3基因作为外标设计特异性引物及探针,建立了细菌的三重检测体系和真菌的两重检测体系,并对方法进行了验证。验证结果表明,建立的金黄色葡萄球菌、生孢梭菌和外标基因的三重荧光定量PCR 检测体系及白色念珠菌和外标基因的双重荧光定量PCR 检测体系可对细胞培养液中的3 种菌进行准确定性及定量。检测限结果表明,3种菌液检测限达101CFU/mL,其原因为:在菌液基因组DNA 抽提前,使用溶菌酶溶解细菌和真菌的细胞壁,提高了基因组DNA 得率;在基因组DNA 抽提反应中加入1 ng辣椒基因组DNA,一方面可作为多重反应体系的外标基因,实时监测反应体系,另一方面可作为外标基因,提高菌液基因组DNA得率;通过加大模板上样量,将模板基因组DNA 的上样量增加至10 μL,也可提高检测反应的检测限。文献报道表明,细菌、真菌检测的灵敏度普遍在50~100 CFU/mL,本研究建立的细菌、真菌反应体系的检测限达101CFU/mL,金黄色葡萄球菌、生孢梭菌和白色念珠菌的检测限分别为40、10和20 CFU/mL,均低于50 CFU/mL,检测的灵敏度和准确性显著提高[13,18-20]。
本研究建立的方法与传统培养定量检测方法比较[21-22],更快速、更全面、更节约时间。目前已有多项研究采用多重定量PCR快速检测细菌或真菌[23-25],但针对细胞培养液中易感染的主要细菌、真菌采用快速检测的报道较少。本研究建立的细胞培养液中常见细菌、真菌的定量快检方法,具有良好的专属性、抗干扰性及重复性,可广泛应用于细胞培养过程中污染监控。

