SARS-CoV-2 mRNA疫苗通用体外生物学活性检测方法的建立及验证
王新竹,赵丹华,苏歧,刘欣玉,姜崴,叶强
1.中国食品药品检定研究院,北京 102629;2.长春生物制品研究所有限责任公司,吉林 长春 130012
SARS-CoV-2 是一种具有高度传播性和致病性的冠状病毒,于2019 年底出现并引发急性呼吸道疾病的大流行,威胁人类健康和公共安全[1-2]。疫苗的研发与生产是控制SARS-CoV-2流行的关键[3]。
mRNA 疫苗是一种全新的疫苗技术,具有研发和生产周期短、易大规模生产的特点[4-6],但其质量控制仍缺少系统的研究数据和经验[7]。对疫苗的体外生物学活性进行评价是评估疫苗有效性的重要手段,在SARS-CoV-2 mRNA 疫苗的质量控制中,体外生物学活性评价方法非常关键,也很复杂。疫情后,可用于COVID-19 研究的体外模型被广泛开发[8-9],但由于各研发企业方法不同,无法对不同企业的疫苗质量进行评价和比较,给疫苗质量控制带来困扰。为此,本研究建立了通用稳定的SARS-CoV-2 mRNA疫苗体外生物学活性检测方法,并进行验证,以期应用于SARS-CoV-2 mRNA疫苗的质量控制。
1 材料与方法
1.1 疫苗原液、成品及细胞 SARS-CoV-2 原型株、Delta、BA.1、BA.2、BA.4/5、XBB.1.5变异株mRNA疫苗原液及Delta、XBB.1.5 变异株mRNA 疫苗成品均由国内企业生产;HEK293T、HEK293、A549 细胞均由中国食品药品检定研究院保存。
1.2 主要试剂及仪器 SARS-CoV-2 S 蛋白ELISA 检测试剂盒A 和B 分别购自国内外两家企业;LipofectamineTM2000 Transfection Reagent(11668019)购自美国Invitrogen 公司;RIPA 裂解和提取缓冲液(89900)购自美国Thermo Scientific 公司;高糖DMEM 细胞培养基(11960044)、Opti-MEM(31985070)、FBS(10099-141)和胰蛋白酶-EDTA(0.25%,25200072)购自美国Gibco 公司;各变异株蛋白分别购自美国Acro Biosystems公司(CAT:SPN-C52H9、SPN-C52Ht、SPN-C522a、SPN-C5223、SPN -C5229、SPN-C5248)和北京义翘神州科技股份有限公司(CAT:40589-V08B1、40591-V08-H16、40589-V08H30、40589-V08H28、40589-V08-H32、40589-V08H40)。
1.3 方法条件的筛选
1.3.1 检测试剂盒的选择 所选用的试剂盒需对各变异株S 蛋白有良好响应。根据市售试剂盒、抗体的技术资料,选用SARS-CoV-2 S 蛋白ELISA 通用检测试剂盒A 与B 分别进行检测。先用剂盒B 对不同变异株的商品化SARS-CoV-2 S 蛋白进行检测:取浓度为50 μg/mL 的变异株蛋白储存液,2倍系列稀释(10 ~640),用ELISA 检测试剂盒测定各稀释倍数下的A450值,以确定试剂盒是否对不同变异株蛋白均有良好响应。在B 试剂盒检测中得到的数据基础上,使用A 试剂盒进行检测,各变异株蛋白稀释至该试剂盒线性区间的中值(2 500 ng/mL)上样,测定各蛋白的A450值并计算浓度。
1.3.2 转染细胞的选择 根据目前各企业体外生物学活性测定所用的表达细胞,选择HEK293T、HEK293、A549 3种细胞进行比较。将细胞浓度均调整至2.5×105个/mL,加入6孔板,1 mL/孔,37 ℃培养20 ~24 h,待细胞汇合度达70%~80%时,分别按1、4、16 μg mRNA转染XBB.1.5 株mRNA 疫苗原液。ELISA 试剂盒检测,重复检测3 次,比较不同转染细胞的表达量,选择转染效率最高的细胞进行后续试验。
1.3.3 细胞铺板浓度的选择 确定转染细胞后,调整6 孔板细胞铺板浓度分别为1.5 × 105、2.5 × 105、4.0×105个/mL,待细胞汇合度达70%~80%时,按4 μg mRNA 转染XBB.1.5 株mRNA 疫苗原液,ELISA试剂盒检测,设2个复孔,重复检测2次,比较不同细胞铺板浓度的表达量。
1.3.4 转染剂量的确定 将各变异株疫苗按不同剂量转染细胞后,ELISA 试剂盒检测蛋白表达量,将蛋白表达量与mRNA 转染量进行线性拟合,选取良好线性范围内的中间剂量作为转染剂量。
1.4 方法的建立
1.4.1 细胞培养 用胰蛋白酶-EDTA(0.25%)溶液室温消化HEK293T细胞,以含10%FBS的高糖DMEM培养基终止消化,收集所有液体,90 ×g离心3 min,弃上清,用含10% FBS 的高糖DMEM 培养基重悬细胞,计数并测定活率后,稀释至2.5×105个/mL(以活细胞计),按每孔2 mL 接种至6 孔板,37 ℃,5%CO2培养箱中培养约24 h。
1.4.2 转染 待细胞汇合度达70% ~80%时取出6孔板,弃去细胞培养液,加入1 mL预热至37 ℃含10%FBS 的DMEM。将转染所用试剂提前30 min 从冰箱取出,平衡至室温。将LipofectamineTM2000以opti-MEM 按1∶35 的比例稀释,静置孵育5 min。用opti-MEM将mRNA疫苗原液、成品、参考品(企业提供)分别稀释,使6 孔板中每孔接种的mRNA 疫苗原液中mRNA 的量分别为2、3、4、5、6 μg,剂量分别为50%、75%、100%、125%、150%,稀释后的样品与稀释后的LipofectamineTM2000等体积混合,室温静置孵育15 min。空白对照不加mRNA样品,其余处理同上。自CO2培养箱中取出6 孔板,按每孔500 μL 将转染液逐滴滴加至孔中,混匀,放回CO2培养箱继续培养20 ~24 h。
1.4.3 蛋白收集 弃去6孔板中的培养基,加入RIPA细胞裂解液,300 μL/孔,室温裂解15 min,枪尖轻刮孔底,收集孔中所有液体,4 ℃,13 200×g离心30 min。吸取上清,得到的蛋白溶液直接进行ELISA 检测,或-20 ℃保存备用。
1.4.4 ELISA检测
使用A试剂盒进行检测,按试剂盒说明书操作。
1.4.4.1 试验前准备 使用前将试剂盒中各组分平衡至室温。用超纯水将试剂盒中20 × Wash Buffer Concentrate稀释成1×Wash Buffer,20×Dilution Buffer Concentrate稀释成1×Dilution Buffer,待用。
1.4.4.2 样品孵育 取出相应板条,洗板后,用1 ×Dilution Buffer 稀释样品,将稀释好的样品及标准品按每孔100 μL 上样,上样浓度应在试剂盒能够检测的线性区间内。室温孵育2 h 后,用1× Wash Buffer洗板3次。
1.4.4.3 抗体孵育 检测抗体Detection Antibody 用1 × Dilution Buffer 按1∶330 稀释,使用前10 min 配置。向板孔中加入稀释后的抗体工作液,室温孵育1 h后,用1×Wash Buffer洗板3次。
1.4.4.4 显色读数 将Color Regent A与Color Regent B等体积混合制备显色液,现用现配,每孔加入100 μL显色液,室温孵育10 ~15 min;加入Stop Solution,5 min内读数,得到蛋白浓度结果。疫苗或原液转染后表达量与参考品转染后表达量的比值为该批疫苗或原液的体外相对生物学活性。
1.5 方法的验证及可接受标准
参照《中国药典》三部(2020 版)通则9401 要求[10],使用Delta株和XBB.1.5株mRNA疫苗原液、成品进行方法的验证,考察方法的相对准确度、中间精密度、线性和范围,4项指标的验证采用合并设计。先用建立的方法对两种不同变异株Delta、XBB.1.5 mRNA疫苗的原液及成品进行体外活性检测,对细胞表达的相应变异株S 蛋白进行定量检测,并计算相对活性。由3名实验员分3 d各自重复检测,共计9次试验。
1.5.1 相对准确度及线性 取至少5个效价水平,每个效价水平的相对偏倚均应在± 30%内,以效价理论值的对数(横坐标)对其相应效价测定值的对数(纵坐标)做线性回归,回归方程的斜率应在0.8 ~1.25范围内,相关系数(R)应不低于0.95。
1.5.2 中间精密度 计算测定值的几何变异系数(geometric coefficient of variation,GCV),每个效价水平相对效价测定值的GCV应小于20%。
1.5.3 范围 相对准确度、中间精密度和线性均符合1.5.1和1.5.2要求时的效价水平范围,该范围应至少涵盖相对效价的质量标准范围(50%~150%)。
1.6 统计学分析 采用SPSS 27.0.1 软件进行统计分析,组间数据的比较采用单因素方差分析(ANOVA检验)。检验时,首先对组内数据进行方差一致性检验,要求P>0.05,满足此条件的基础上再进行组间方差分析,判断95%置信度下组间差异是否有统计学意义。线性拟合图采用Origin 2021软件绘制。
2 结果
2.1 方法的建立
2.1.1 检测试剂盒的选择 检测结果显示,B 试剂盒对BA.4/5和XBB.1.5株蛋白的结合较弱,见表1。A试剂盒对各变异株蛋白均有良好响应,且测定浓度与理论值(2 500 ng/mL)差异较小,见表2。因此选择A试剂盒用于体外生物学活性检测。450
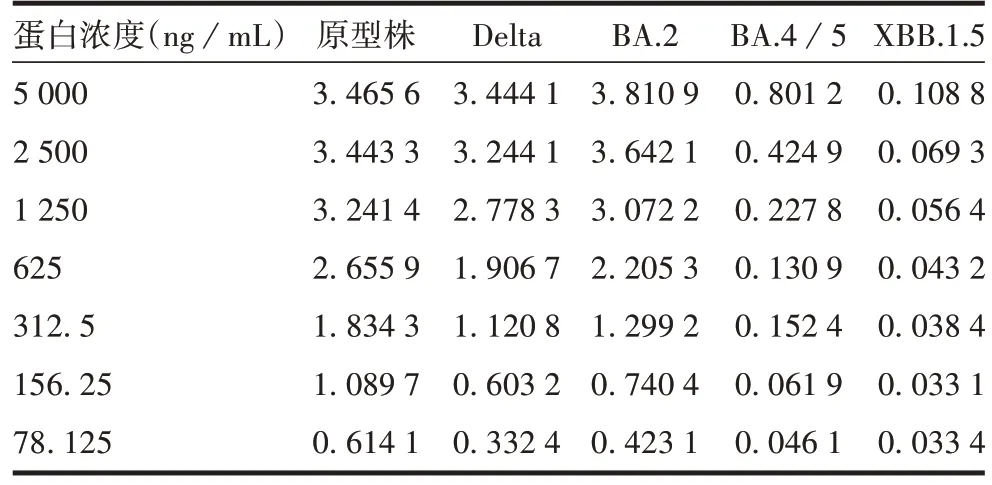
表1 B试剂盒对各变异株S蛋白测定结果(A450)Tab.1 Test results of S protein of each variant by Kit B(A)
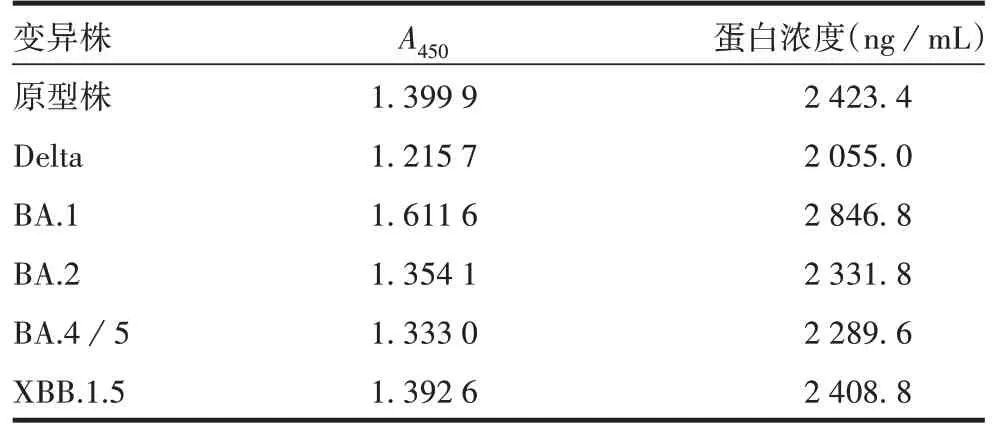
表2 A试剂盒对各变异株蛋白浓度测定结果Tab.2 Test results of S protein concentration of each variant by Kit A
2.1.2 转染细胞的选择 检测结果显示,各转染剂量下HEK293T细胞的蛋白表达水平均明显高于HEK-293 和A549 细胞(F=2 355,P<0.001),见表3。因此选择HEK293T细胞进行后续试验。
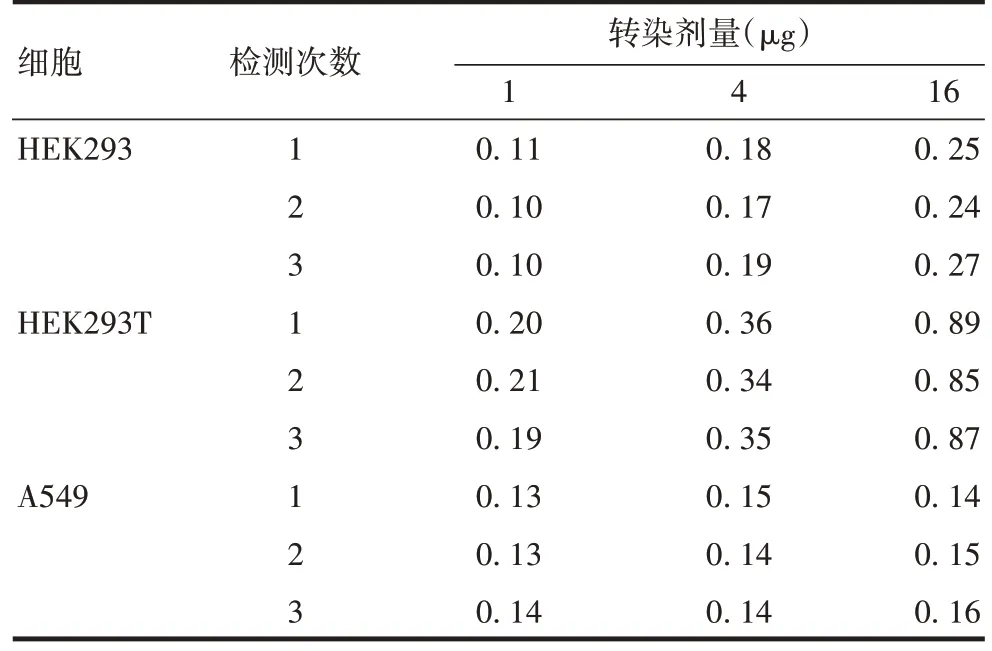
表3 不同细胞表达蛋白的测定结果(A450)Tab.3 Test results of protein expression in different cells(A450)
2.1.3 不同细胞铺板浓度的选择 检测结果显示,不同铺板浓度细胞的蛋白表达水平差异无统计学意义(F=2.139,P=0.174),见表4。选择区间的中间浓度2.5×105个/mL的铺板浓度进行后续试验。
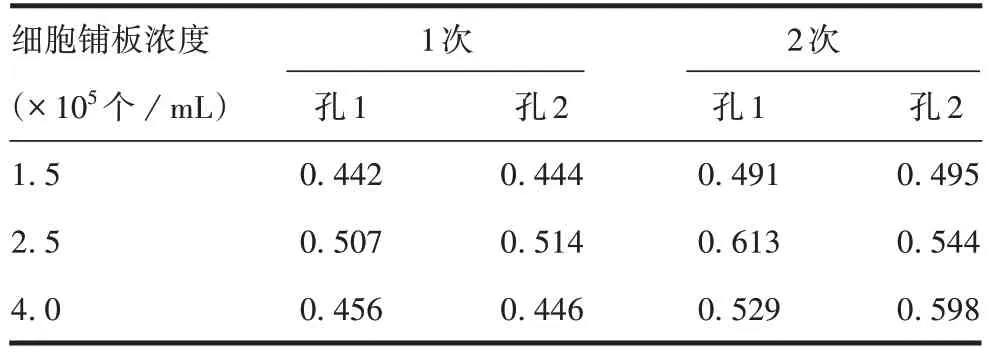
表4 不同细胞铺板浓度表达蛋白的测定结果(A450)Tab.4 Test results of protein expression at different cell concentrations(A450)
2.1.4 转染剂量的确定 检测结果显示,试剂盒测得的原型株、Delta、BA.1、BA.2、BA.4/5 和XBB.1.5体外表达蛋白量与初始mRNA 转染剂量之间具有较好的线性关系,R2分别为0.986 4、0.997 1、0.993 2、0.991 8、0.998 1 和0.987 9,均大于0.98,表明在6孔板接种mRNA 量为1 ~16 μg/孔(BA.1 株为1 ~8 μg/孔)区间内,细胞表达的蛋白量与初始转染mRNA 量具有良好的线性关系。可选择4 μg/孔作为6孔板转染剂量。
2.2 方法的验证
2.2.1 相对准确度及线性 对Delta、XBB.1.5株mRNA疫苗原液及成品进行检测,每个效价水平的相对偏倚均在±30%内,见表5 ~表8。以效价理论值对数对其相应效价测定值对数做线性回归,回归方程的斜率均在0.8 ~1.25 范围内,均符合可接受标准。Delta株mRNA疫苗原液的回归方程为y=0.964 2x+0.023 8,R= 0.961 6;XBB.1.5 株mRNA 疫苗原液的回归方程为y=1.040 1x+0.007 1,R=0.966 5;Delta株mRNA疫苗成品的回归方程为y=1.019 6x-0.007 4,R= 0.967 5;XBB.1.5 株mRNA 疫苗成品的回归方程为y= 0.803 2x+ 0.001 4,R= 0.956 9。见图1。
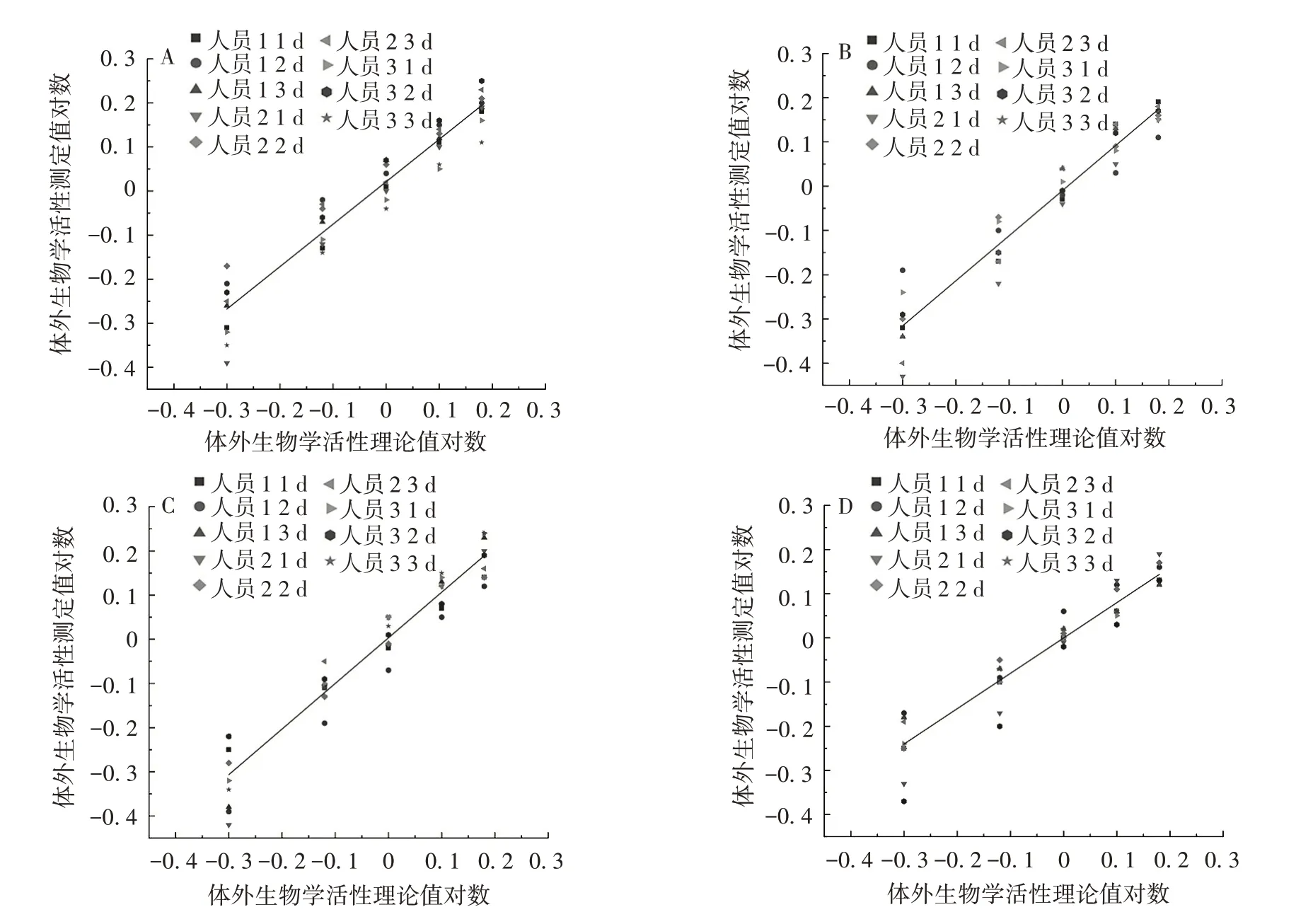
图1 Delta 株mRNA 疫苗原液(A)、成品(B)及XBB.1.5 株疫苗原液(C)、成品(D)体外生物学活性测定对数值与理论对数值的线性关系Fig.1 Linear relationship between measured and theoretical logarithm value of Delta strain mRNA vaccine bulk(A),product(B)and XBB.1.5 strain mRNA vaccine bulk(C),product(D)

表5 Delta株原液体外活性相对效价测定结果(%)Tab.5 Test results of relative potency of Delta strain bulk in vitro(%)
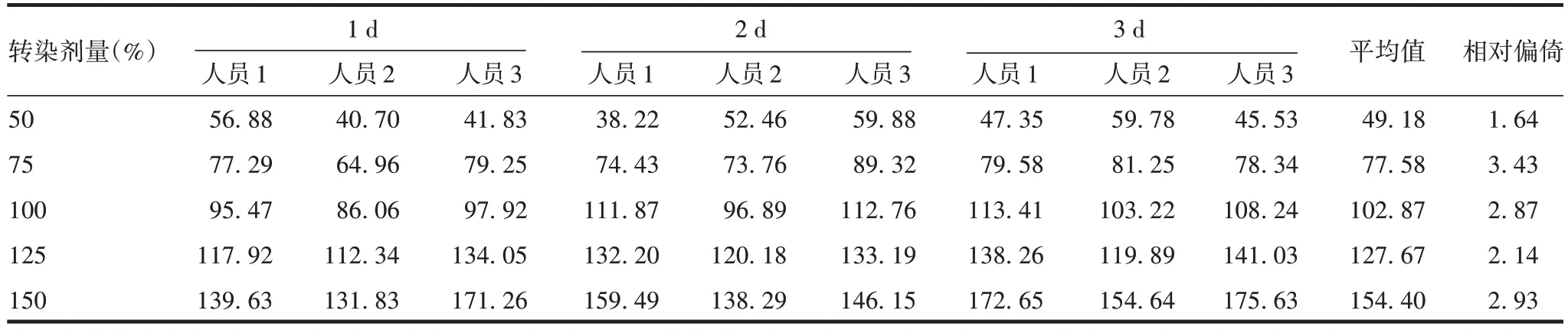
表6 XBB.1.5株原液体外活性相对效价测定结果(%)Tab.6 Test results of relative potency of XBB.1.5 strain bulk in vitro(%)
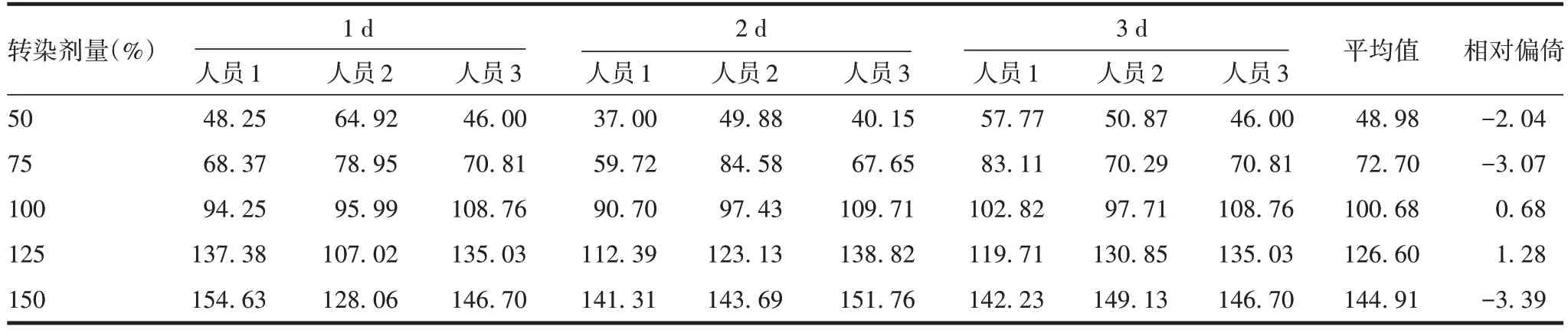
表7 Delta株成品体外活性相对效价测定结果(%)Tab.7 Test results of relative potency of Delta strain product in vitro(%)
2.2.2 中间精密度 Delta、XBB.1.5 株mRNA 疫苗原液及成品每个效价水平相对效价测定值的GCV均小于20%,符合可接受标准,见表9。

表9 9次测定结果的GCV(%)Tab.9 GCV values of nin(%)
2.2.3 范围 该方法的相对准确度、中间精密度和线性均符合要求(效价水平范围为50%~150%),满足常见疫苗体外生物学活性质量标准范围。
3 讨论
疫苗的有效性是评价疫苗质量的重要指标,评价疫苗有效性的方法,一般有体内效力和体外生物学活性两种方法。体内法存在动物需求量大、操作费时及检测结果变异大等缺陷[11],在WHO 推行动物福利3R 原则的背景下[12],以体外生物学活性代替体内效力评价疫苗有效性成为一种趋势[13]。
2022年4月发布的《WHO关于预防传染病mRNA疫苗质量、安全性及有效性评估的法规考虑》中提出,基于细胞的转染表达系统或无细胞测定系统能够用于测定mRNA 能否表达出正确的蛋白质,以此作为测定疫苗效力的方法[14]。2023年USP颁布的第二版《mRNA 疫苗质量分析方法》则明确给出了体外活性方法检测疫苗效力的具体方法以供参考,在这一版指南中,除了同样认为mRNA 编码蛋白的产品评价可通过基于细胞的表达试验进行评估外,也提出表达蛋白功能性结合的评估可通过ELISA进行[15]。
ELISA 法操作简单,敏感性和特异性高,可实现对于SARS-CoV-2 相关蛋白的快速检测[2,16-18]。目前,各mRNA 疫苗企业基本都建立了体外生物学活性的检测方法,大都用疫苗或原液转染细胞,采用ELISA 方法对表达的目的蛋白量进行检测,但具体操作均不同。体外生物学活性检测中,细胞种类、细胞铺板浓度、mRNA 转染量、检测抗体对方法均有影响,本研究对HEK293、HEK293T、A549 细胞的转染表达水平进行比对可以看出,不同细胞的蛋白表达水平具有显著性差异,HEK293T细胞表达水平最高;细胞在同一汇合度情况下转染,细胞浓度对于最终蛋白表达量无显著影响;在一定的转染剂量范围内,mRNA 转染量与蛋白的表达量呈线性,这也符合非自扩增型mRNA 在细胞内表达的原理[19],选取线性中间的转染量作为最终转染剂量,在检测过程中,蛋白表达量差异真实反应了mRNA 转染量差异,避免了平台期蛋白表达量不能有效反应转染量的情况;不同的检测抗体或试剂盒对不同变异株蛋白的结合情况存在较大差别,由于SARS-CoV-2 变异较快,不断有新的变异株出现[20],当对mRNA 疫苗进行体外生物学活性检测时,每种新变异株均需筛选新的抗体或试剂盒,浪费大量人力物力。为了建立通用检测方法,本研究选取了对各变异株S 蛋白均有较好响应的ELISA试剂盒A。
对建立的新方法进行规范的验证是保障新方法适用性的前提[21]。《中国药典》三部(2020 版)通则9401(ChP<9401>)与美国药典(USP 2023)收载的“biological assay validation”(通则1033)(USP<1033>)中均包含相对准确度、中间精密度、线性和范围4 项指标,ChP<9401>和USP<1033>中均推荐评估5 个效价水平,每个水平至少独立测定3 次[22]。参照该要求,在进行生物学活性方法验证时,本研究由3 名实验员3 d 共进行9 次检测,对方法的相对准确度、中间精密度、线性和范围进行考察,转染剂量范围设置为标准转染剂量的50% ~150%,9 次检测后进行拟合。其中相对准确度在《中国药典》中要求在±15%范围内,但参照USP<1033>第2.5 节,相对化学测定或免疫测定法,生物测定具有更大的变异性,可选择更宽松的限制范围[23]。鉴于体外生物学活性测定时,具体的蛋白表达量受细胞状态影响,相对准确度很难达到±15%内,参照实际检验工作情况,将相对准确度范围适当放宽至± 30%区间[24]。除此之外,其余项目设定标准均与ChP<9401>一致。基于目前已上市疫苗及最主要的mRNA 疫苗研究方向[25-26],针对Delta和XBB.1.5变异株疫苗进行了方法的验证,结果发现,针对Delta 和XBB.1.5变异株疫苗,本方法相对准确度、中间精密度、线性均能够达到设定的标准,且相对准确度、中间精密度和线性均符合要求时的效价水平范围(50% ~150%),满足常见疫苗体外生物学活性质量标准范围。
本研究建立了通用的SARS-CoV-2 体外生物学活性检测方法,经验证,该方法能满足Delta和XBB.1.5株SARS-CoV-2 mRNA 疫苗体外生物学活性的检定需求。但由于不同变异株之间的差异,该方法应用于其他毒株及以后出现的新毒株SARS-CoV-2 mRNA疫苗检定时,仍需进行充分的适用性验证。

