单唾液酸四己糖神经节苷脂钠注射液不良反应42例文献分析
张小明,陈强
神经节苷脂为一种鞘糖脂,在哺乳动物神经元细胞中含量丰富,是神经细胞膜的重要组成部分。单唾液酸四己糖神经节苷脂由猪脑提取,经色谱分离和纯化技术制得,由唾液酸寡糖基团和神经酰胺部分构成;其具有良好的亲脂性,可透过血脑屏障,活化细胞膜酶,保护神经细胞并促进损伤的神经细胞重塑及再生,从而改善脑电活动异常[1]。单唾液酸四己糖神经节苷脂钠注射液在临床上应用较广泛,多用于治疗急性脑梗死、颅脑损伤、血管性痴呆、新生儿缺血性脑病及面神经炎等[2-3]。随着该药的广泛应用,除药品说明书上提及的“少数患者使用后出现皮疹反应”外,已有文献报道单唾液酸四己糖神经节苷脂钠注射液导致的其他药品不良反应(ADR)。笔者通过对单唾液酸四己糖神经节苷脂钠注射液ADR报道个案进行整理与分析,研究ADR发生的特点与一般规律,旨在为临床合理用药提供参考。
1 资料与方法
1.1 资料来源 采用计算机进行检索,以“单唾液酸四己糖神经节苷脂钠”“不良反应”“过敏反应”为检索词,在中国知网、万方数据知识服务平台及维普网数据库进行检索。根据单唾液酸四己糖神经节苷脂钠注射液(齐鲁制药有限公司生产)首次上市时间,获取2004—2021年单唾液酸四己糖神经节苷脂钠注射液ADR报告,剔除综述类文献,以个案报道为主要参考文献,删除描述模糊、信息记录不全的文献[4]。共收集到单唾液酸四己糖神经节苷脂钠注射液ADR文献30篇,涉及患者42例。
1.2 方法 阅读并整理筛选后的文献,用Excel软件记录患者的年龄、性别、既往过敏史、给药方式及剂量、累及器官系统、主要临床表现、发生时间、治疗措施、转归情况等有效信息并进行统计分析,计算各类不良反应发生的例数与构成比,依据“Naranjo ADR Probability Scale”分别对每个案例逐一进行关联性评价: >9分,高度可能有关;>5~9分,很可能有关;1~5分,可能有关;<1分,可疑。
2 结 果
2.1 性别与年龄 42例患者中男29例(69.05%),女13例(30.95%),年龄30~91 (61.40±11.02)岁,其中>60岁患者22例(52.38%)。具体见表1。

表1 42例ADR报告中患者的性别与年龄分布
2.2 患者用药原因和既往过敏史情况分析 42例患者中原发疾病包括脑血管疾病(脑出血、脑梗死、脑动脉供血不足)21例,外伤所致的脑损伤4例,以及帕金森病、脊髓血管畸形、脊髓空洞症、感染性脑部疾病、脑膜瘤、腰椎滑脱、颈椎骨折、肢体乏力、肩周炎、三叉神经痛、感染性脑部疾病、面神经炎、右眼间断胀痛、吉兰—巴雷综合征。过敏史情况为皮疹1例,对牛羊肉、花粉及海鲜过敏1例,否认既往过敏史者21例,过敏情况未知19例。
2.3 用药方式与剂量 单唾液酸四己糖神经节苷脂钠注射液药品说明书上推荐的用法用量:(1)病变急性期(尤急性创伤),100 mg/d静脉滴注,2~3周后改为维持量,每天20~40 mg,一般为6周;(2)帕金森病,首剂量500~1 000 mg/d静脉滴注,第2天起200 mg/d,皮下、肌内注射或静脉滴注,一般用至18周。42例中除1例肌内注射20 mg外,其余均为静脉滴注,剂量20~200 mg/d,具体用量剂量见表2。分析原发疾病与相应的用药剂量,除1例病例存在剂量问题,其余病例均符合药品使用说明书的用法用量[5]。

表2 静脉滴注ADR每天用药剂量分布情况
2.4 联合用药 42例中合并用药19例(45.24%),单独用药14例(33.33%),未知9例(21.43%)。所涉及的合并使用药物主要为β受体阻断剂(美托洛尔、硝苯地平、氨氯地平)、血管紧张素相关抑制剂(厄贝沙坦、缬沙坦、来酸依那普利),利尿剂(甘露醇、呋塞米),神经营养药物(脑蛋白水解物、小牛血去蛋白提取物), 血液用药(氨甲环酸、阿司匹林、矛头蝮蛇血凝酶、氯吡格雷),活血通络药(大活络丸、灯盏细辛),抗炎、抗病毒药物(洛芬待因、头孢米诺),维生素类(维生素C、维生素B1、维生素B12),质子泵抑制剂(泮托拉唑钠、兰索拉唑),以及盐酸法舒地尔、奥拉西坦、胞磷胆碱等。
2.5 ADR发生时间 42例中1例患者滴注1 min后出现过敏性休克,最迟为用药14 d后出现神经节苷脂相关性吉兰—巴雷综合征。对ADR发生时间进行分析,在滴注中、滴注结束后及后续一段时间均可发生ADR,见表3。
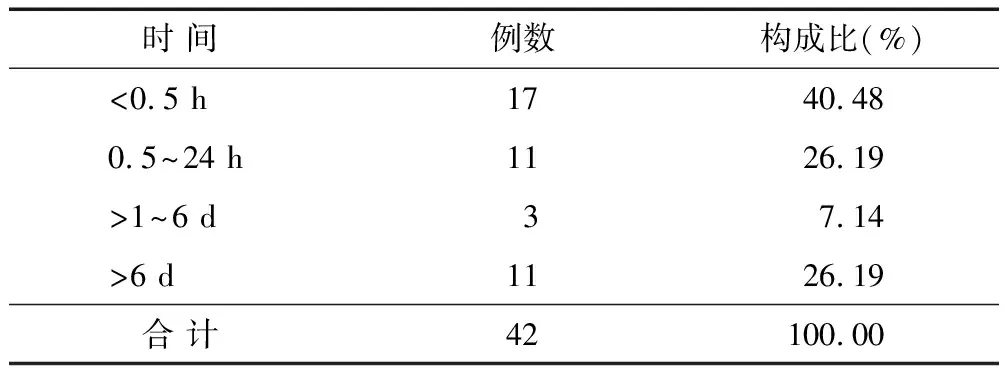
表3 42例ADR发生时间分布情况
2.6 累及器官和系统及临床表现 单唾液酸四己糖神经节苷脂钠注射液不良反应累计器官及系统见表4,包括全身性损害、吉兰—巴雷综合征、过敏性休克、皮肤及其附件损害、肌肉骨骼系统损害、视觉损害、胃肠系统损害、泌尿系统损害;涉及的主要临床症状包括突发寒战、面色发白或发紫、口唇发绀、心悸、头晕、呼吸急促、大汗,以及呼吸困难、肌力下降等吉兰—巴雷综合征相关症状。

表4 42例ADR报道统计
2.7 治疗与转归 42例均进行对症处理治疗,发生吉兰—巴雷综合征ADR患者中3例出现胸闷、四肢无力等症状后停药,4例确诊吉兰—巴雷综合征后停药,1例停药2 d后出现相关症状,2例停药时间未知,均予人免疫球蛋白静脉注射治疗(除1例家属拒绝该治疗方案)。非吉兰—巴雷综合征ADR的32例患者中,除2例于次日滴注时发生轻微寒战、腰痛立即停药外,其余均为ADR发生后并立即停药,进行对症治疗。
2.8 关联性评价 42例报道中,根据“Naranjo ADR Probability Scale”进行评价,很可能有关23例(54.76%),可能有关19例(45.24%),可疑无。具体情况见表4。
3 讨 论
近年来临床研究已证明单唾液酸四己糖神经节苷脂钠注射液在治疗血管性中枢神经系统损伤、颅脑损伤、帕金森病等方面具有良好的疗效,其在临床上的广泛应用使得ADR暴露人群增多,以及医师与患者对用药安全的意识提高,单唾液酸四己糖神经节苷脂钠注射液ADR报告也逐渐增多,报道中也出现了除“少数患者使用后出现皮疹反应”外,其他未在说明书上出现的ADR。
3.1 ADR与性别、年龄 42例ADR患者中男29例,女13例,男∶女为2.23∶1;年龄>50岁者占78.57%,平均年龄(61.40±11.02)岁。这可能是由于原发疾病主要为脑血管疾病,该疾病男性易发于女性且好发于中老年人。提示单唾液酸四己糖神经节苷脂钠注射液在临床上易用于中老年患者,需谨慎监护用药情况。
3.2 ADR与既往过敏史 42例中2例患者存在既往过敏史,21例否认既往过敏史,19例(45.24%)过敏情况未知。反映出有关既往过敏史内容记录不全、不规范的情况仍存在,临床医师需要警惕该问题,仔细详实填写患者的基本信息,以便为后续临床用药提供指导。
3.3 ADR与联合用药 42例患者中合并用药19例,单独用药14例,未知9例。说明联合用药与单独用药对单唾液酸四己糖神经节苷脂钠注射液引起ADR并不是决定性因素。但考虑到与其联合使用的药物种类多且存在中药注射剂、中药丸剂及抗生素类等自身易导致ADR的药物,在临床使用中应该充分考虑到各种药物的相互作用,谨慎用药,减少ADR的发生[6]。
3.4 ADR与发生时间 表3统计结果显示,单唾液酸四己糖神经节苷脂钠注射液在用药的1 min~14 d均会发生ADR。其中,发生时间主要集中在用药的第1天,以过敏反应和过敏性休克为主。在用药的2~6 d内,2例患者第6天发生ADR,分别为过敏性多形性红斑,以及腰痛、全身不适、寒战、发热,肉眼血尿,继之呕吐等全身性不良反应。6~14 d发生ADR的患者有10例为吉兰—巴雷综合征,符合在使用外源性神经节苷脂的5~15 d可发生神经节苷脂相关吉兰—巴雷综合征。需要注意的是,1例患者在连续用药10 d后,停药后第2天出现寒战、高热、脉速;1例为第2次注射单唾液酸四己糖神经节苷脂钠时出现嘴唇麻木、口唇发绀、胸腹部疼痛、尿急、气促, 提示医务人员需密切关注患者的用药反应。此外,1例临床诊断为吉兰—巴雷综合征的患者使用单唾液酸四己糖神经节苷脂钠注射液发生过敏性休克,对该类患者应避免使用外源性神经节苷脂类药物[7]。
3.5 ADR与临床表现 据表4所示,单唾液酸四己糖神经节苷脂钠注射液引起的常见ADR症状为突发寒战、面色发白或发紫、口唇发绀、心悸、头晕、呼吸急促、大汗等全身性损害。该药物的原料来源于动物的脏器,制备的过程包括提取脂质、水解、透析等多个步骤,使用了大量的有机溶剂和高分子物质,复杂的制备工艺是造成其易引起过敏等不良反应的重要原因[8]。根据2015年颁布的《国家食品药品监督管理总局国家药品标准颁布件》,已对单唾液酸四己糖神经节苷脂钠的检验方法和标准进行明文规定,可减少由于制备工艺所造成的相关不良反应。
此外,早在1993年就有报道显示患者在接受外源性神经节苷脂治疗后,出现吉兰—巴雷综合征。吉兰—巴雷综合征以进展迅速的肢体对称性无力、远端感觉减弱或异常为主要症状,严重时伴有呼吸衰竭,其病情的严重程度与病程及后果因人而异。研究表明,感染病原体后,人体会产生相应抗体发生免疫反应。外周神经上的单唾液酸神经节苷脂与空肠弯曲菌的寡多糖成分结构类似,在注射外源性单唾液酸四己糖神经节苷脂后,可能刺激人体免疫系统产生相应抗体,发生抗原抗体交叉反应,从而引起外周神经结构改变,神经功能缺失,诱发吉兰—巴雷综合征[9]。由于临床上使用该药物者多为脑血管疾病的中老年患者,其自身症状与吉兰—巴雷综合征早期症状相似,在用药后5~15 d应关注患者情况,若察觉早期症状,应立即停药,检测血人抗神经节苷脂抗体、进行神经电生理检查等,确诊后采用静脉注射免疫球蛋白或血浆置换等治疗措施,缓解患者症状。此外,42例患者中出现腰痛3例,肉眼血尿1例,说明单唾液酸四己糖神经节苷脂钠注射液所引起的ADR不仅局限于过敏反应和吉兰—巴雷综合征,需临床医务工作者引起重视。
综上所述,单唾液酸四己糖神经节苷脂钠注射液作为对损伤的神经细胞具有修复功能的辅助用药已被广泛用于临床治疗,成为多家医院的重点监控药品[10-11]。目前关于该药的ADR报道较少,且多数报告信息记录不全:未说明用药剂量,未说明患者既往过敏史,对合并用药情况未做说明或详细分析与鉴别等。为保障患者的用药安全,首先,药企应时刻关注并主动收集相关ADR信息,对药物说明书进行修改并加以完善,从制备的角度分析造成不良反应的原因,采取有效的质控措施,降低ADR发生率。其次,临床医护工作者应合理用药,根据药品说明书注意药物剂量、给药方式、溶媒、药物相互作用等问题,保证用药的安全有效,并对用药后的患者密切监护,保障患者生命安全。
利益冲突所有作者声明无利益冲突

