共轭亚油酸对高脂饮食肥胖小鼠肠道微生物菌群的影响
孙趁意,赵建波,李贵,刘霞
(郑州大学第二附属医院 消化内科,河南 郑州 450000)
机体长时间处于“正平衡(摄入能量大于消耗能量)”状态时,脂质过度积累,导致体重增加,进而引起肥胖[1-3]。糖尿病、高脂血症、高血压等所致的心脑血管疾病、肌肉骨骼系统及代谢系统等疾病的发生发展与肥胖密切相关[4-7]。肥胖还会造成该部分人群心理压力明显增大、生活质量下降等一系列问题的出现[8-9]。绝大多数肥胖人群很难长期坚持低脂健康饮食[10]。因此,需要探索一种适合肥胖人群能长期坚持、简便、行之有效的减重方法。共轭亚油酸(conjugated linoleic acid,CLA)是一种多不饱和脂肪酸,可以从各种反刍动物的奶制品及富含亚油酸的植物油中获得[11]。CLA具有多种生理效应,包括抗肿瘤、减轻胰岛素抵抗、降低血糖、减轻肥胖及降低血压等[12-14],通常被认为是一种膳食补充剂[15],已有人群将其作为一种减肥“代餐”。
利用CLA干预高脂饮食小鼠,其能够通过调节胃蛋白的表达并对特定的肠道细菌产生益生元的作用[16]。可见,肠道微生物菌群为CLA的作用位点之一。肠道微生物菌群在食物的吸收与消化上起到重要作用[17]。而高脂饮食导致机体肠道微生物菌群紊乱,进一步加重肥胖的形成[18]。为了解肠道微生物菌群在CLA减轻高脂饮食小鼠肥胖中所起的作用,促进CLA作为膳食补充剂的进一步应用进行了本研究,期望能为GLA的临床研究应用提供实验数据。
1 材料和方法
1.1 实验动物及饲料
于北京维通利华实验动物技术有限公司[许可证号SYXK(京)2022-0052]购买24只4周龄雄性LDLR-/-小鼠。本研究经郑州大学第二附属医院医学伦理委员会审批(2022248)。于鼠来宝(武汉)生物科技有限公司购买小鼠饲料。其中高脂饲料的营养成分组成:蛋白质15%,碳水化合物25%,脂肪60%。
1.2 试剂和仪器
本次实验所需的CLA乳液、TRIzol和HE染色试剂盒分别购于武汉绿景丰华生物科技有限公司、北京普利莱基因技术有限公司和上海碧云天生物技术有限公司。电子显微镜购自Carl Zeiss公司,实时荧光定量PCR仪购自ABI公司,血糖仪购自Roche公司。
1.3 造模、分组及干预
小鼠在SPF级动物房适应性喂养7 d后,随机分为3组(正常组、高脂组和干预组),每组8只。普通饲料用于喂养正常组小鼠,高脂饲料同时喂养高脂组小鼠及干预组小鼠,正常组及高脂组小鼠分别于每天上午9:00接受生理盐水灌胃(0.1 mL·10 g-1)、干预组小鼠于每天上午9:00接受CLA灌胃(0.1 mL·10 g-1)。3组小鼠均连续干预16周,实验过程所用小鼠均未出现死亡。
小鼠Lee’s指数和肝脏指数。Lee’s指数[19]=体重(g)×103/体长(cm),肝脏指数=肝脏重量(g)/体重(g)。小鼠处死前称重、测体长(小鼠鼻尖至肛门的距离,单位为cm),处死小鼠后取肝脏组织并称重。
口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)应于干扰结束前2 d进行。应用25 g·L-1的葡萄糖溶液给小鼠灌胃(0.1 mL·10 g-1),之后分别于灌胃后0、15、30、60、90、120 min通过血糖仪检测血糖。
小鼠血脂及血清胰岛素数据。 用摘眼球法对小鼠进行取血操作,用离心管采集小鼠眼球血,于室温下静置2 h,待血液凝固血块收缩后,以4 000 r·min-1离心10 min钟后得到血清,取上清于干净的离心管中,暂存于-20 ℃备用。按照试剂盒说明检测各指标的含量(于南京建成生物工程研究所完成)。
RNA提取、逆转录及RT-PCR。取50 mg小鼠回肠组织,加入TRIzol试剂进行充分研磨,随后依次加氯仿进行震荡、离心,取上清于干净的离心管中,加入异丙醇再次离心、弃上清,加入体积分数为75%的酒精洗涤沉淀,以此提取总RNA;应用ReverTra Ace qPCR RT Kit和SYBR Green试剂盒(东洋纺生物科技有限公司)进行后续操作,反应结束后,通过2-ΔΔCt方法进行数据处理。各引物序列如下。ZO-1:(F)5’-CTCCAGGTGCTTCTCTTGCT-3’,(R)5’-TATCTTCGGGTGGCTTCACT-3’。TLR4:(F)5’-TCTCAGCAGTTGCTTCTTCTT-3’,(R)5’-CCAGAGCCGGGAGTGTACAA-3’。
TNF-α:(F)5’-AAGGGGAGGAAGTCCTGTTG-3’,(R)5’-TCTGTAGAGTGGGAGGTGC-3’。Ocln:(F)5’- AGAACAGGAGGGACTGCTCTTTTTG -3’,(R)5’- CCAGGCTATAGCCTTTGGCAGGGCTCG -3’。
小鼠回肠组织病理变化。离体的小鼠回肠组织应用甲醛溶液充分固定,再按照浸泡、脱水、包埋的步骤完成所有程序后,进行连续切片从而得到回肠组织病理切片,随之进行HE染色,封片后在电子显微镜下观察小鼠回肠组织的病理改变。
小鼠肠道菌群的16S rDNA高通量测序。干预结束后,收集3组小鼠的粪便于灭菌冻存管中,随后立即转入-80 ℃超低温冰箱冻存备用,送至上海美吉生物医药科技有限公司进行测序。
1.4 统计学方法

2 结果
2.1 CLA对小鼠体重、糖耐量、肝脏指数和Lee’s指数的影响
每隔2周测量小鼠体重。前4周,小鼠体重差异无统计学意义(P>0.05)。随着实验进展,相对于高脂组与干预组的小鼠体重的明显增加,正常组小鼠的体重增加比较缓慢。实验第10周之后,干预组小鼠的体重低于高脂组小鼠(P=0.023)(图1A)。OGTT实验发现正常组小鼠的血糖在30 min时达到峰值,120 min时恢复到实验前水平。图1B显示高脂饮食导致小鼠血糖急剧上升,在15~90 min处于较高水平(>30 mmol·L-1),120 min时仍未降至实验前水平。GLA结果显示干预组小鼠的血糖峰值明显低于高脂组小鼠的血糖峰值,且各时间点血糖均低于高脂组(图1B)。高脂组小鼠OGTT曲线下面积明显增加(P<0.001)。和高脂组相比,干预组小鼠OGTT曲线面积出现下降(P<0.001)。为了解CLA对肥胖小鼠中主要器官的影响,计算肝脏指数,高脂组小鼠的肝脏指数较正常组小鼠增加(P=0.034),而CLA干预16周后,高脂组小鼠的肝脏指数降低(P=0.035)。CLA降低了肥胖小鼠的Lee’s指数(P=0.030 )。见表1。

表1 各组小鼠OGTT曲线下面积变化、肝脏指数 和Lee’s指数

A为小鼠体重曲线图;B为小鼠血糖曲线图。
2.2 CLA对小鼠血清胰岛素和脂质的影响
相对于正常组小鼠,高脂组小鼠的血清胰岛素、血清甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL)和总胆固醇(total cholesterol,TC)均升高(P<0.05)。CLA灌胃16周后,干预组小鼠的血清胰岛素、TC、TG、LDL水平较高脂组下降(P<0.05)。相对于正常组小鼠,高脂组小鼠血清中高密度脂蛋白(high density lipoprotein,HDL)含量下降(P=0.003),干预组小鼠血清HDL含量在CLA干预后升高(P=0.041)。见表2。

表2 各组小鼠血清脂质和胰岛素变化情况
2.3 CLA对小鼠回肠炎症因子水平、肠道紧密连接蛋白和回肠组织病理的影响
肥胖小鼠的回肠炎症因子TLR4在mRNA水平的相对表达量约为正常饮食小鼠的90倍,相对于正常组对照是明显增加,同时TNF-α在mRNA水平的相对表达量也升高,约为正常组小鼠TNF-α表达量的40倍。小鼠体内的TLR4和TNF-α相对表达量在CLA干预下可以降低(见表3)。高脂组小鼠体内的Ocln(P<0.001)和ZO-1(P=0.001)在mRNA水平的相对表达量低于正常组。ZO-1和Ocln相对表达水平在CLA干预后上升(见表3)。通过HE染色,发现高脂饮食会造成小鼠回肠组织结构紊乱、细胞核染色变浅、组织细胞间隙增大、上皮细胞脱落、坏死,而CLA干预后,干预组小鼠的回肠组织结构较高脂组小鼠改善,说明GLA能够降低高脂组小鼠的肠道通透性。见图2。

表3 各组小鼠回肠炎症因子、肠道紧密连接蛋白相对表达量
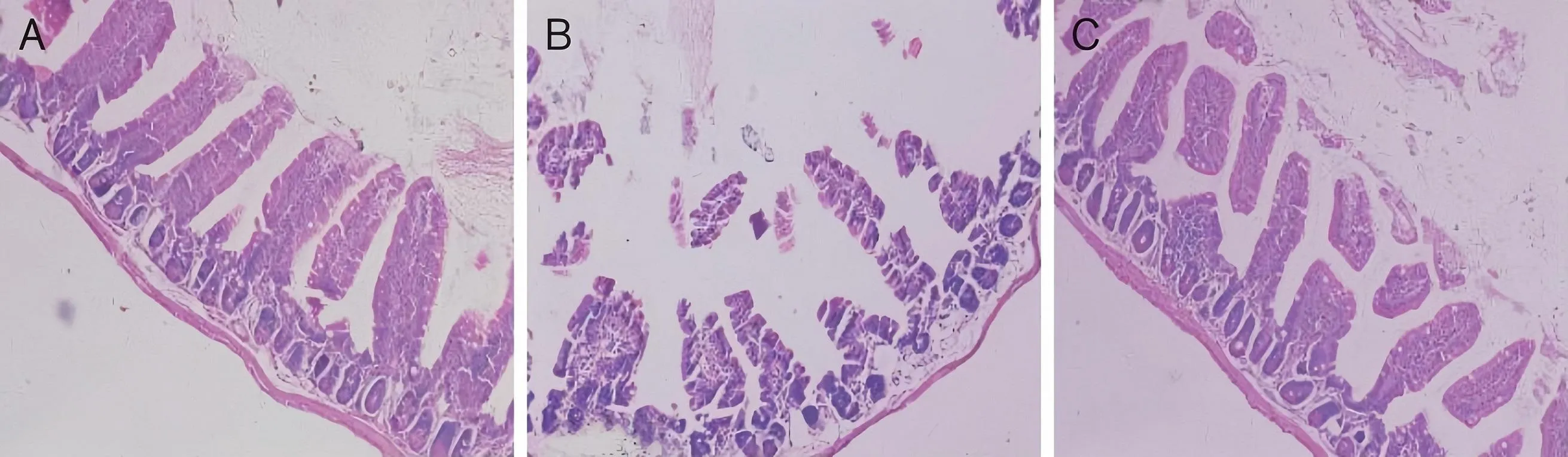
A为正常组;B为高脂组;C为干预组。
2.4 CLA对小鼠肠道微生物菌群的影响
通过对小鼠肠道菌群Alpha多样性分析观察到:高脂组小鼠的Chao指数相对于正常组小鼠有所下降(P<0.05),而干预组小鼠Chao指数在GLA干预后则增加(P<0.01)(图3A)。相对于正常组,在门水平上,肥胖小鼠肠道菌群的放线菌门丰度增加、厚壁菌门丰度降低。干预组小鼠肠道微生物菌群中厚壁菌门丰度在CLA干预后明显增加,放线菌门丰度则有所下降(图3B)。相对于正常组,在属水平上,高脂组小鼠肠道微生物菌群中乳酸杆菌丰度下降(由19.56%下降至10.25%),而CLA能显著增加小鼠肠道微生物菌群双歧杆菌丰度由2.21%下降至24.36%。(图3C、D和E)。

A为Chao指数;B为门水平物种组成;C为正常组属水平物种组成;D为高脂组属水平物种组成;E为干预组属水平物种组成。
3 讨论
肥胖是指体内贮存的脂肪量超过理想量的20%以上,当体重指数≥30 kg·m-2时,被认为已处于肥胖的状态[20-21]。近年来,越来越多的研究表明肥胖与肠道微生物菌群密切相关,肠道微生物菌群能够调节宿主的代谢,促进肥胖的发生与发展[22]。目前研究认为,在正常进食时适当补充双歧杆菌、乳酸杆菌等有益微生物可能会预防或减少肥胖的发生[23]。从而推断,若能够将肠道微生物菌群的结构进行改善,可能进一步阻断肥胖的发生、发展。
本次实验中用到的LDL受体基因敲除小鼠,是研究肥胖的理想模型之一。因为LDL的主要作用是转运内源性胆固醇,当LDL的受体缺失时,LDL就无法正常代谢,血浆胆固醇即可升高,进一步引起脂质累积,最终造成肥胖[24]。相对于正常组小鼠,在本实验中观察到高脂饮食导致小鼠体重明显增加,Lee’s指数进一步印证了小鼠肥胖的发生。OGTT和血清胰岛素结果表明高脂组小鼠出现了明显的胰岛素抵抗和糖耐量受损的情况。CLA干预后,小鼠体重明显下降,且糖耐量受损也有所改善。实验结果显示,CLA降低肥胖小鼠TC、TG、LDL的含量,增加了HDL的含量。Druart等[25]研究发现,CLA具有显著减轻肥胖小鼠体重、改善糖脂代谢等功能。高脂饮食能够引发小鼠肠道炎症,并导致小鼠肠黏膜屏障功能受损[26],为了评价CLA对肠道炎症和肠黏膜屏障的影响,检测了回肠炎症因子和肠紧密连接蛋白的相对表达水平。实验结果表明,CLA能够显著改善肥胖小鼠肠道内炎症水平,降低肠道通透性。
肠道菌群测序结构表明,高脂饮食诱导的肥胖小鼠的Chao指数相较于正常组小鼠的Chao指数明显降低,而经过CLA的干预,发现干预组小鼠的Chao指数又产生了上升趋势,这说明高脂饮食会导致小鼠肠道菌群的多样性降低,而GLA能够逆转这种改变,GLA能够明显提高小鼠的肠道菌群多样性。本实验发现肥胖小鼠的放线菌门和厚壁菌门丰度降低,与Zhou等[27]的研究结果是一致的。研究证实,乳酸杆菌、双歧杆菌有改善机体糖脂代谢水平和降低炎症水平等多种生物功能[28-29]。本研究中,CLA能够明显提高小鼠肠道菌群的双歧杆菌丰度,而乳酸杆菌丰度变化不明显,这可能与研究时间短、样本数量小等原因有关。
CLA在结构上被认为是一种反式脂肪酸,有研究表明食用反式脂肪酸的消耗量可能与冠心病危险因素呈正相关[30],但美国食品和药物管理局未将CLA归类为反式脂肪酸。CLA有多种生理功能,因此已被作为“膳食补充剂”而应用,在乳制品、食物或者饮料中添加CLA是增加其摄入的常用方法[31]。机体肠道微生物菌群可能是CLA的作用位点之一,Den等[32]实验表明,trans-10,cis-12CLA饮食补品能够优化高脂高蔗糖小鼠的肠道微生物菌群,增加乳酸杆菌含量,同时粪便中丁酸盐和血浆乙酸盐的浓度升高了2倍,血浆乙酸盐的浓度升高了1.5倍。有研究表明,丁酸盐对机体的能量平衡产生积极影响,并能够防止饮食所引起的肥胖[33]。因此,推测CLA能够影响机体肠道微生物菌群,改善肠道微生物菌群结构,增加了产丁酸盐细菌含量,进而延缓肥胖进展。
4 小结
CLA可能通过改善高脂饮食组小鼠的肠道菌群结构,提高厚壁菌门和双歧杆菌丰度,进一步减轻肥胖小鼠体重,调节糖脂代谢,降低肠道内炎症因子的表达量及恢复肠黏膜屏障功能。CLA作为一种膳食补充剂,必将有更为广泛的应用。但本实验存在不足之处,未能明确粪便中短链脂肪酸的含量变化。在下一步实验中,将进一步研究,了解CLA对肥胖小鼠内肠道短链脂肪酸的影响变化。

