低温胁迫对不同耐寒红树植物幼苗光合生理和抗氧化特性的影响
许明海,冯 瑜,童宇艳,岳丹斐,张慧玉,郑春芳*
(1. 平阳县自然资源和规划局,浙江 温州 325400;2. 城镇水污染生态治理技术国家地方联合工程研究中心 温州大学生命与环境科学学院,浙江 温州 325035;3. 奉港中学,浙江 宁波 315500;4. 武义县实验小学,浙江 武义 321200)
红树林分布于热带和亚热带海湾、河口滩涂上以红树植物为主的常绿乔木、灌木组成的木本植物群落,具有促淤防浪护岸,护堤固滩、促淤固滩、净化水体、美化景观、维持湿地生物多样性以及固碳储碳等重要生态功能[1-2]。温度是限制红树植物地理分布的重要因素[3]。中国红树林植物种类随纬度的升高和平均温度的下降而减少,其中,最南的海南省红树植物种类有24 种,而人工引种最北界浙江仅有1 种[4]。近些年来,全球变暖已经成为不争的事实,这势必对红树林生长产生影响。红树林是嗜热植物,主要分布在南北半球25 ℃等温线内,而以全球变暖为主要特征的全球气候变化可促进红树林向更高纬度引种,目前红树林的自然分布北界可由现在的福建福鼎北扩至浙江,甚至已经开始在杭州尝试种植[5]。然而,另一方面,因气候变化带来的频繁极端低温灾害又对红树林生态系统造成了极大的伤害和严重威胁,尤其是生长最北缘的红树植物[6-7]。多年引种经验表明,限制我国高纬度地区红树分布的主要因素是温度,其中极端最低温度是主要限制因素之一[4],这主要表现在极端低温会引起红树植物光合器官受损,抗氧化系统失衡,光合电子传递受阻,生长发育停滞,叶片发黄脱落,植株营养物质损失,成熟植株提前落花落果,甚至死亡等[8-10],详见图1。因此,解析红树林对低温胁迫响应与适应机制已成为提高红树林抗寒性的重要课题。

图1 2015 年不同树龄红树林极端低温伤害症状Fig. 1 The symptoms of extremely cold events damage on mangroves in 2015
秋茄(Kandelia obovateSheue et al.)为红树科秋茄树属常绿灌木或小乔木,是我国境内分布最广、纬度分布最高、最耐寒的红树植物,在我国引种成林的最北缘为浙江西门岛[11]。红榄李(Lumnitzera littore(Jack.)Voigt)是使君子科榄李属的红树植物,主要分布于东非到西太平洋、澳大利亚亚热带地区和中南半岛,目前我国野生种数量仅有9 株,唯一分布地在三亚铁炉港[12]。红榄李生长于易受人为干扰的高潮带,是嗜热窄分布的濒危红树植物[13-14]。研究认为,红榄李濒危的主要原因主要包括:种群遗传性多样性较低,野生个体数量较少,有性生殖存在障碍等[15]。一般来说,红榄李对温度的要求也较为苛刻。据调查,红榄李仅能生长在年平均温度为21~25 ℃,且全年无霜的滩涂上,这导致红榄李对低温的影响较为敏感。目前,对红树植物低温胁迫的研究主要集中在秋茄、白骨壤、桐花树等[16-17]上,而将我国分布最南(低温敏感)的红榄李与最北(耐寒)秋茄置于相同低温下比较其对温度耐性的生理机制研究还报道甚少。本研究以低温敏感型红榄李和耐寒型秋茄幼苗为试验材料,通过比较分析两种红树植物在不同低温时间处理下的光合生理参数、荧光参数、光合色素含量、活性氧含量、抗氧化系统中关键酶活性以及叶绿体超微结构、气孔开放特征等变化,探讨两种红树植物响应低温的光合生理和抗氧化特性差异,以期为我国红树林资源保护与抗寒机制研究提供理论依据。
1 材料与方法
1.1 供试材料
2021 年10 月初,分别将来自福建漳江口红树林国家级自然保护区(117°24′~117°30′ E,23°53′~23°56′ N)和三亚铁炉港红树林自然保护区(109°42′~109°44′ E,18°15′~18°17′ N)已培育1 a 的健壮秋茄、红榄李幼苗(生长在规格为13 cm × 13 cm 营养杯中)装入高30 cm、直径为20 cm 的聚乙烯塑料桶内。小心剪开营养杯的底部,使幼苗根系能够直接接触塑料桶底部,加入一定量的Hoagland’s 营养液,使塑料桶底部营养液3 cm 左右深。将其摆放在人工气候室(昼夜温度28 ℃/25 ℃)内培养,适应恢复15 d。恢复期间每2 d 更换一次Hoagland’s 营养液。
1.2 实验设计
选择大小一致的秋茄和红榄李幼苗,移至昼夜温度为25 ℃ /20 ℃,光照周期为12 h /12 h,光强为 400 μmol·m-2·s-1,相对湿度为65%~70%的智能培养箱内,适应10 d。随后将两种红树植物幼苗均分成2 组,一组仍保留在温度25 ℃ (昼) /20 ℃ (夜)的光照培养箱内,作为对照;另一组移入温度为7 ℃(昼)/4 ℃(夜)的冷光源植物生长箱(DGX-260E)进行低温胁迫处理(简称为LS),在低温处理24、48 h 时,分别取对照和两种红树植物幼苗顶端完全展开的倒三对叶片进行光合、荧光以及生理指标测定;每个处理3 盆,3 次重复。
1.3 测定项目与方法
1.3.1 光合参数的测定 使用Li-6400 型便携式光合仪于9:30—11:30 测定顶端完全展开的倒三对叶片的净光合速率(Pn)、细胞间隙CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率参数。测定时设定内置红蓝光源光强为400 μmol·m-2s-1,CO2浓度均为(410 ± 3)μmol·mol-1,气体流速设为500 μmol·s-1。气孔限制值(Ls)计算公式为:Ls=1-Ci/Ca
1.3.2 叶绿素荧光参数 使用FMS2 调制式荧光测定仪(英国Hansatech 公司)进行叶片叶绿素荧光参数测定。测定时先测定光适应下的稳态荧光(Fs)、最大荧光(Fm’)等参数,暗环境下适应30 min 后,测定初始荧光(Fo)、最大荧光(Fm)和PSII 最大光化学效率(Fv/Fm)。根据Yuan 等[18]的方法计算PSII 实际光化学效率(ФPSII)、光化学猝灭系数(qP)以及非光化学猝灭系数(NPQ)。
1.3.3 光合色素的测定 称取0.1 g 秋茄、红榄李幼苗叶片剪碎放入25 mL 的1:1 无水乙醇和丙酮提取液中。置于黑暗环境下提取至叶片发白,测定提取液在665、649 和470 nm 处的吸光值,参照李合生[19]方法计算叶绿素a、叶绿素b、总叶绿素以及类胡萝卜素含量。
1.3.4 超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和丙二醛(MDA)含量的测定 分别取1.0 g 秋茄、红榄李幼苗叶片,加3 mL 50 mmol·L-1pH7.5 Tris-HCL 缓冲液后进行冰浴研磨,离心30 min,取上清液待测。用氯化硝基四氮唑蓝(NBT)法测定SOD 活性[20],采用愈创木酚法测定POD 活性[20];按Du 和Bramlage[21]方法测定MDA 含量。
1.3.5 过氧化氢(H2O2)与超氧阴离子(O2·-)含量的测定 参照彭建等[22]钼酸铵法测定样品过氧化氢酶活性。利用羟胺氧化法[23]测定样品O2·-含量。
1.3.6 叶绿体超微结构和气孔扫描电镜 分别取各实验小组叶片进行裁剪为长条形1 × 2 mm(避开主脉),将取样叶片正反面标记进行真空处理,确保样品沉入固定液中,其中叶绿体透射电镜标本采用5% 戊二醛固定液,气孔扫描电镜标本选用2.5%的戊二醛固定液。使用JEOL JEM-1230 透射电镜和Zeiss Gemini 300 扫描电镜进行样本观察。
测量之前先用图片中的10 μm 微尺定标,利用ImageJ 软件测量单个气孔的气孔长、气孔宽,并按照张翠等[24]方法计算气孔开度。同时,利用软件中的polygon 工具测量气孔面积。每个处理测量3 个样本,每个样本测量10 个视野。
1.4 数据统计分析
通过SPSS 10.0 统计软件进行单因素方差分析(One-way ANOVA)进行数据比较,采用Duncan’s 法检验处理间差异的显著水平(P<0.05)。图中数据均为平均值 ± 标准偏差,通过SigmaPlot 10.0 绘图软件作图。
2 结果与分析
2.1 低温胁迫对两种红树植物幼苗生长和叶片气体交换参数的影响
由图2 可知,在低温胁迫48 h 时,秋茄幼苗叶片并未产生明显的变化,而同样低温处理下红榄李幼苗叶片出现萎蔫现象,即叶片明显下垂。

图2 低温胁迫对两种红树植物幼苗生长情况的影响Fig. 2 Effects of low temperature stress on growth of two mangrove seedlings
由表1 可知,秋茄和红榄李幼苗叶片净光合速率(Pn)均随着低温胁迫时间的增长而显著下降,甚至低温胁迫48 h 处理下红榄李幼苗叶片Pn甚至降至-0.33 μmol·m-2·s-1。与对照相比,低温胁迫下两种红树植物叶片Pn下降幅度存在着较大的差异,且降低幅度随胁迫时间延长而增加。例如,与对照相比,低温胁迫48 h 处理下,秋茄幼苗叶片Pn下降幅度约为82.1%,而红榄李幼苗叶片Pn下降幅度约为105.2%。此外,低温胁迫48 h 处理下,秋茄幼苗叶片Pn下降幅度为红榄李约为79%,表明秋茄耐寒性较高于红榄李。
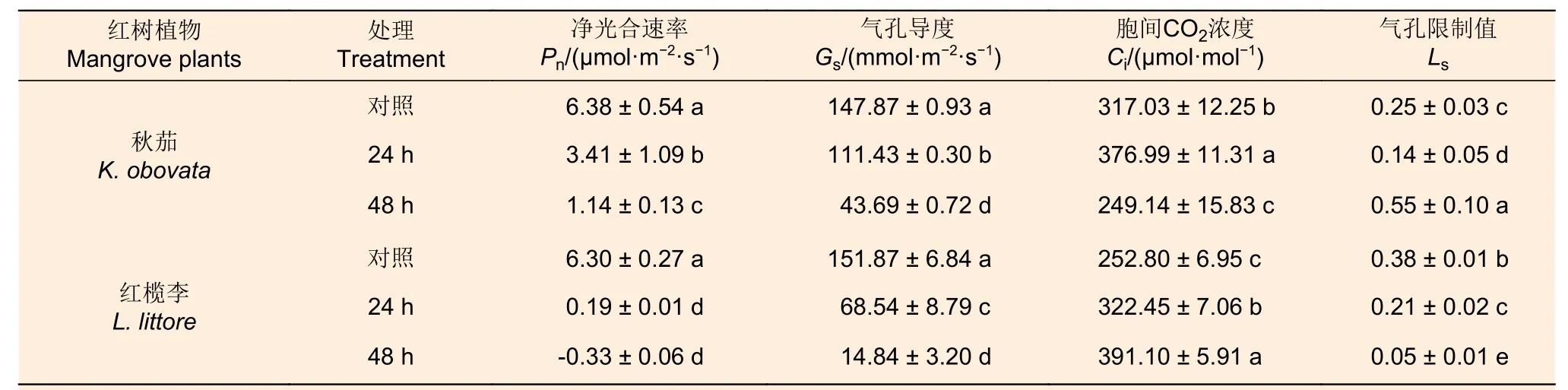
表1 低温胁迫对两种红树植物幼苗叶片气体交换参数的影响Table 1 Effects of low temperature stress on gas exchange parameters in leaves of two mangrove seedlings
不同低温胁迫处理下两种红树植物叶片气孔导度(Gs)变化趋势与Pn相似(表1)。与对照相比,低温胁迫24 h 处理下,秋茄和红榄李幼苗叶片Gs分别下降25%和55%,而低温胁迫48 h 处理下两种红树植物叶片Gs分别下降70%和90%,这表明红榄李幼苗叶片Gs对低温响应比秋茄更为敏感。
由表1 可知,随低温处理时间延长秋茄幼苗叶片胞间CO2浓度(Ci)呈先增后降的趋势,而红榄李幼苗叶片Ci却逐渐增加。在低温胁迫24 h 处理下,秋茄、红榄李幼苗叶片Ci为对照的1.19 倍和1.28 倍。然而,与对照相比,低温胁迫48 h 处理下,秋茄幼苗叶片Ci降低了21%,而红榄李幼苗叶片Ci则增加了55%。
随低温胁迫时间延长,红榄李幼苗叶片气孔限制值(Ls)持续降低,而秋茄幼苗叶片气孔限制值呈先降后增的趋势(表1)。与对照相比,低温胁迫24 h 处理下,秋茄、红榄李幼苗叶片Ls分别降低44% 和45%;低温胁迫48 h 处理下秋茄植物叶片Ls上升了120%,而红榄李植物叶片气孔限制值降低了87%。
2.2 低温胁迫对两种红树植物幼苗叶片叶绿素荧光参数的影响
由表2 可知,随着低温胁迫的时间延长,秋茄和红榄李幼苗叶片Fv/Fm、ΦPSⅡ和qP 均逐渐减少。低温胁迫下,红榄李幼苗叶片Fv/Fm、ΦPSⅡ和qP 下降幅度均大于秋茄,且随着低温胁迫时间延长,各值降低幅度更大。与对照相比,低温胁迫24 h 下,秋茄幼苗叶片Fv/Fm、ΦPSII、qP 分别降低18%、21% 以及25%,而红榄李幼苗叶片Fv/Fm、ΦPSⅡ和qP 则分别降低32%、41% 以及27%;低温胁迫48 h 处理下,秋茄幼苗叶片Fv/Fm、ΦPSⅡ、qP 分别降低39%、38% 以及44%,而红榄李幼苗叶片Fv/Fm、ΦPSⅡ、qP 分别降低达70%、77%以及51%。随着低温胁迫时间延长,秋茄幼苗叶片NPQ 呈逐渐增加的趋势,而红榄李幼苗叶片NPQ 却先增后降(表2)。与对照相比,低温胁迫24 h 和48 h 下,秋茄幼苗叶片NPQ 分别增加26%和49%,低温胁迫24 h 下红榄李幼苗叶片NPQ 为对照1.28 倍,而低温胁迫48 h 处理下叶片NPQ 为对照的36%。
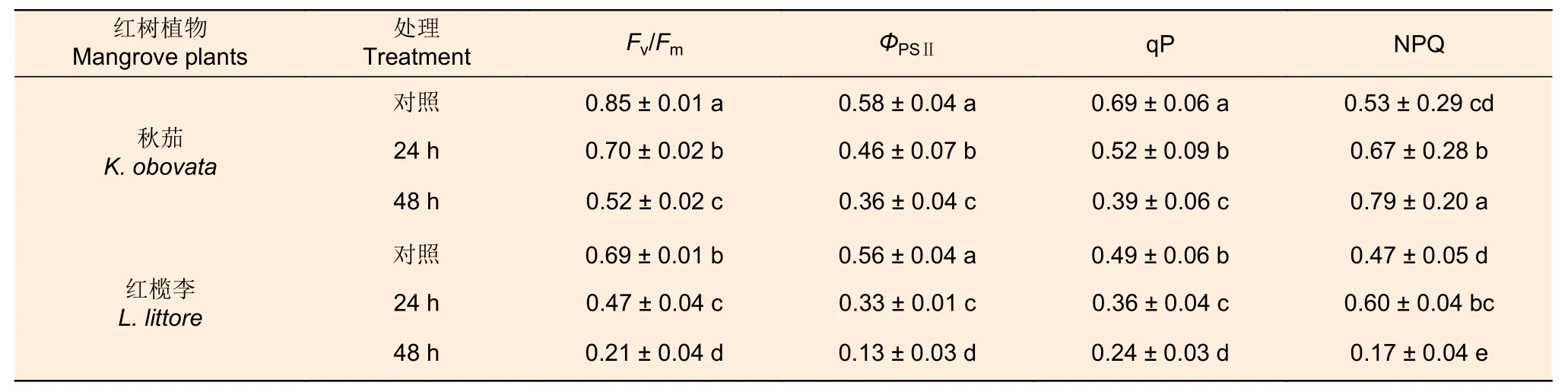
表2 低温胁迫对两种红树植物幼苗叶片叶绿素荧光参数的影响Table 2 Effects of low temperature stress on chlorophyll fluorescence parameters of leaves of two mangrove seedlings
2.3 低温胁迫对两种红树植物幼苗叶片光合色素含量的影响
由表3 可知,随低温胁迫延长秋茄和红榄李幼苗叶片叶绿素(Chl)含量、类胡萝卜素(Car)含量、Chl a/Chl b 值均逐渐减少(表3)。低温处理下两种红树植物相比,秋茄幼苗叶片Chl 含量、Car 含量、Chl a/Chl b 值以及Car/Chl 值均比红榄李的值高。
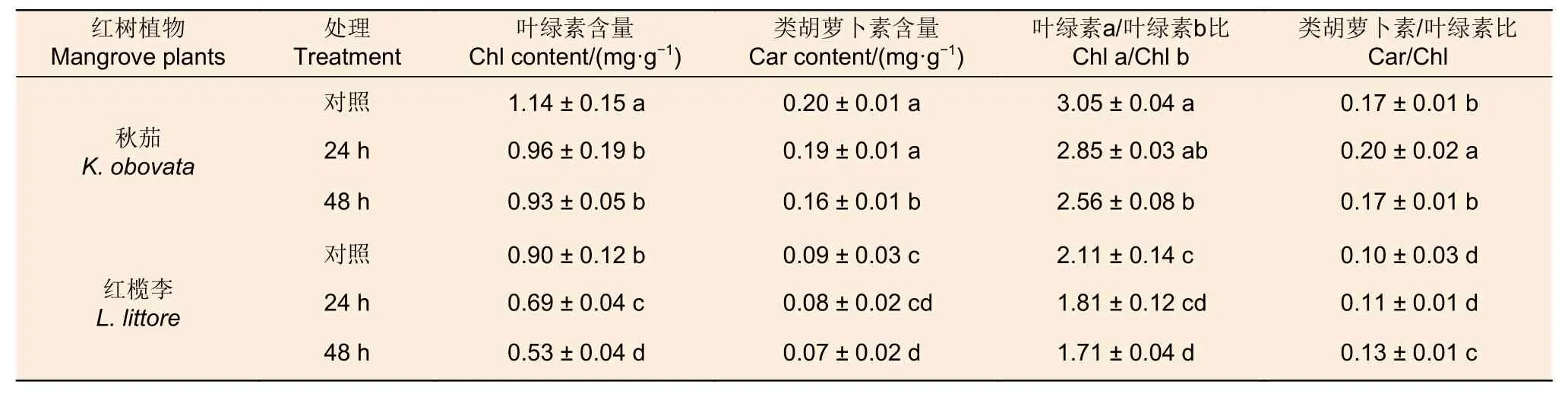
表3 低温胁迫对两种红树植物幼苗叶片光合色素的影响Table 3 Effects of low temperature stress on photosynthetic pigments in leaves of two mangrove seedlings
与对照相比,低温胁迫24 h 和48 h 处理下,秋茄幼苗叶片Chl 含量分别下降16%和18%;低温胁迫24 h 处理下,秋茄幼苗叶片叶片Car/Chl值上升18%,而低温胁迫48 h 处理下秋茄幼苗叶片Car/Chl 值无显著性差异;两个低温胁迫处理相比,秋茄幼苗叶片Chl 含量无显著差异变化,而Car/Chl 值显著下降(P<0.05)。与对照相比,低温胁迫24 h 处理下,秋茄幼苗叶片Car 含量和Chl a/Chl b 值均无显著差异变化,而低温胁迫48 h 处理下秋茄幼苗叶片Car 含量和Chl a/Chl b 值均显著下降(P<0.05)。
与对照相比,低温胁迫24 h 和48 h 处理下,红榄李幼苗叶片Chl 含量分别降低23% 和41%,Car/Chl 值分别上升10% 和30%;两个低温胁迫处理相比,低温胁迫24 h 处理下红榄李幼苗叶片Chl 含量显著高于低温胁迫48 h 处理(P<0.05),两个低温胁迫处理下红榄李幼苗叶片Car/Chl 值均上升。与对照相比,低温胁迫24 h 处理下红榄李幼苗叶片Car 含量和Chl a/Chl b 值均无显著差异变化,而低温胁迫48 h 处理下红榄李幼苗叶片Car 含量和Chl a/Chl b 值均显著下降(P<0.05)。
2.4 低温胁迫对秋茄和红榄李幼苗叶片抗氧化系统与膜脂过氧化程度的影响
秋茄和红榄李幼苗叶片SOD 活性均随低温胁迫延长逐渐降低,且红榄李幼苗下降的幅度较大(表4)。比如,与对照相比,低温胁迫24 h 和48 h 处理下,秋茄幼苗叶片SOD 活性分别降低2%和61%,而红榄李幼苗叶片SOD 活性分别降低51%和85%。不同低温处理间相比,低温胁迫24 h 处理下,秋茄叶片SOD 活性显著高于低温胁迫48 h 处理,而与对照之间无显著差异;低温胁迫24 h 处理下,红榄李幼苗叶片SOD 活性与对照和低温胁迫48 h 处理均存在显著差异(P<0.05)。
随低温胁迫时间延长,秋茄幼苗叶片POD 活性先增后降,而红榄李幼苗叶片POD 活性一直持续下降(表4)。与对照相比,低温胁迫24 h 和48 h 处理下,秋茄幼苗叶片POD 活性增加了113%和42%,而红榄李幼苗叶片POD 活性分别降低53%和94%。
随着低温胁迫延长两种红树植物叶片MDA 含量均逐渐增加,且红榄李幼苗叶片MDA 含量高于秋茄(表4)。低温胁迫24 h、48 h 处理下,秋茄幼苗叶片MDA 含量分别为对照的1.35 倍和1.63 倍,而红榄李幼苗叶片MDA 含量分别为对照1.53 倍和1.88 倍。
2.5 低温胁迫对秋茄、红榄李幼苗叶片H2O2 含量和O2-含量的影响
由表5 可知,随着低温胁迫时间延长,秋茄和榄李幼苗叶片H2O2和O2·-含量均逐渐增加。与对照相比,低温胁迫24 h 和48 h 处理下秋茄幼苗叶片H2O2、O2·-含量分别增加了20%、27%和44%、32%;低温胁迫24 h、48 h 处理下红榄李幼苗叶片H2O2和O2·-含量分别增加了31%、37%与60%、43%。
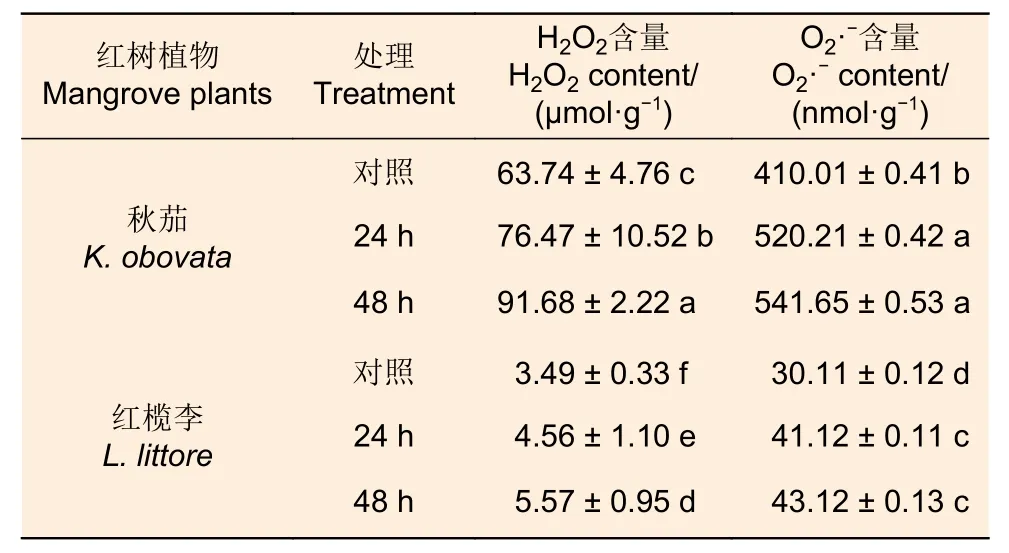
表5 低温胁迫对两种红树植物叶片过氧化氢(H2O2)含量和超氧阴离子(O2·-)的影响Table 5 Effects of low temperature stress on the contents of hydrogen peroxide (H2O2) and superoxide anion (O2·-) in leaves of two mangrove plants
2.6 低温胁迫对两种红树植物幼苗叶片叶绿体超微结构的影响
由图3 可知,对照条件下,秋茄(图3A)和红榄李(图3B)幼苗叶片叶绿体紧密分布在细胞壁周围且结构完整,呈现为饼状或者凸透镜状,基粒片层排列较为紧密有序,膜清晰可辨,可以观察到叶绿体内有淀粉粒(S)和嗜锇体(OG)。与对照相比,低温胁迫48 h 处理下秋茄(图3 a)和红榄李(图3 b)的叶绿体与对照相比,其叶绿体明显膨胀,淀粉粒肿胀变大且基粒片层间距加大,叶绿体膜较对照状态下出现不清晰或破裂等现象,其中红榄李幼苗叶片叶绿体结构受低温胁迫伤害更大,如叶绿体数目、单位基粒数和基粒片层数均减少,淀粉粒异常膨大。
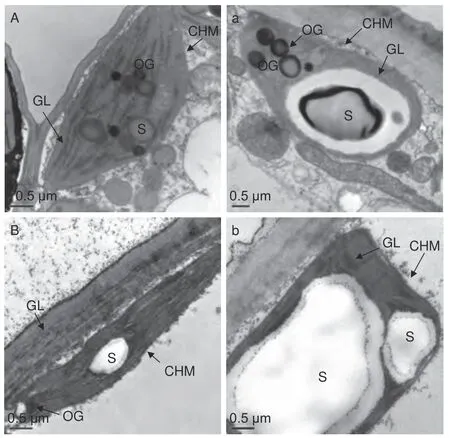
图3 低温胁迫下两种红树植物叶绿体超微结构Fig. 3 Effects of low temperature stress on the ultrastructure of chloroplasts in two mangrove plants
2.7 低温胁迫对秋茄和红榄李幼苗叶片气孔结构特征的影响
由图4 可知,低温胁迫下秋茄和红榄李幼苗叶片气孔开张度均明显小于对照。通过计算,低温胁迫下秋茄幼苗叶片气孔长、宽以及开张度均显著高于红榄李(P<0.05)。与对照相比,低温胁迫48 h 处理下秋茄、红榄李幼苗叶片气孔长、宽以及开张度长并未显著变化。同样,秋茄幼苗叶片气孔开张度宽均显著高于红榄李(P<0.05)。与对照相比,低温胁迫48 h 处理下秋茄和红榄李幼苗气孔开张度宽分别降低37%和80%,气孔面积分别上升了25%和24%。
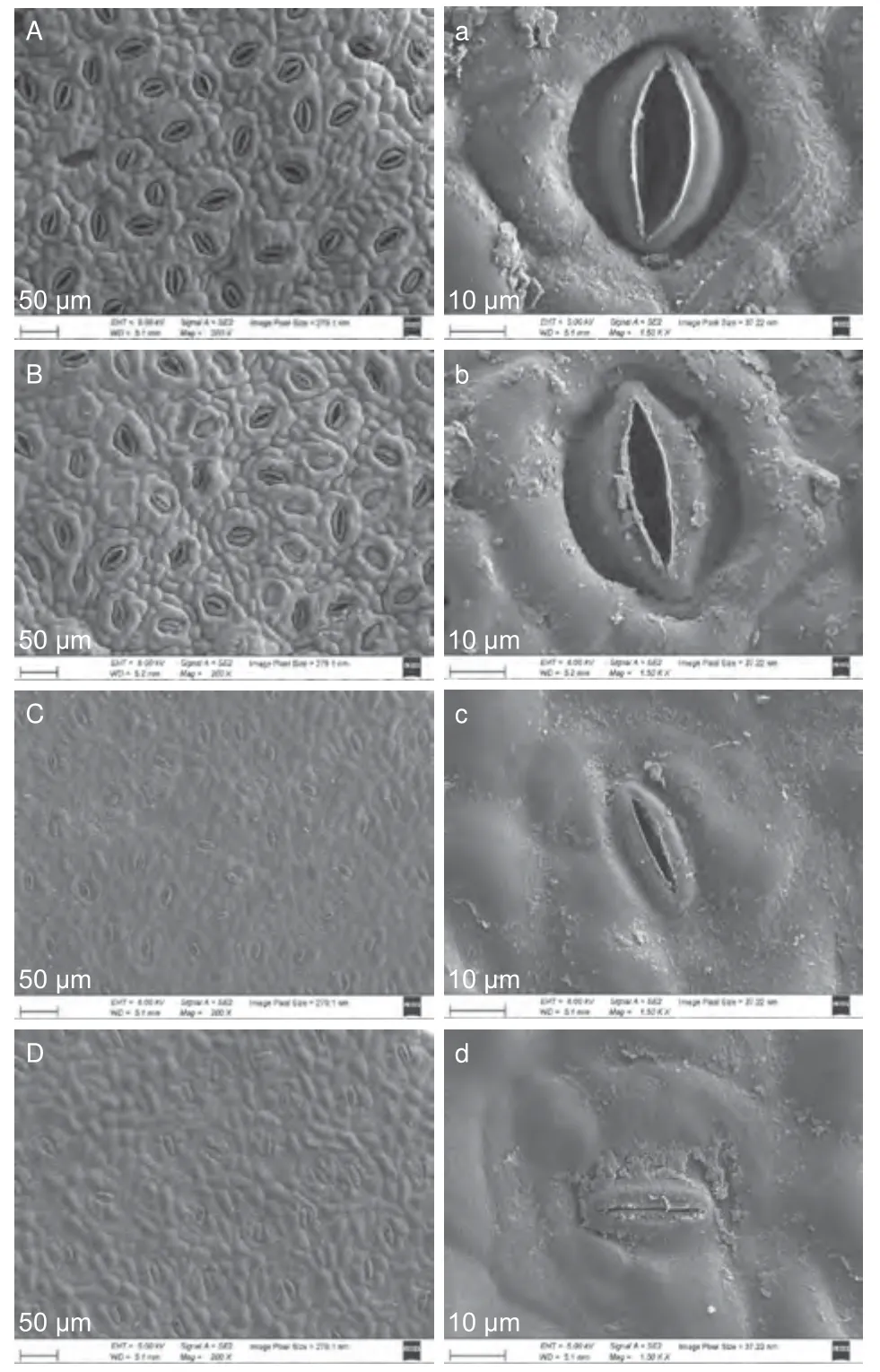
图4 低温胁迫对两种红树植物叶片气孔形态的影响Fig. 4 Effects of low temperature stress on the leaf stomata of two mangrove plants
3 讨论
光合作用是植物生长发育的物质基础,而低温胁迫下植物则通过光合作用强弱可以反映其抗寒能力[25-26]。研究认为,逆境胁迫引起的植物光合作用限制因子可分为气孔限制和非气孔限制,其中气孔限制导致的叶片光合速率下降主要表现气孔关闭引起Ci、Gs均降低,Ls升高;而非气孔限制则主要表现为Ci升高,Ls下降,这归因于逆境会破坏叶绿体结构,使光合色素合成受到抑制,电子传递受阻等[27-30]。前期研究还发现,低温胁迫会使红树植物秋茄的叶绿体超微结构发生改变,基粒溶解、基层片层断裂,膜破裂,甚至解体,最终引起叶片净光合速率降低,这也是非气孔限制的主要表现之一[25]。然而,低温如何影响红榄李幼苗叶片光合能力的研究仍未有相关报道。在本研究中,48 h 7 ℃(昼)/4 ℃(夜)处理对秋茄幼苗影响较小,其植株未有低温伤害症状,而在同样温度下红榄李幼苗却出现萎蔫现象,且叶片净光合速率值为负值,表明秋茄耐寒性远高于红榄李。本研究还发现,低温胁迫24 h 处理下秋茄幼苗叶片Pn、Gs以及Ls均降低,而Ci升高;低温胁迫48 h 处理下,秋茄幼苗叶片Pn、Gs以及Ci均降低,而Ls升高,表明低温胁迫24 h 处理下秋茄幼苗叶片Pn的下降主要受到非气孔限制的影响,这可能是秋茄对低温的应急反应。当胁迫时间延迟至48 h 时,其Pn的降低由气孔限制影响,主要表现在气孔开张度减少(图4B 和表6),与此同时,非气孔限制仍存在,如叶绿体超微结构(图3a)受到轻微伤害。与秋茄不同,低温胁迫24 h 和48 h 处理下红榄李幼苗叶片Pn、Gs以及Ls均降低,而Ci均升高,表明低温胁迫下,红榄李幼苗叶片Pn的降低主要由非气孔限制起着主要作用,表现在叶绿体超微结构受到严重破坏,如叶绿体数目、单位基粒数和基粒片层数均减少,淀粉粒异常膨大等(图3b),叶片气孔基本关闭(图4D)。综上所述,非气孔限制是影响红榄李幼苗不耐寒的一个重要因素。
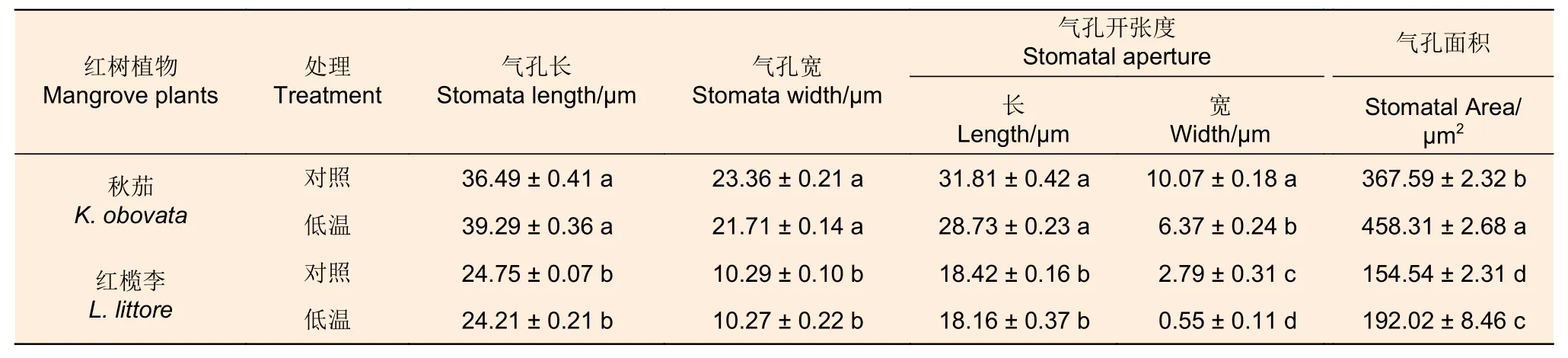
表6 低温胁迫对两种红树植物叶片气孔指标的影响Table 6 Effects of low temperature stress on leaf stomatal indexes of two mangrove plants
植物叶片的叶绿素荧光参数(Fv/Fm、ΦPSII、qP 等)可作为判定植物耐寒能力的重要指标,其中电子传递有效性和光化学效率的差异是影响植物耐寒性的主要原因[31]。研究认为,低温胁迫直接降低秋茄叶片Fv/Fm、ΦPSII和qP 等,引起PSII 反应中心出现过剩的激发能,致使叶片发生PSII 光抑制,最终导致叶片Pn下降[25]。本研究中,随着低温胁迫时间的延长,秋茄、红榄李幼苗叶片Fv/Fm、ΦPSII和qP 均下降,且低温胁迫48 h 处理下红榄李幼苗叶片各荧光参数下降幅度均高于秋茄,表明低温胁迫会使两种红树植物的PSII 反应中心发生部分失活或伤害,降低反应中心对激发能捕获能力,影响叶片净光合速率。然而,低温胁迫对红榄李的伤害更为严重,这也验证了红榄李叶片Pn下降是由于非气孔限制引起。前期研究还发现,低温胁迫提高秋茄幼苗叶片NPQ 值,表明植株通过以热耗散方式散失过多的光能,从而减轻光系统伤害[32],这与本研究结果一致。然而,红榄李幼苗仅在低温胁迫24 h 处理下,叶片NPQ 显著高于对照,而低温胁迫48 h 处理下,其值却显著下降,这表明低温胁迫时间延长后红榄李已不能通过增加热耗散来避免伤害,从而丧失了防御能力。
光合色素能够在植物光合作用中参与吸收、传递光能或引起原初光化学反应,其含量的变化可反映植物光合作用的强弱。光合色素主要包括Chl(Chl a 和Chl b)和Car,其中Chl 在光合作用的光吸收中其核心作用,而Car 不仅具有天线色素作用,而且还可以减少ROS[33]。前期研究发现,低温胁迫下Chl a/Chl b 值能反映光合能力强弱,且Chl a/Chl b 值与秋茄抗寒性有正相关[34]。研究还认为,叶绿素含量的降低主要是低温胁迫通过增加叶绿素酶活性,促进叶绿素的降解[35]。本研究中,随着低温胁迫时间的延长,秋茄和红榄李幼苗叶片叶绿素含量、Chl a/Chl b 值均呈下降的趋势,且低温胁迫24 h 和48 h 处理下,秋茄幼苗叶片叶绿素含量和Chl a/Chl b 值均无显著性差异,而红榄李幼苗叶片叶绿素含量却存在显著差异,这表明低温胁迫时间延长可能也会加快红榄李幼苗叶片叶绿素酶活性,促进叶绿素的降解,而相同低温胁迫下秋茄幼苗却未有相似现象,这可能归因于较高的Chl a/Chl b 值,即秋茄的抗寒能力高于红榄李。对两种红树叶片Car 含量变化分析,秋茄幼苗叶片Car 合成对低温胁迫时间较红榄李敏感,即在低温胁迫下秋茄幼苗叶片Car 参与清除ROS 的作用相比于红榄李较强,如低温胁迫24 h和48 h 处理下秋茄幼苗叶片Car 含量存在显著差异,而红榄李幼苗而无显著差异。Car/Chl 值与植物清除活性氧的能力有关,逆境下植物Car/Chl 值变化可与清除ROS 的抗氧化酶活性一致[36]。低温胁迫24h 处理下,秋茄幼苗叶片Car/Chl 值显著增加,而随着低温胁迫时间延长,其值却下降。这主要是因为秋茄幼苗受到轻微低温胁迫时,植株出现应急反应,迅速提升Car/Chl值,进而减轻ROS对细胞的伤害;之后随着低温胁迫时间延长,这种自我保护作用减弱。与秋茄不同,随着低温时间延长红榄李幼苗叶片Car/Chl 值一直持续增加,这可能与低温胁迫下红榄李幼苗叶片ROS 大量积累有关。
低温胁迫会使不耐寒红树植物体内大量ROS累积,引起细胞膜脂过氧化,破坏膜结构,而耐寒红树植物却在低温胁迫下植株呈现较轻的伤害程度,这与清除ROS 的抗氧化酶活性和Car 含量有关[12]。研究认为,当植物抵抗低温胁迫时,其首先启动SOD,将O2·-转化为H2O2和O2,POD和CAT 则进一步将H2O2分解为H2O 和O2,从而减轻活性氧对膜系统的伤害,增强植株的抗寒性[37]。本研究中,一方面,随着低温胁迫时间延长秋茄、红榄李幼苗叶片SOD 活性均降低,致使清除O2·-能力降低,使其含量增加。另一方面,在两种红树植物体内SOD 催化O2·-歧化为H2O2和O2后,POD 对清除H2O2将起着重要作用;相同低温胁迫下秋茄幼苗叶片POD 活性显著增加,而红榄李幼苗叶片POD 活性显著降低。此外,秋茄幼苗叶片MDA 含量增加幅度小于红榄李。说明POD 在低温胁迫下两种红树植物抗氧化清除酶系统中起着主要作用[16],其中低温胁迫会抑制红榄李幼苗叶片抗氧化酶活性,提高了H2O2含量,增加了膜脂过氧化产物MDA 积累,从而加剧膜的损伤;相反,秋茄却有较强的防御机制,这也是其耐寒性高于红榄李的原因之一。
4 结论
随着低温胁迫时间延长秋茄和红榄李幼苗叶光合能力均逐渐降低,但红榄李光合作用降低的幅度更大,尤其是在低温胁迫48 h 处理下,表明秋茄耐寒性较红榄李高。这可能是因为:低温胁迫48 h 处理下,红榄李幼苗叶片光合色素下降,叶绿体超微结构受到破坏,气孔开张度减少,光合电子传递效率降低,PSII 反应中心受到伤害,ROS增加,膜系统受损,致使光合能力下降,而秋茄受到的低温伤害较红榄李轻。研究结果不仅丰富了我国红树林抗寒研究内容,而且也为高纬度红树林引种提供了重要参考依据。

