文冠果种子高表达XsKCS7 基因的克隆和酵母表达功能鉴定
梁重钧,李麟坤,胡振华,张 薇,许慧慧,王利兵*
(1. 海南大学 林学院,海南 海口 570228;2. 中国林业科学研究院林业研究所,北京 100091;3. 开鲁县林业和草原局,内蒙古 通辽, 028400)
我国是世界油料主产国和最大进口国,粮油安全与国家安全息息相关。根据中华人民共和国国家统计局(http://www.stats.gov.cn/)数据显示,2022年我国油菜籽、芝麻、大豆、花生等油料总产量约3 653 万吨,而进口食用油籽达到9 610 万吨,另外进口食用油648 万吨。我国食用油对外依存度已达到70%,超过了国际安全警戒线[1]。因此,开发和利用木本油料,提高我国食用油产量和质量,对满足我国社会需求和降低食用油对外依存具有十分重要的现实意义。我国油料树种资源十分丰富,适用于食用的含油量40%以上的油料树种约150 多种,但目前开发利用程度较深的只有油茶(Camellia oleiferaAbel.)、核桃(Juglans regiaL.)、油橄榄(Olea europaeaL.)等10 余种。由此可见,有大量的木本油料资源有待发掘及进一步开发利用。
文冠果(Xanthoceras sorbifoliumBunge)又名黄角(Yellowhorn),为无患子科(Sapindaceae)文冠果属木本油料,是《关于加快木本油料产业发展的意见》中明确提出的10 个木本油料树种之一。文冠果种子油脂含量丰富,含油率达60%以上,其中不饱和脂肪酸含量高达92%,富含在植物中极为罕见的神经酸(3%~7%)[2-4]。神经酸(Nervonic acid,C24∶1Δ15,cis-tetracos-15-enoic acid),一种超长链单不饱和脂肪酸,是大脑白质神经组织的主要组成部分,具有修复大脑受损神经纤维的独特生理功效[5-6],1925 年在人类和哺乳动物大脑中首次发现,次年从鲨鱼脑中提取,并确定了神经酸的结构,又名鲨鱼酸[7-8]。人体难以合成神经酸,远未达到人体健康推荐摄取量300 mg·(60 kg)-1[9],必须从食物中摄取,鲨鱼脑中富含神经酸,所提取的神经酸纯度高达98%,市场价格约120 万元·kg-1,价格昂贵,国际社会也已禁止捕杀鲨鱼;而神经酸人工合成效率低,副产物多,同样无法满足人类的需求。由此可知,油料种子神经酸已成为获取神经酸的主要途径[10]。目前,元宝枫和文冠果已生产出对应的食用油,应用于食品行业。文冠果具有抗逆性强、易存活、含油率高、童期短等特点,更易批量种植和规模化生产神经酸。
随着高通量测序技术的发展,神经酸的生物合成通路已有报道[4,11-12]。脂肪酸在细胞质体中以乙酰辅酶A 为原料,合成终产物油酸(Oleic acid,C18∶1Δ9,cis-9-octadecenoic acid);转运蛋白长链酰基辅酶A 合成酶(LACS)将游离脂肪酸C18∶1 以C18∶1-CoA 的形式转运至内质网;C18∶1-CoA 在脂肪酸延伸酶复合体的作用下经过3 个重复延伸反应依次生成辅酶A 形式的花生烯酸(cis-11-Eicosenoicacid,C20∶1Δ11)、芥酸(Erucic acid,C22∶1,cis-13-docosaenoic acid)和神经酸(C24∶1);最后以三酰甘油的形式储存在植物种子和果实中。脂肪酸延伸酶复合体由4 个组分构成,包括3-酮酯酰-CoA合酶(3-ketoacyl-CoA synthase,KCS)、3-酮酯酰-CoA还原酶(3-ketoacyl-CoA reductase,KCR)、3-羟酯酰-CoA 脱水酶(3-hydroxyacyl-CoA dehydrase,HCD) 和羟酯酰-CoA 还原酶(enoyl-CoA reductase,ECR)。其中KCS 为单体酶,具有底物特异性,是C18 以上超长链脂肪酸延长的限速酶;KCR、HCD 和ECR 为寡聚酶,是所有脂肪酸延长反应共有[13]。根据文冠果基因组KCS基因在染色体的位置分布[14],本研究将KCS基因编号为XsKCS1~XsKCS20以便于描述。文冠果参考基因组和种子发育不同时期转录组测序数据联合分析,发现XsKCS7基因在种子中的表达量较其他KCS基因最高,可能调控种子油超长链脂肪酸的合成,然而其具体的功能尚未解析[15]。本研究在此基础上,克隆文冠果XsKCS7基因,并进行生物信息学分析和生物酵母转化功能鉴定。本研究初步鉴定了XsKCS7基因功能,为探索文冠果种子神经酸的合成通路提供分子依据。
1 材料与方法
1.1 实验材料
文冠果(Xanthoceras sorbifoliumBunge)特色抗旱栽培良种‘中石4 号’(国S-SV-XS-015-2020)五年以上稳产实生苗生长于辽宁省阜新市彰武县(42°37′ N, 122°53′ E),种植区域年平均降水量为504 mm,年平均温度为7 °C,最低温度为-36 °C,最高温度为38 °C(数据来源于全国天气网),林间正常管理。用于本研究基因克隆所需的文冠果发育中期种子样品采集于2022 年6 月,种子样品经纯净水冲洗后擦干,液氮速冻后保存于-80 °C 待用。用于酵母表达实验的生物酵母采用酿酒酵母菌株INVSc1。
1.2 实验方法
1.2.1 文冠果KCS家族基因表达分析 下载Wang 等公开的文冠果种子不同发育时期种子(开花后第40、54、68、81 d)转录组原始数据(SRA 编号:PRJNA493982),以本研究室文冠果基因组数据为参考基因组进行联合分析[16],基因的表达水平根据FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)进行计算。
1.2.2 RNA 提取和cDNA 链合成 文冠果发育中期种子样品RNA 的提取方法参照多糖多酚植物总RNA 提取试剂盒(天根,中国)说明书,经过降解酶RQ1 RNase-Free Dnase(Promega ,美国)降解残留的基因组DNA 后,以1 μg RNA 为模板,利用GoScriptTM Reverse Transcription System(Promega,美国)试剂盒反转录得到cDNA。
1.2.3 基因克隆和生物信息学分析 依据文冠果基因组XsKCS7基因参考序列,设计上游(5′-CTCTTCTTGTTTAGCTACCCTTT -3′)和下游(5′- ATCCTTTTTATTCCATTCTCTTT -3′)特异性引物;以采集的文冠果发育中期种子cDNA 为模板,利用kod 高保真扩增酶(Toyobo,日本)扩增,经测序验证无突变的XsKCS7连接至克隆载体pGEM®-T Easy 载体系统构建(Promega,美国)并转化至大肠杆菌DH5α;再次测序验证序列后,将阳性菌液保存于-80 °C。
多重序列比对通过软件DNAMAN 7.0 中的clustal X 程序进行;系统性进化树分析由软件MEGA5.0 中的neighbor-joining 程序进行。
1.2.4 生物酵母转化与表达 限制性内切酶HindⅢ 酶切酵母表达载体pYES2.0,设计带有同源臂的上游引物(5′-taagcttggtaccgagctcgATGGCT AATGAGAACAAAAA -3′)和下游引物序列(5′-gcggccgttactagtggatcTTAAATAACAATCGATGC AA -3′)扩增XsKCS7,以同源重组法构建酵母表达载体pYES2.0-ProGAL1::XsKCS7,操作方法参照试剂盒SeamLess Assembly Cloning Kit(中美泰合,中国);酿酒酵母(Saccharomyces cerevisiae)INVSc1(Invitrogen, USA)菌株的转化采用聚乙二醇/醋酸锂(PEG/LiAc)诱导法[17]。
转基因酵母在SD-U 液体培养基中震荡至吸光值A600至0.4~0.5 后,加入总溶液1/10 体积的20%半乳糖水溶液(m/v)激活酵母载体启动子GAL1表达XsKCS7,同时分别加入底物0.5 mmol·L-1花生烯酸C20∶1 芥酸C22∶1 以及不加底物(酵母提取物自身含有油酸C18∶1),20 °C培养4 d;培养物于3 500 g 离心10 min,收集酵母菌体,以真空冷冻干燥机在-40 °C 环境下干燥12 h 成粉末状,-80 °C 保存用于脂肪酸含量和组分测定。
1.2.5 脂肪酸测定 酵母提取物脂肪酸提取采用硫酸甲醇酯化法[18],提取的脂肪酸甲酯由乙酸乙酯溶解。吸取1.0 μL 乙酸乙酯用于GC 检测,检测仪器使用气相色谱仪,柱子使用强极性气相色谱柱DB-23。GC 检测设置条件为:170 ℃,5 min;2 ℃·min-1到210 ℃;柱箱210 ℃;压力163.8 kpa;总流量48.3 mL·min-1;柱流量4.2 mL·min-1;分流比10.0。
2 结果与分析
2.1 文冠果KCS 家族基因表达分析
SapBase 数据库(http://www.sapindaceae.com/)公开了由本研究室测序获得的文冠果基因组数据,共注释KCS基因20 个[14,16],根据这些基因在染色体的位置分布,编号为XsKCS1~XsKCS20(图1)。基于参考基因组和转录组测序数据,分析得到文冠果KCS基因家族在高油文冠果种子不同发育时期的表达模式。结果如图2 所示,XsKCS5、XsKCS6、XsKCS19及XsKCS20在文冠果种子各个发育时期的表达量均为0,不参与基因表达热图绘制;XsKCS7基因在种子中的表达量远高于其他KCS基因,表明XsKCS7基因可能调控文冠果种子油超长链脂肪酸的合成功能。

图1 KCS 基因在文冠果染色体中的位置Fig. 1 The position of KCS genes in the chromosome of Xanthoceras sorbifolium
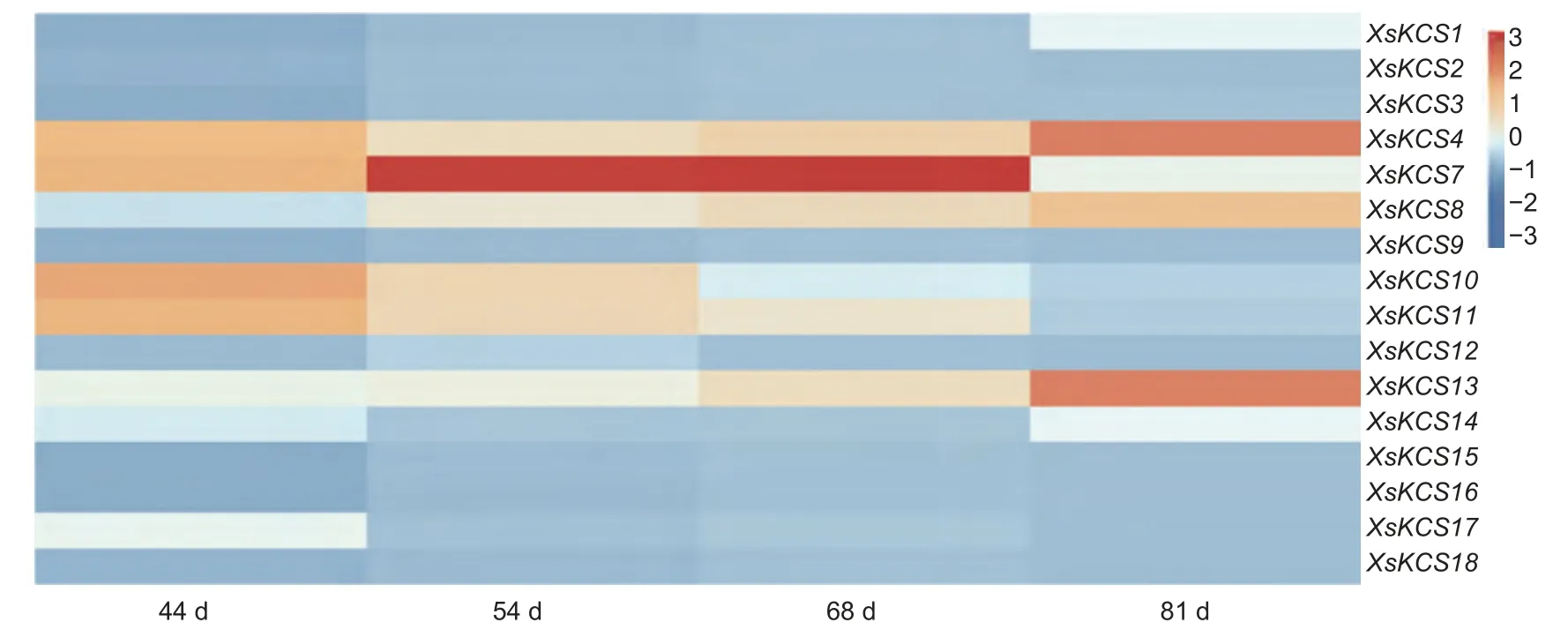
图2 XsKCS 基因在文冠果不同发育时期种子中的表达量Fig. 2 Expression of XsKCS genes in seeds of Xanthoceras sorbifolium at different developmental stages
2.2 XsKCS7 基因的克隆
将采集的文冠果发育中期种子用液氮研磨后,使用RNA 提取试剂盒抽提种子RNA,经电泳检测发现RNA 具有清晰的28S 和18S 条带(图3A),同时Agilent 2100 Bioanalyzer 分析仪检测RIN(RNA integrity number)值大于7.0,表明RNA完整性较好;分光光度计测量其OD260/OD280值在1.95~2.05 之间,表明RNA 纯度高。
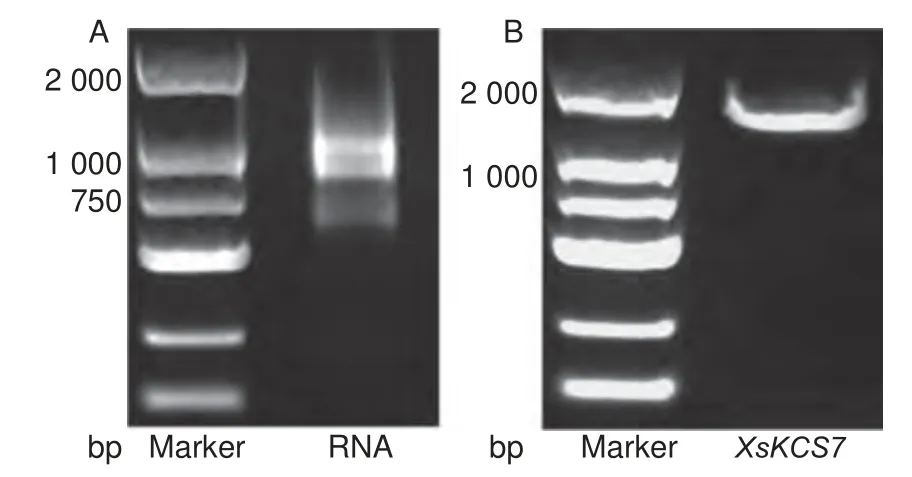
图3 RNA 电泳图(A);XsKCS7 基因扩增电泳图(B)Fig. 3 Electrophoresis of RNA(A) and electrophoresis of the amplification of XsKCS7 gene(B)
以种子cDNA 为模板,依据文冠果基因组XsKCS7基因参考序列设计的特异性引物扩增,连接至克隆载体后使用通用引物T7/SP6 扩增并测序,最终获得包括XsKCS7基因CDS 区的1 512 bp 序列,扩增产物长度包括克隆载体骨架共1 681 bp(图3B)。
2.3 XsKCS7 蛋白序列分析
通过软件DNAMAN5.0 将文冠果XsKCS7 蛋白、梣叶槭(Acer negundoL.)AnKCS(NCBI注册号:KAI9194759.1;下同)、橡胶[Hevea brasiliensis(Willd. ex A. Juss.) Müll. Arg.]HbKCS11(XP_021653194.1)、石榴(Punica granatumL. )PgKCS11 (XP_031382877.1 )、木薯(Manihot esculentaCrantz )MeKCS20(XP_021595702.1 ) 和白时钟花(Turnera subulataSmith)TsKCS11(KAJ4840348.1)蛋白进行多重序列比对。结果如图4 所示,文冠果XsKCS7 蛋白与其他植物KCS 基因具有相似的保守基序(红框标出)。

图4 KCS 蛋白多重序列比对Fig. 4 Multiple sequence alignment of KCS protein
采用软件MEGA5.0 neighbor-joining 程序将XsKCS7 蛋白与其他物种KCS 蛋白进行系统性分析,参与构建系统进化树的物种包括:蓖麻(Ricinus communisL. )RcKCS6 (XP_0025 10886.3)、大豆[Glycine max(L.) Merr.]GmKCS5(XP_003555356.2)、甘蓝型油菜(Brassica napusL.)BnKCS6(LOC106410639)、花生(Arachis hypogaeaLinn.)AhKCS5(XP_02562 0215.1)、苦楝(Melia azedarachL.)MaKCS(KAJ4706144.1)、簸箕柳(Salix suchowensisW. C. Cheng in S. Y. Jin)SsKCS(KAG523 0593.1) 、 山 核 桃[Carya illinoinensis(Wangenh.) K. Koch]CiKCS5(XM_043119331.1)、蒜头果(Malania oleiferaChun & S. K. Lee)MoKCS(MK210592.1)、拟南芥(Arabidopsis thaliana)AtKCS10(NP_180193.1)、桃[Prunus persica(L.) Batsch]PpKCS5(XP_020411733.1)、梣叶槭AnKCS(KAI9162263.1)、漾濞槭(Acer yangbienseY. S. Chen & Q. E. Yang)AyKCS(TXG70798.1)、蔷薇(Rosa chinensisJacq.)RsKCS6(XP_024164718.1 )、 巴西橡胶树HbKCS11(XM_021797502.1)、阿月浑子(Pistacia veraL.)PvKCS20(XM_031416789.1)。结果如图5 所示,XsKCS7 蛋白与其他物种KCS 蛋白亲缘性关系较近,其中与橡胶树亲缘关系最近,为67.62%。

图5 KCS 蛋白系统性进化树分析Fig. 5 Phylogenetic tree analysis of KCS protein
2.4 转基因酵母鉴定XsKCS7 基因功能
将重组质粒pYES2.0-ProGAL1::XsKCS7(简写为pYES2.0-XsKCS7)和对照空载体pYES2.0转化酿酒酵母菌株INVSc1。酿酒酵母本身不具有超长链延长酶活性,pYES2.0 对照组中未检测到花生烯酸(C20∶1)、芥酸(C22∶1)以及神经酸(C24∶1)。与pYES2.0 对照组相比,pYES2.0-XsKCS7 转基因酵母提取物未检测到其他脂肪酸(图6A1、B1);与pYES2.0 + C20∶1 对照组相比,pYES2.0-XsKCS7 转基因酵母提取物中检测到了芥酸和微量的神经酸(图6A2、B2);与pYES2.0 + C22∶1 对照组相比,pYES2.0-XsKCS7转基因酵母提取物中检测到神经酸(图6A3、B3)。上述结果表明XsKCS7基因具有催化花生烯酸生成芥酸和催化芥酸生成神经酸的功能,但不具备油酸生成花生烯酸的功能。
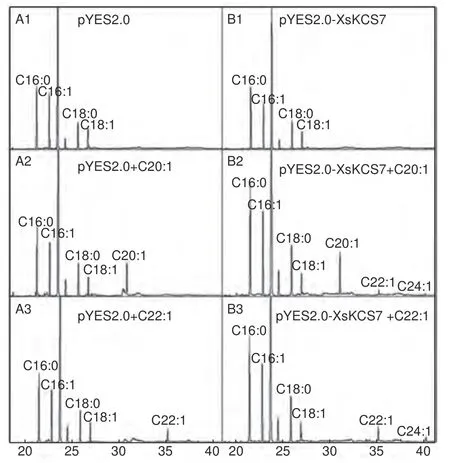
图6 酵母细胞提取物脂肪酸甲酯GC-MS 峰图Fig. 6 GC-MS analysis for FA components in yeast cells
3 讨论
文冠果是一种罕见的种子中富含神经酸的经济油料树种,而神经酸具有潜在的药用保健效用[5],是近年来国内外研究的热点。3-酮酯酰-CoA 合酶基因(KCS)是调控超长链脂肪酸合成的限速酶基因,已在蒜头果[19]、银扇草(Lunaria annuaL.)[20]、碎米荠(Cardamine graecaL.)[21]等物种中克隆并鉴定其具有调控神经酸合成的功能,然而在文冠果中尚未解析。
本研究以文冠果基因组为参考基因组,重新分析文冠果种子不同发育时期转录组测序数据,发现XsKCS7基因在种子的表达量明显高于其他KCS基因。通过PCR 法扩增得到XsKCS7基因序列,编码503 个氨基酸;生物信息学分析发现,XsKCS7蛋白序列与其他物种KCS 蛋白序列均具有KCS 家族保守基序“GMGCSA”、“FGNTSSSS”以及“GSGFKCNSAVW”[22];系统进化树分析结果表明XsKCS7 与其他物种KCS 蛋白亲缘性关系较近,与橡胶树最近(图5)。以上结果表明克隆的XsKCS7基因具有潜在的3-酮酯酰-CoA 合酶功能,然而其具体的功能还需进一步研究。
真核酿酒酵母表达是适合研究具有单一催化功能蛋白的异源表达系统,该系统已被许多研究用于鉴定KCS 酶的功能。例如,在酿酒酵母菌株INVSc1 中异源表达毛果杨(Populus trichocarpaL.)PtKCS1和PtKCS2,发现PtKCS1底物偏好为单不饱和脂肪酸,而PtKCS2偏好为多不饱和脂肪酸[23];银扇草和碎米荠KCS也通过酵母表达系统鉴定其具有以花生烯酸(C20∶1)为底物,生成神经酸的功能[20-21]。本研究同样使用酿酒酵母菌株INVSc1 表达系统,分别以油酸(C18∶1)、花生烯酸、芥酸(C22∶1)为底物异源表达文冠果XsKCS7基因,发现XsKCS7基因具有调控花生烯酸生成芥酸和催化芥酸生成神经酸的功能。以上结果表明不同物种KCS基因具有明显的底物特异性调控功能,而至今为止已被功能鉴定的KCS基因较少,应用生物信息学预测其功能的准确性较差,由此可见,单一KCS基因的功能研究极为必要。本研究通过酵母异源表达系统鉴定XsKCS7基因具有调控芥酸和神经酸的合成的功能,同时前期研究表明XsKCS7基因在文冠果种子发育期高表达,由此可见,XsKCS7基因是调控文冠果种子油超长链脂肪酸芥酸和神经酸合成的关键基因,为解析文冠果神经酸合成通路提供了扎实基础。
4 结论
依据KCS基因在文冠果基因组染色体中的位置分布将20 个KCS基因编号为XsKCS1~XsKCS20。以本研究室测序得到的文冠果基因组为参考基因组,重新分析文冠果种子不同发育时期转录组数据(SRA 编号:PRJNA493982),发现XsKCS7基因在种子中的表达量远高于其他KCS基因。本研究克隆了文冠果XsKCS7基因,生物信息学分析其具有潜在的3-酮酯酰-CoA 合酶功能,在酿酒酵母异源表达XsKCS7基因鉴定其具有调控芥酸和神经酸的合成功能。综上所述,XsKCS7基因是调控文冠果种子芥酸和神经酸合成的关键基因。

