牡丹花青素苷合成关键基因PsDFR启动子活性分析
周 琳,袁 梦,齐 宇,2,张梦杰,王 雁*
(1. 中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,北京 100091;2. 山东省农业科学研究院,山东 济南 250100)
花色是观赏植物重要的园艺性状,也是吸引传粉者的主要因素[1-3]。花青素苷对植物呈色起重要作用[4]。在其生物合成途径中,二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)是下游阶段的关键酶,可催化二氢黄酮醇还原为无色花青素苷元,进而转变成橙色到砖红色的天竺葵素糖苷、红色的矢车菊素糖苷和蓝色到紫色的飞燕草素糖苷,与花色的产生直接相关[4]。目前,DFR基因的克隆及其功能分析已在亚洲百合(LiliumAsiatic hybrids)[5]、 玫 瑰 (Rosa rugosaThunb.)[6]、牵牛花(Ipomoea nil(L.) Roth.)[7]、一品红(Euphorbia pulcherrimaWilld. ex Klotzsch)[8]、马樱杜鹃(Rhododendron delavayiFranch.)[9]和橙花龙胆(Gentiana luteaL. var.aurantiaca(M. Laínz) M. Laínz)[10]等多种观赏植物中得到研究。
对不同植物的研究发现,DFR在转录水平上的调控机制十分复杂,受光照、温度、激素等一系列外部环境和内部因子的影响。孟祥春等[11]研究发现经过短暂光照处理的非洲菊(GerberahybridaHort.)花青素苷含量及DFR基因表达量均显著增加,且基因表达水平与光照时间呈正相关。在芜菁(Brassica rapaL.)中,与花青素苷积累相关的BrDFR对冷胁迫表现出明显响应[12]。紫花苜蓿(Medicago sativaL.)[13]、欧洲油菜(Brassica napusL.)[14]和金鱼草(Antirrhinum majusL.)[15]中的DFR基因可分别响应干旱、盐和植物激素等非生物胁迫,转录水平发生明显变化。
牡丹(Paeonia suffruticosaAndr.)是我国的传统名花,具有极高的观赏价值和经济价值。研究表明,PsDFR在牡丹花色形成中起重要作用[16-18],不仅作为转录因子PsbHLH1 的靶基因参与调控花青素苷的生物合成,还可能与转运蛋白PsGSTF3互作,与花青素苷的转运和积累相关[19-20]。启动子是位于结构基因上游的一段DNA 序列,包含控制基因表达的多种调控元件,能够特异性结合RNA 聚合酶,在基因表达调控中起核心作用[21]。开展启动子研究对于理解基因的时空表达模式[22]、环境响应机制[23]等具有重要意义。
本研究利用染色体步移法从牡丹花瓣中克隆了PsDFR的启动子序列,对其顺式作用元件进行了分析,探究了不同长度缺失启动子的活性及其对ABA、MeJA、光照等不同胁迫处理的响应,并初步确定了相关调控区域,为进一步研究PsDFR启动子的功能及其在牡丹花色形成中的转录调控机制提供参考。
1 材料与方法
1.1 试验材料
以‘黑花魁’牡丹(P.Suffruticosa‘Hei Hua Kui’)盛花期花瓣为试材。于4 月中下旬,取自中国林业科学研究院玉泉山牡丹资源圃,用锡箔纸包好,经液氮速冻后,保存于-80 ℃超低温冰箱。大肠杆菌(Escherichia coli)DH5α、农杆菌(Agrobacterium tumefaciens)GV3101 购自北京天根生化科技有限公司。烟草(Nicotiana benthamiana)野生型为本实验室保存,在 23 ℃、16 h/8 h 光暗周期下生长。
1.2 PsDFR 启动子的克隆和顺式作用元件分析
参照北京天根生化科技有限公司Plant Genomic DNA Kit 说明书提取‘黑花魁’花瓣基因组DNA。根据课题组已克隆的PsDFR基因cDNA 序列(Accession No:HQ283448)及前期获得的牡丹花瓣转录组数据库( Accession No:PRJNA594258), 利用生物学软件Primer Premier 5.0 设计特异引物PsDFR-F/PsDFRR(表1),用于PsDFR基因的gDNA 全长序列扩增。根据测序得到的DNA 序列,在启动子下游不同位置设计3 条特异性嵌套反向引物SP1、SP2、SP3(表1),以花瓣基因组DNA 为模板,按照TaKaRa 公司的Genome Walking Kit 说明书,连续开展3 轮PCR 扩增。PCR 产物经1%琼脂糖凝胶电泳检测后,切胶回收清晰条带,连接到pMD-19T 载体上并转化大肠杆菌DH5α 感受态细胞,挑取转化平板上的白色菌落进行培养,通过菌液PCR 和质粒酶切鉴定阳性克隆后,委托生工生物公司(上海)测序。
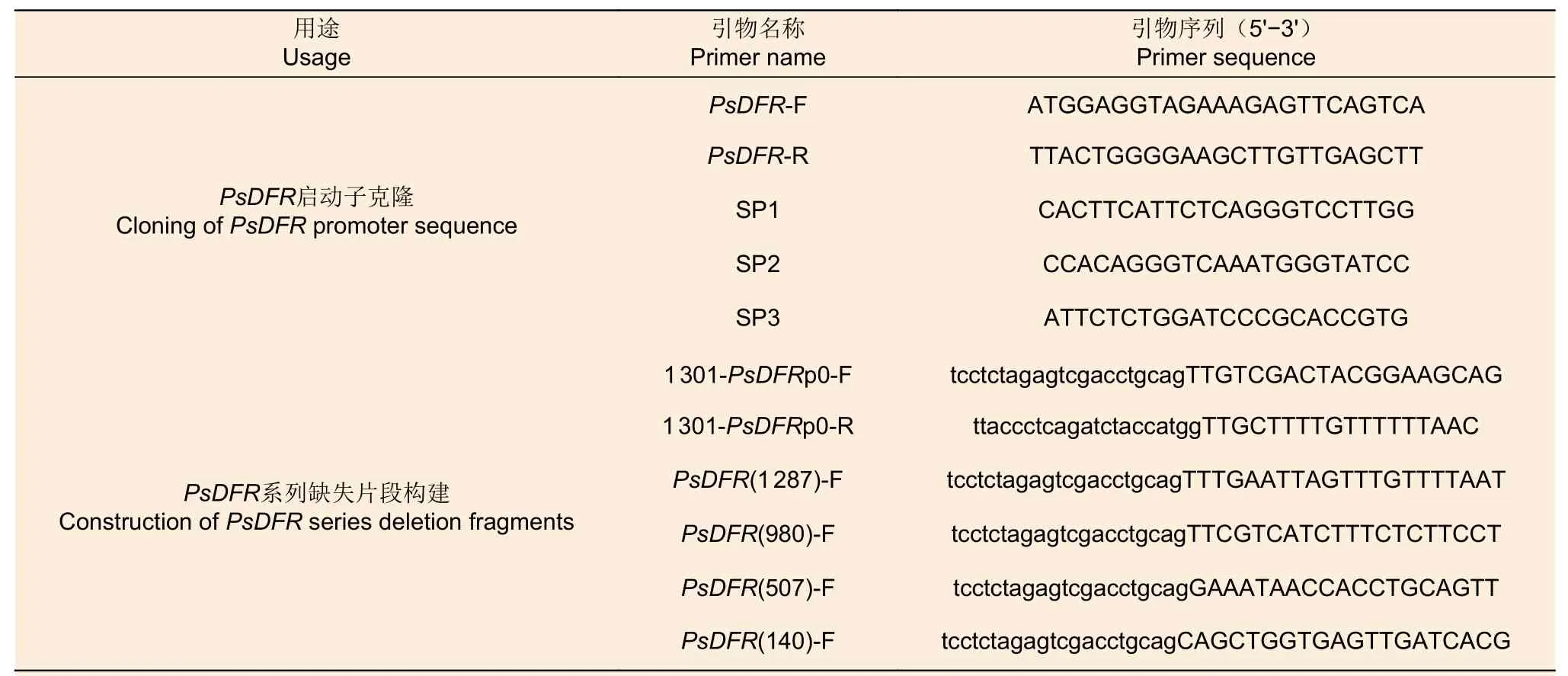
表1 PsDFR 启动子克隆和活性分析相关引物 Table 1 The primers used in cloning and functional analysis of PsDFR promoters
利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(https://www.dna.affrc.go.jp/PLACE/?acti on=newplace)分析启动子序列所包含的调控元件,并用TBtools 软件绘制各顺式作用元件分布图;通过TSSP 在线网站(http://linux1.softberry.com/berry.phtml?topic=tssp&group=programs&subgro up=promoter)预测转录起始位点。
1.3 不同缺失表达载体的构建
根据PsDFR启动子的全长序列,设计了5′端分别含有相应侧翼序列和酶切位点的扩增引物1301-PsDFRp0-F 和1301-PsDFRp0-R(表1),以包含全长启动子序列的质粒为模板,通过同源重组方法将PsDFR启动子构建至pCAMBIA1301-GUS 表达载体上。根据PsDFR启动子顺式作用元件的分布情况,设计了4 条启动子系列缺失引物,分别命名为PsDFR(1287)-F、PsDFR(980)-F、PsDFR(507)-F 和PsDFR(140)-F(表1)。以上述构建好的PsDFR全长启动子重组质粒为模板,以1301-PsDFRp0-R 为共用反向引物,通过同源重组方法,构建了不同长度启动子片段的pCAMBIA1301-GUS 融合表达载体。最后,对含有 5 个不同长度启动子片段,即1 687 bp (-1 623至 + 64)、1 287 bp (-1 223 至 + 64)、980 bp(-916 至 + 64)、507 bp(-443 至 + 64 )和140 bp(-76 至 + 64)的重组质粒进行菌液PCR 和测序验证后,用于启动子瞬时表达分析。
1.4 重组质粒农杆菌菌液转化烟草的瞬时表达分析
将构建好的5 个不同长度启动子融合表达载体的质粒分别转化到农杆菌GV3101 中。菌液PCR 验证后,取2 mL 接种于50 mL LB 液体培养基(含50 mg·L-1Rif 、50 mg·L-1Kan 和25 mg·L-1Gen)中过夜培养至OD600=1.0 左右。离心收集菌体,用悬浮液(含10 mmol·L-1MgCl2、10 mmol·L-1MES 和100 μmol·L-1AS)重悬至OD600约等于0.6,室温避光静置3 h 以上后,取2 mL 分别注射到4~5 叶期的烟草叶片中。72 h后取侵染后的叶片放入GUS 染色液进行组织化学染色。70% 乙醇浸泡脱色后拍照记录。以注射pCAMBIA1301-35S-GUS 空载体的叶片为阳性对照,注射无菌水的叶片为阴性对照。
1.5 不同处理下PsDFR 启动子的GUS 活性分析
为分析PsDFR启动子对不同激素的响应,取不同菌液注射2 d 后的烟草植株,对其叶片正反面分别喷洒外源茉莉酸甲酯(MeJA,100 μmol·L-1)和脱落酸(ABA,100 μmol·L-1)直到叶面呈滴水状态,其中MeJA 喷洒后进行套袋密闭处理。以喷洒清水的烟草叶片为对照,每组设置5 个重复,处理24 h 后取样(每12 h 追加喷洒一次)。同时,为了解启动子对光照诱导的响应,对侵染2 d 后的烟草植株分别进行暗培养24 h 后取样,以及暗培养24 h 后恢复全光照培养12 h 后再取样两种处理。每组设置5 个重复。所有样品经液氮速冻后,置于-80 ℃冰箱保存。参照阴霞等[24]的方法,利用荧光分光光度计检测GUS 酶活。
运用SPSS19.0 的Duncan’s 新复极差法进行显著性分析。
2 结果与分析
2.1 PsDFR 启动子克隆及顺式作用元件分析
以牡丹基因组DNA 作为模板,利用染色体步移法进行3 次巢式PCR 后,扩增到1 条长为1 687 bp 的目的片段(图1)。生物信息学预测结果显示,PsDFR启动子含有多个CAAT-box,转录起始位点位于翻译起始密码子ATG 上游63 bp处。转录起始位点上游16 bp 处有一个TATAbox 结构(图2)。
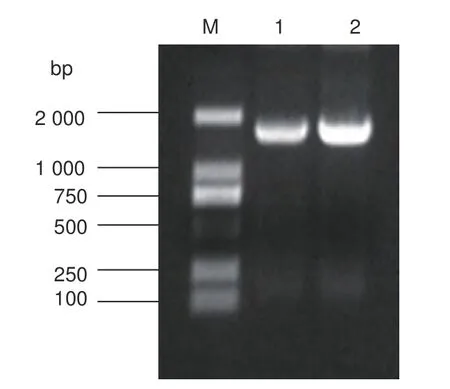
图1 牡丹PsDFR 启动子的 PCR 扩增Fig. 1 PCR production of PsDFR promoter from tree peony

图2 PsDFR 基因启动子序列Fig. 2 The sequence of the PsDFR promoter
如表2、图3 所示,PsDFR启动子除含有核心启动子元件TATA-box 和CAAT-box 外,还包含参与大多数植物启动子转录起始过程的Inr 元件INRNTPSADB 和大量光调控元件,有G-Box、Box 4、GA-motif、GATA-motif、TCCC-motif 、TCT-motif、GT1-motif 、I-Box 、SORLIP1AT 和TBOXATGAPB 等,以及多个激素和胁迫响应相关元件。其中,激素响应元件包括:ABA 响应元件ABRE 和DPBFCOREDCDC3;细胞分裂素诱导相关元件ARR1AT;乙烯诱导相关元件ERE;GA 响应元件GARE-motif 和TATCCAOSAMY;茉莉酸甲酯响应元件TGACG-motif 等。逆境胁迫响应元件包括: 水分胁迫相关响应元件ACGTATERD1 和CBFHV ; 低温响应元件CRTDREHVCBF2 以及受伤和病原体应答相关元件W box 等。值得注意的是,其他作用元件中类黄酮生物合成相关的调控元件或转录因子识别位点MYBCORE 、MYBPLANT 和MYCCONSEN-SUSAT 多达17 个。 这些元件的存在表明PsDFR在牡丹花青素苷的生物合成中发挥重要作用,并可能在转录水平上受到光照、激素(如GA、ABA、乙烯)和非生物胁迫(如干旱、低温)等多种因素的调节。此外,在PsDFR启动子序列中还发现了叶肉细胞特异表达作用元件 CACTFTPPCA1 、 花粉特异激活元件POLLEN1LELAT52 和GTGANTG10 等控制基因器官特异表达的作用元件,说明PsDFR在植物体内的表达可能具有一定的器官特异性。
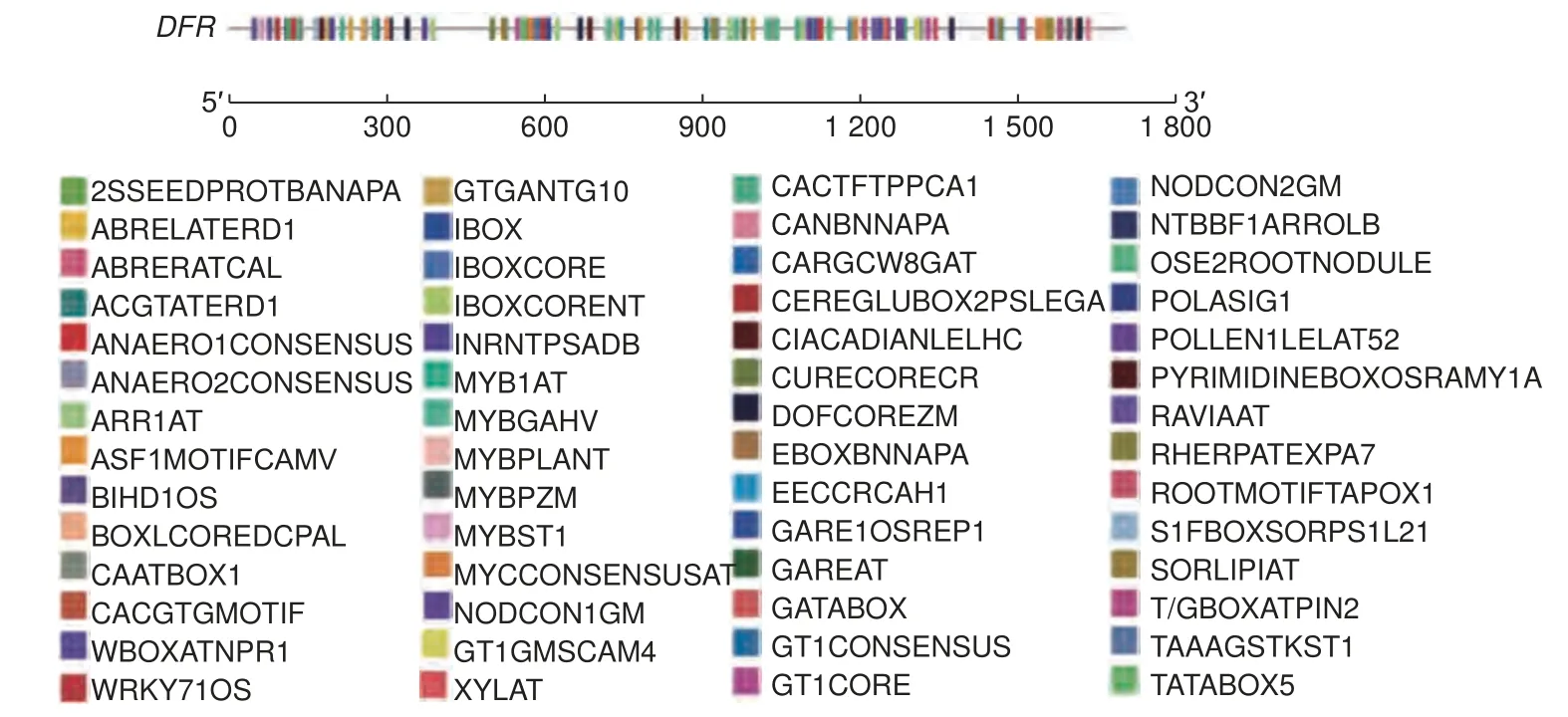
图3 PsDFR 启动子顺式作用元件分布图Fig. 3 Distribution map of the cis-elements of PsDFR promoter
2.2 启动子不同缺失片段的表达载体构建
5 个不同长度的缺失片段(图4)是根据PsDFR启动子顺式作用元件预测结果,从转录起始位点上游1 623 bp 的5′端对启动子序列进行逐步删除,最终获得:1 687 bp(P0,-1 623 至+ 64)、1 287 bp(P1,-1 223 至 + 64)、980 bp(P2,-916 至 + 64)、507 bp(P3,-443 至+ 64 )和140 bp(P4;-76 至 + 64)。
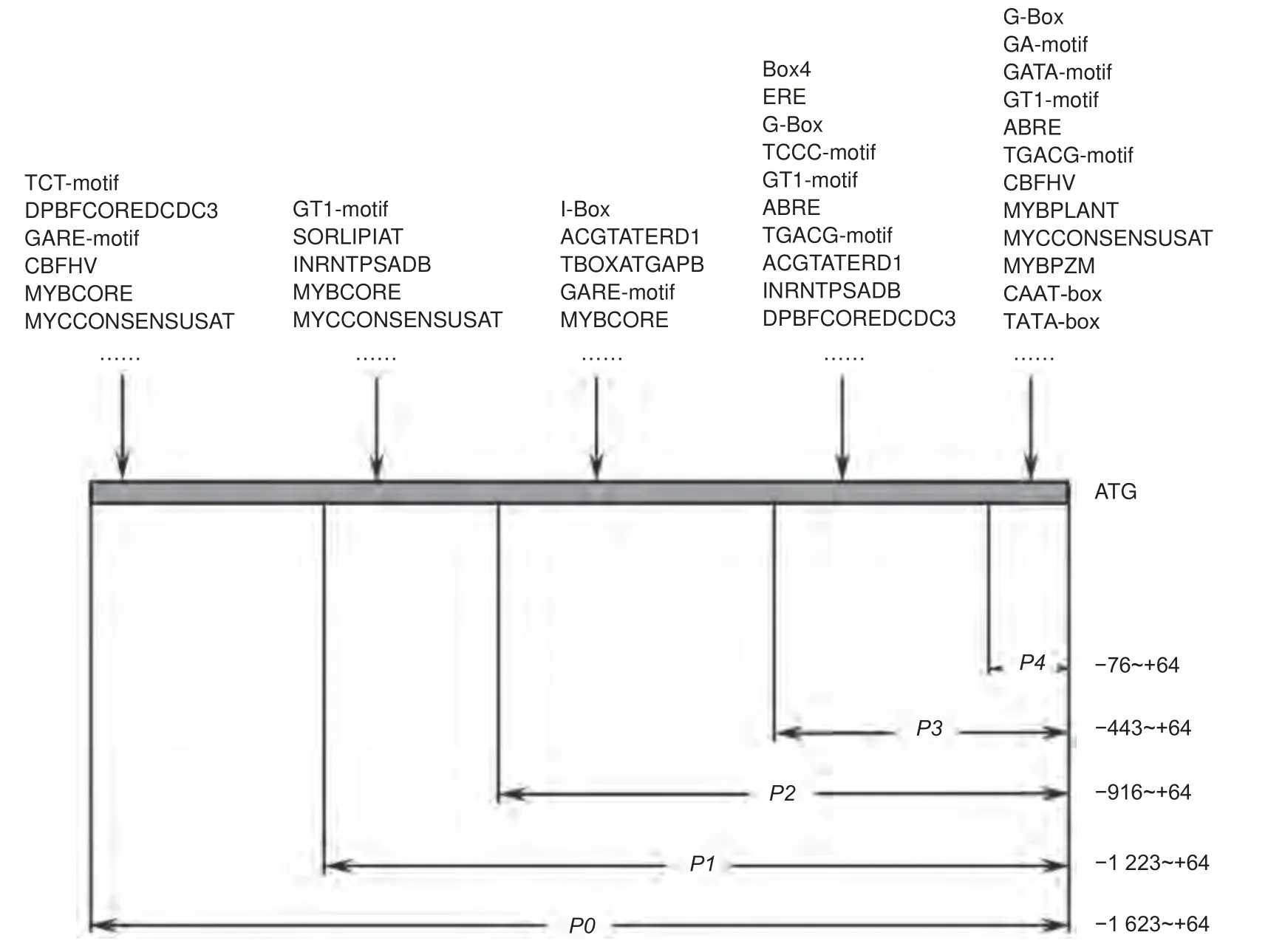
图4 PsDFR 启动子缺失片段Fig. 4 Schematic diagram of the PsDFR promoter deletions
利用同源重组的方法将获得的PsDFR启动子全长序列P0构建到pCAMBIA1301-GUS 表达载体上,菌液PCR 和测序结果证明该序列已经替换了原有的35S 启动子并与GUS 基因融合(图5),重组质粒被命名为pCAM-PsDFRp0。以该质粒为模板,通过同样的方法,经菌液PCR 和测序验证,获得了另外4 个不同缺失片段的pCAMBIA1301-GUS 融合表达载体pCAM-PsDFRp1、pCAMPsDFRp2、pCAM-PsDFRp3 和pCAM-PsDFRp4(图5)。
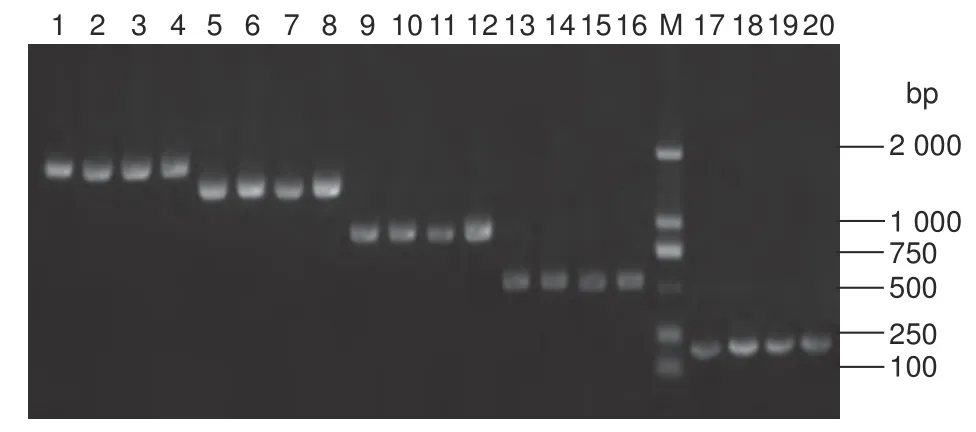
图5 PsDFR 启动子及其缺失片段的融合表达载体验证Fig. 5 Verification of PsDFR promoter and deletion fragment fusion expression vector
2.3 启动子缺失片段在烟草叶片中的瞬时表达及GUS 染色分析
为研究PsDFR启动子各区域的表达活性,将含有不同缺失片段的融合表达载体分别转化农杆菌后,注射至烟草叶片中进行GUS 组织化学染色分析。结果由图6 所示,注射无菌水的阴性对照的叶片没有染色,而由启动子CaMV35S 驱动的阳性对照GUS 染色最明显。在不同PsDFR启动子缺失片段的瞬时表达中,随着启动子5′端序列的缺失,染色程度由深到浅变化,染色部位也越来越小。特别是全长启动子P0在相继缺失了-1 623 至-1 223(P1)以及-1 223 至-916(P2)之间的区域后,缺失材料的GUS 染色明显变浅,最后仅在叶脉周围观察到稀疏分散的蓝色斑点,表明5 个缺失片段均具有启动子活性,但活性随片段的缩短而减弱,-1 623 至-916 之间的区域对于其活性具有重要作用。
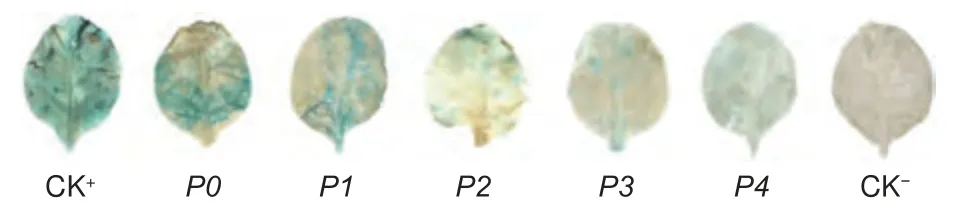
图6 PsDFR 启动子缺失片段瞬时转化烟草染色结果Fig. 6 Detection of transient expression of different PsDFR promoter deletion regions in tobacco leaves
2.4 光照和激素对启动子不同缺失片段活性的影响
对不同农杆菌侵染48 h 后的烟草分别进行ABA、MeJA、黑暗和光照处理后,检测叶片GUS活性,结果如图7 所示,对照中,GUS 活性随启动子缺失片段的缩短而不断降低,这与染色结果(图6)相一致。黑暗处理后,所有启动子缺失片段诱导的GUS 酶活性均受到不同程度抑制,恢复光照后,除P4外其余启动子活性均有显著升高(p<0.05);ABA 处理明显抑制了P0和P1下游GUS 的表达活性,与对照相比,分别下降了51.85%和56.12%,但随着5′端序列的逐渐缺失,ABA 对启动子P2的抑制作用明显降低,并反而促进了P3的启动子活性,约达对照的1.28倍;MeJA 明显抑制了不同启动子片段诱导的GUS 活性,与对照相比,均下降了40%以上。
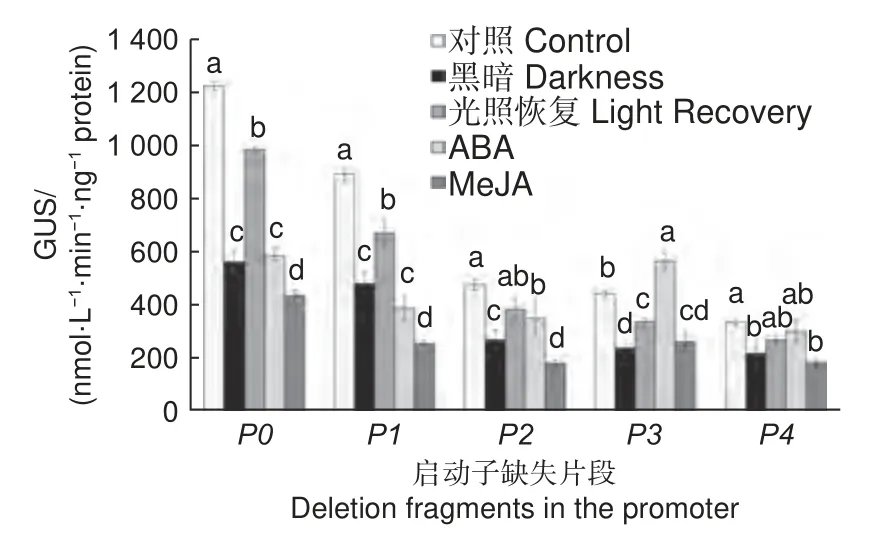
图7 光照和激素诱导下PsDFR 启动子缺失片段驱动的GUS 活性分析Fig. 7 Analysis of the GUS activity driven by PsDFR promoter deletion regions in response to light and hormone treatments
3 讨论
本研究利用染色体步移法从牡丹花瓣中分离到PsDFR基因长1 687 bp 的启动子序列。该序列位于转录起始位点上游的-1 623 bp 处,除了包含调控转录起始精确度和效率的核心启动子元件外,还具有光响应元件、激素和逆境胁迫相关元件以及组织特异性表达相关元件等。
前期研究发现,随着花朵的着色,PsDFR基因的表达量与花青素苷的含量呈正相关,并且在花瓣中特异高表达,在叶片、萼片、雄蕊和心皮中的表达水平很低[16,25]。然而,除一些花粉特异激活元件外,在PsDFR启动子中未发现其他花器官相关特异元件。Roh 等[26]通过启动子缺失发现,花瓣特异性启动子PISTILLATA(BnPI)中的光响应元件G-box 可能与花瓣特异性表达有关。Imai 等[27]发现在菊花(Dendranthema morifolium(Ramat.)Tzvel.)CmCCD4a的ATG 上游存在一些与花瓣特异性表达相关的未知顺式元件。在非洲菊中,不同花器官间的着色差异与DFR启动子的结构无关,而是由调控其表达的上游转录因子启动子上的空间特异性顺式作用元件调控的[28]。因此,为了明确哪些顺式元件在PsDFR的花瓣特异性高表达中起重要作用,还需对其启动子或与其互作的转录因子启动子进行更全面、细致的片段缺失分析。
在启动子缺失片段的GUS 染色分析中,发现不同区域的PsDFR启动子表达活性具有明显差异。全长启动子片段(P0)活性最高,但随着5′端序列的逐步缺失,活性不断降低。特别是删除-1 623 至-916 之间707 bp 的片段后,启动子活性迅速下降,推测该片段中可能含有与启动子活性相关的核心元件。根据顺式元件分析结果,发现该片段包含2 个Inr 元件(INRNTPSADB)。Nakamura等[29]证实该元件可在缺乏TATA-box 的情况下对转录激活起关键作用。在PsDFR启动子中,Inr 元件是否在TATA-box 存在的情况下也具有激活转录起始的作用,还有待进一步研究。
光照是影响植物合成花青素苷的重要环境因子之一,不同光质、光照强度和光周期信号可通过促进或抑制类黄酮合成相关基因的表达,调控花青素苷的合成和积累。Hartmann 等[30]在拟南芥(Arabidopsis thaliana(L.) Heynh.)CHS启动子区域发现了一个由G-Box 核心元件(ACGT)和MYB 识别元件(ACCWACCNN)组成的光响应单元LRU。小麦(Triticum aestivumL.)TaDFRB在花青素苷积累的部位高表达,并受光诱导明显上调,也与其启动子中包含这两个元件有关[31]。本研究中,PsDFR启动子也含有该元件组合(GBox 和MYBPZM),并同时具有Box4、GAmotif、TCT-motif、GT1-motif、I-Box 等多个光响应元件。光处理后,不同启动子缺失片段对光照变化均有明显响应,即在黑暗条件下启动子活性降低,恢复光照后启动子活性升高,这与Gollop等[32]对葡萄(Vitis viniferaL.)DFR启动子的研究结果一致,推测这些元件在牡丹花青素苷生物合成对光照的响应中起重要作用。
除光照外,DFR在表达过程中还受ABA、MeJA 等多种激素影响。如ABA 可上调草莓(Fragaria ananassaDuch.)[33]和葡萄[34]果实中DFR的表达水平,进而促进花青素苷的积累;红肉苹果(Malus sieversiif.niedzwetzkyana(Dieck) Langenf.)MdDFR的转录受MeJA 正调控,但受ABA 负调控[35]。目前,关于激素如何影响牡丹DFR的表达以及DFR的启动子活性如何响应激素处理的报道很少。在PsDFR启动子中,发现了典型的ABA 响应元件ABRE 和DPBFCOREDCDC3 以及MeJA 响应元件TGACGmotif 和T/GBOXATPIN2 。ABA 处理抑制了P0和P1的启动子活性,但对启动子缺失片段P2的抑制作用明显降低,而P3的启动子活性显著高于对照,推测这与启动子-443 至-76 bp 序列区段存在ABA 应答相关元件有关,且-1 623 至-916 bp 之间可能存在抑制ABA 响应的未知元件。在MeJA 方面,尽管MeJA 处理通常被认为可促进花青素苷的积累[36],但在拟南芥、甘薯(Ipomoea batatasLam.)等植物中发现,受糖信号、品种及组织特异性或处理浓度的影响,MeJA 处理也会对DFR基因的表达及花青素苷合成起抑制作用[37-38]。本研究中,MeJA 处理后各缺失片段的启动子活性均有明显下降,推测100 μmol·L-1MeJA 在‘黑花魁’牡丹花青素苷的合成中可能起负调控作用。
4 结论
DFR 是植物花青素苷生物合成下游阶段的关键酶。本研究通过染色体步移法分离了牡丹PsDFR基因长1 687 bp 的启动子序列。顺式作用元件分析结果表明PsDFR的表达可能受光信号、激素和胁迫等多种信号的共同调节。通过对瞬时转化烟草叶片的GUS 组织化学染色和酶活性进行分析,明确了PsDFR启动子活性受光的正调控以及MeJA 的负调控;-1 623 至-916 bp 间的区域对于启动子活性具有重要作用,-443 至-76 bp 是响应ABA 处理的核心区域。上述结果为进一步揭示PsDFR响应不同环境信号参与牡丹花色形成的调控机制提供参考。

