不同温度和胁迫时长下蓝云杉的光合响应
欧阳芳群,崔 夏,张 辉,邓军育,石青松,李玉岭,孙 猛*
(1. 植物迁地保护国家林业和草原局重点实验室,北京 100093;2. 北京市花卉园艺工程技术研究中心,北京 100093;3. 北京市植物园管理处,北京 100093)
云杉属(Picea)树种多,分布广,在陆地生态系统中占有特殊生态位,是高寒地区的生态建群种和重要用材树种。根据联合国政府间气候变化专门委员会的第六次评估报告(https://www.ipcc.ch/report/ar6/wg2/),按照目前世界各国的减排措施,到本世纪末全球平均气温将上升2.7 ℃,远高于《巴黎协定》控制全球气温上升的目标,将导致灾难性的气候变化。树木年轮记录随着温度的升高白云杉(Picea glauca(Moench) Voss)径向生长降低[1]。分布在欧洲中部的欧洲云杉(Picea abies(L.) H. Karst.)因为夏季温度超过其可忍受的临界值而出现死亡[2]。云杉生长非常依赖其生长环境[3-4],全球持续暖化(www.epa.gov/climate-research)和降水量减少将不利于云杉生长[5-8],对云杉种的适合度和生产力将有严重影响[9]。
高温胁迫会影响植物各种生理生化过程,其中光合作用是植物对温度变化最敏感的生理过程[10],这会导致光系统II(PSII)受体的还原-氧化发生变化,并降低两个光系统(PSⅠ和PSII)中光合电子传递效率[11]。植物光合作用的响应取决于热胁迫的强度和持续时间[12]。中度热胁迫引起光呼吸增加和气孔导度降低,导致光合作用短暂降低;严重高温胁迫或热激下,由于类囊体膜完整性丧失和光系统失活, 叶片光合电子传输能力首先发生降低[13]。如果高温胁迫时间超过植物耐热阈值,便会导致光合机构发生不可逆的损害,进而对植物光合碳同化过程产生长远影响。严重的伤害能显著降低树木的生长和抵抗病虫害的能力,导致其死亡[14]。因此高温胁迫对植物的伤害及其防御机制研究已越来越受到重视[15]。叶绿素荧光作为探测植物光合作用的“无损”探针,能够有效反映几乎所有光合作用过程的变化。高温42~50 ℃处理白云杉30 min,其初始荧光(F0)随温度升高而平方增加,而最大荧光(Fm)、可变荧光(Fv)、PSII 的最大光化学效率(Fv/Fm)和光化学荧光淬灭 (qP)随胁迫温度升高而降低,在42~43 ℃ 处理后光系统II(PSII)失去了磷酸化的能力,44~46 ℃处理后严重限制了卡尔文循环利用NADPH 和ATP 的能力[16]。青杄(Picea wilsoniiMast.)在高温35 ℃处理4 个月后Fv/Fm显著低于25 ℃处理[17]。欧洲云杉在遭受了44 ℃短时热激下,Fv/Fm没有明显变化,而52 ℃短时热激下,PSII 的功能已明显抑制,Fv/Fm降为对照组的63%,电子传递链的放氧复合体遭到了严重破坏,电子传递能力受到严重抑制[18]。和对照组相比,42 ℃热处理小叶杨(Populus simoniiCarrière)3、6 h 后F0、Fv/Fm和qP没有发生显著变化,而处理12 和24 h 后Fv/Fm和qP显著降低,但是F0增加[19]。因此植物对热胁迫的响应不仅和胁迫的温度有关,还依赖于时间长短。
高温胁迫下,植物并非消极被动,能在生理生化及分子水平上发生一定变化来渡过胁迫期。但目前对云杉属树种的光系统对高温胁迫的响应和适应机制尚待揭示。蓝云杉(Picea pungensEngelm.)因其针叶颜色湛蓝,观赏价值高,是优良的园林景观树种。本课题组研究发现从湿润地区引进的北美蓝云杉表现出比乡土种青海云杉(Picea crassifoliaKom.)更好的生长势[20],推测其可能具有较好的适热性。本研究以蓝云杉树种为对象,通过模拟高温环境,研究蓝云杉在不同温度和不同胁迫时长下的植株形态变化、针叶相对含水量差异和PSI、PSII 的荧光参数响应热胁迫的特点,分析热胁迫解除后的恢复能力,为蓝云杉在景观生态等领域的应用和适热性遗传改良提供理论参考。
1 材料方法
供试的蓝云杉苗木来自甘肃省小陇山林业实验局林业科学研究所自育播种苗,种子来源美国亚利桑那州,苗龄均为5 a。在高温胁迫处理前和恢复期,苗木生长在塑料大棚温室里,平均温度25 ℃,湿度75%,苗木生长在营养钵(直径22 cm,高度22 cm)中,基质是体积比7:3 的腐殖质土和珍珠岩。75%的遮阳网用于夏季防晒。
(1)不同温度高温胁迫试验:用恒温恒湿实验箱(HS-408)设定3个温度处理(45、50、55 ℃)和常温对照(25 ℃,CK,0 h)。处理时间为6 h(8:00 am—2:00 pm),每温度处理4 株;
(2)不同耐热时长高温胁迫试验:用恒温恒湿实验箱(HS-408)设定1 个温度处理(45 ℃)和常温对照(CK,0 h)。处理时间6 h(8:00 am—2:00 pm),12 h(6 h 重复2 d),18 h(6 h 重复3 d)和24 h(6 h 重复4 d)。每温度处理4 株。
处理结束后0 d、恢复7 d 和恢复 28 d 统计植株叶色变化、落叶情况等。分别测定每株苗木的一年生枝条中段 2 cm 的针叶鲜质量和干质量(0.1 g)。计算叶片相对含水量:相对含水量=(鲜质量-干质量)/鲜质量 × 100%;每个温度、耐热时长处理下各选 3 株苗木测定,每株选择 1 枝条。
每株苗木选择1 份5~6 个完全展开成熟叶(并排用胶带粘好),用HandPEA 仪器测定叶绿素荧光诱导动力学曲线(OJIP 曲线)和PSII 荧光参数[21](表1)。每处理3 个生物学重复。OJIP曲线是标准化后进行绘制的,标准化公式为Vt=(Ft-F0)/(Fm-F0)。式中:Vt表示任一时间点的荧光标准值,Ft表示任一时间点的荧光值。
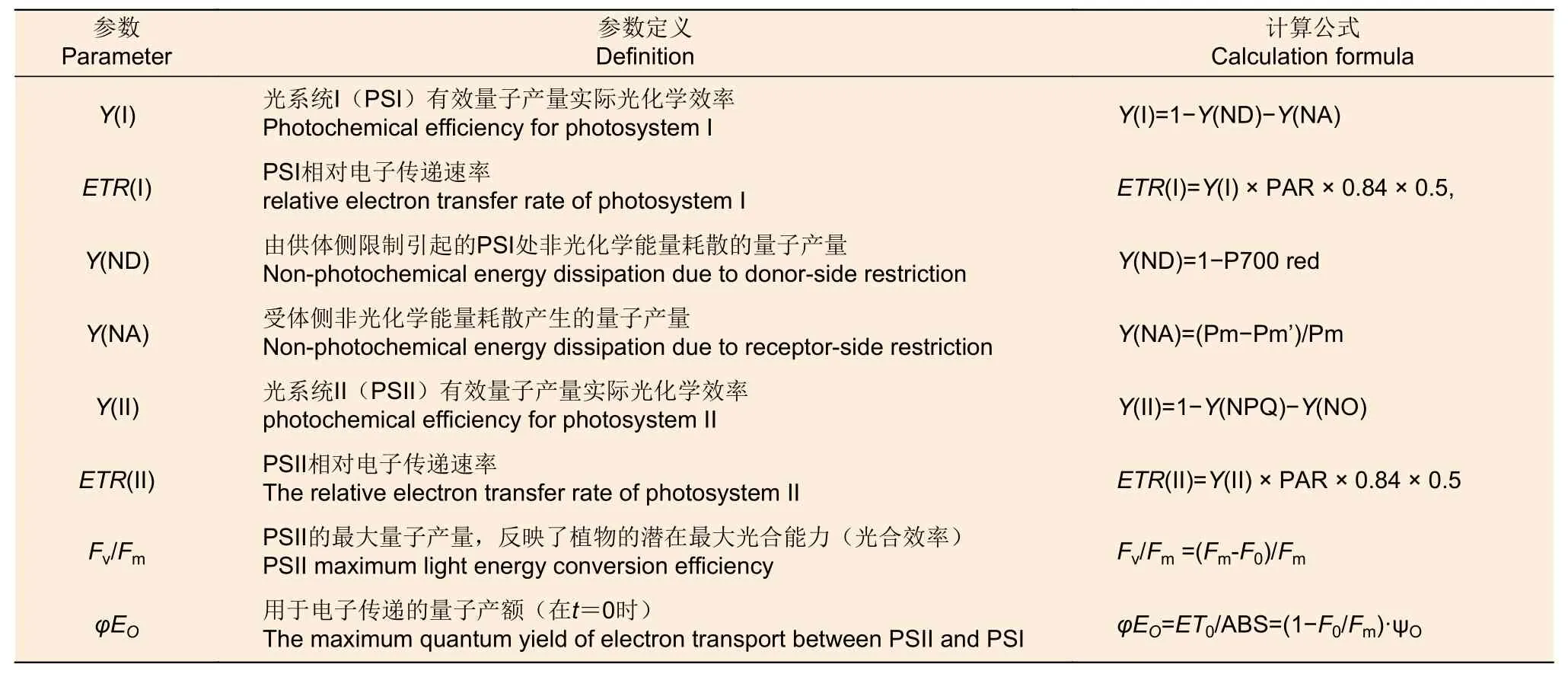
表1 光系统荧光参数 Table 1 Fluorescence parameters of photosystem
同样,每株苗木选择1 份5~6 个完全展开成熟叶(并排用胶带粘好),用荧光仪光纤型双通道PAM-100 测量系统Dual-PAM-100 (Heinz Walz GmbH, Effeltrich, 德国)测定各处理下苗木PSI 和PSII 的叶绿素荧光活性[22]。测定的参数(表1)包括PSI 和 PSII 有效量子产量实际光化学效率Y(I)和 Y(II);PSI 和PSII 相对电子传递速率ETR(I)和ETR(II);受体侧非光化学能量耗散产生的量子产量 Y(NA) 和由供体侧限制引起的PSI 处非光化学能量耗散的量子产量Y(ND)。暗适应后最小和最大荧光产额F0和Fm。苗木暗适应20 min 后开始测定。
消费趋势普遍代表着资本自由转移,若非洲大陆利用好来自中国的市场,当地旅游业极有可能在GDP构成和创造就业等方面大大改变非洲。
(4)统计分析
采用SAS9.1 软件GLM 模块进行方差分析、多重比较。方差分析线性模型
式中:Xijk表示每株观测值,μ表示试验均值,Ti表示不同温度或者耐热时长效应(固定),eijk表示随机误差。用R 软件作图。
2 结果分析
2.1 不同温度胁迫响应
2.1.1 表型响应 与对照相比,45 ℃处理6 h 后蓝云杉表型未发生明显变化(图1A),且恢复28 d 时,仍与对照差别不大(图1B);而50 ℃处理后蓝云杉针叶变黄,55 ℃处理后蓝云杉针叶颜色不但变黄,而且直接干枯掉落;恢复28 d 时,50 ℃和55 ℃处理的蓝云杉整株针叶都变黄,基本干枯掉落(图1)。

图1 蓝云杉高温处理6 h(A)和恢复28 d 时(B)的表型变化Fig. 1 Phenotypic changes in Picea pungens with high temperature treatment for 6 hours (A) and recovery for 28 days (B)
2.1.2 针叶相对含水量差异 处理6 h 后、恢复7、28 d 时,针叶相对含水量在温度处理间差异均极显著(P<0.01,表2)。经DUNCAN 多重比较,针叶相对含水量在处理后和恢复7 d 时,45 ℃处理和对照差异不显著,50 ℃和45 ℃之间差异也不显著,相对含水量在0.60~0.66 之间;而恢复28 d 时只有45 ℃和对照无显著差异,相对含水量为0.64,50 ℃处理后降至0.25。55 ℃处理后,恢复7 d 和28 d 相对含水量在0.15~0.19,远低于对照(图2)。
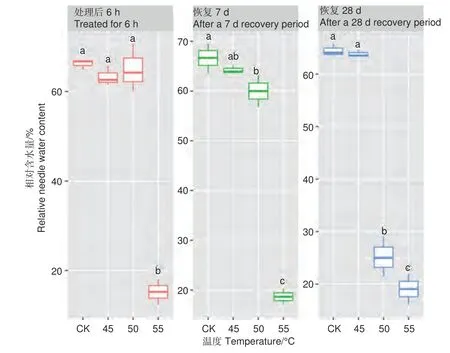
图2 针叶相对含水量在不同温度处理下多重比较,小写字母代表邓肯分析结果Fig. 2 DUNCAN comparison of the relative needle water content under different temperature treatments, and the lowercase letters represent the DUNCAN analysis results
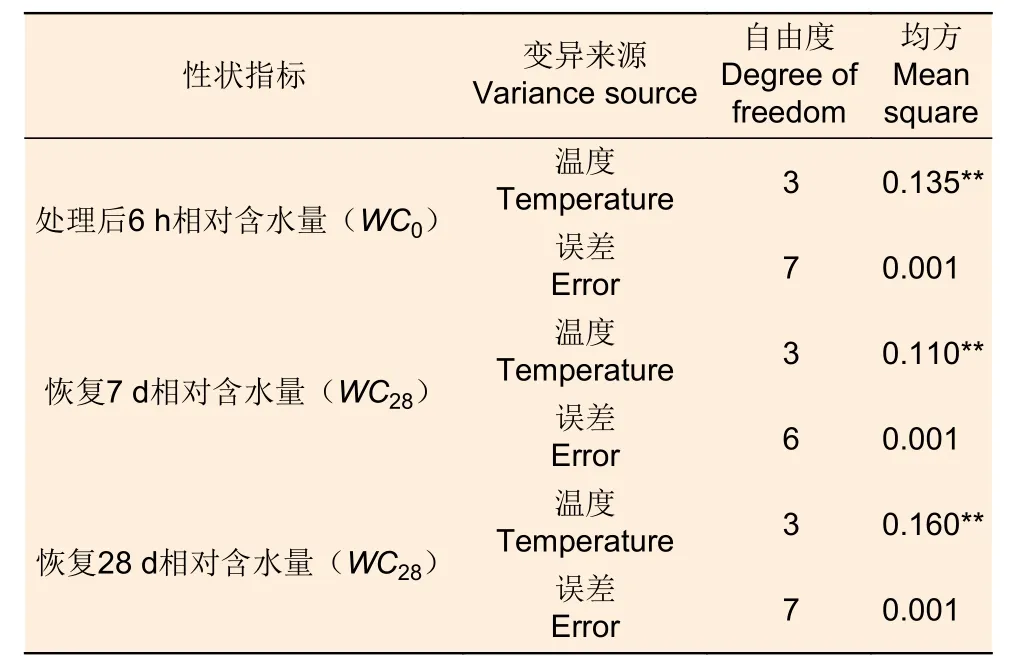
表2 针叶相对含水量方差分析Table 2 Variance analysis of the relative water content of needles
2.1.3 叶绿素荧光参数 不同温度处理后6 h、恢复7、28 d 时,除Y(NA) 在恢复7 d 时不显著外,针叶PSI 荧光参数(Y(I)、ETR(I)、Y(ND)、Y(NA))在温度处理间均差异显著(P<0.01,表3)。经DUNCAN 多重比较(图3)发现,处理后6 h,Y(I)在对照下是0.36,显著高于50 ℃(0.20)、45 ℃(0.14)和55 ℃(0)。ETR(I) 和Y(I) 的趋势一致。恢复28 d,45 ℃处理后的Y(I)和ETR(I)与对照无显著差异,显著大于50 ℃和55 ℃处理。这两种温度下Y(I)、ETR(I)、Y(ND) 和Y(NA)的值均为0。
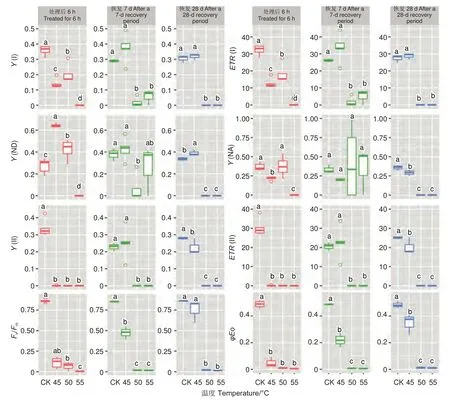
图3 光系统荧光参数在不同云杉种不同温度处理下多重比较Fig. 3 DUNCAN comparation of chlorophyll fluorescence parameters of photosystem under different temperature treatments of different spruces

表3 光系统荧光参数方差分析 Table 3 Variance comparation of chlorophyll fluorescence parameters of photosystem
2.1.4 OJIP 曲线 蓝云杉三种温度处理6 h 后、恢复7 d 和恢复28 d 的经标准化后的OJIP 曲线(图4)显示45 ℃处理3 种云杉6 h 后OJ 相上升,且出现K 峰,至JI 相开始下降,到IP 相趋于平缓。和对照相比,恢复7 d 时候除了JI 相外其他基本恢复正常,到恢复28 d 时,OJIP 曲线基本恢复正常。而50、55 ℃处理6 h 后在恢复7 d 和恢复28 d 时,OJIP 曲线未恢复正常。
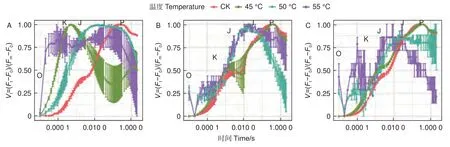
图4 3 种温度处理6 h 后(A)、恢复7 d(B)、恢复28 d(C)后的OJIP 曲线Fig. 4 OJIP curve of the three temperatures under CK, 45, 50 and 55°C for 6 h (A) and the recovery period 7 d (B) and 28 d (C).
2.2 蓝云杉45 ℃不同耐热时长响应
2.2.1 表型效应响应 和对照相比,45 ℃处理6、12、18、24 h 后蓝云杉表型未发生明显变化;恢复7 d 时,45 ℃处理6 h 依然变化不大,但是12、18 h 针叶颜色变黄,失水,24 h 处理几乎整株针叶变黄;恢复28 d 时, 12、18 h 针叶继续失水、变黄,24 h 处理整株针叶都变黄,且基本干枯掉落(图5)。

图5 蓝云杉45 ℃处理后(A)、恢复7 d(B)、恢复28 d 时(C)的表型变化Fig. 5 Phenotypic changes in Picea pungens with high temperature treatment for 6 hours (A),recovery for 7 days and recovery for 28 days (B), from left to right
2.2.2 针叶相对含水量差异 针叶相对含水量在45 ℃不同耐热时长处理后6 h、恢复7 d、28 d差异显著或极显著(P<0.05 或者P<0.01,表4),经DUNCAN 多重比较,针叶相对含水量在处理后时长18 h 处理下值为0.45,显著低于其他时长处理和对照(0.62~0.66)。而恢复7 d 时,12、18 h处理后的相对含水量0.77~0.79,显著高于对照、6 h 和24 h 处理(分别为0.67、0.64、0.68)。恢复28 d 时,对照、6 h、12 h 处理的针叶相对含水量之间无显著差异,显著高于24 h 处理(0.24),18 h 处理居中(0.47,图6)。
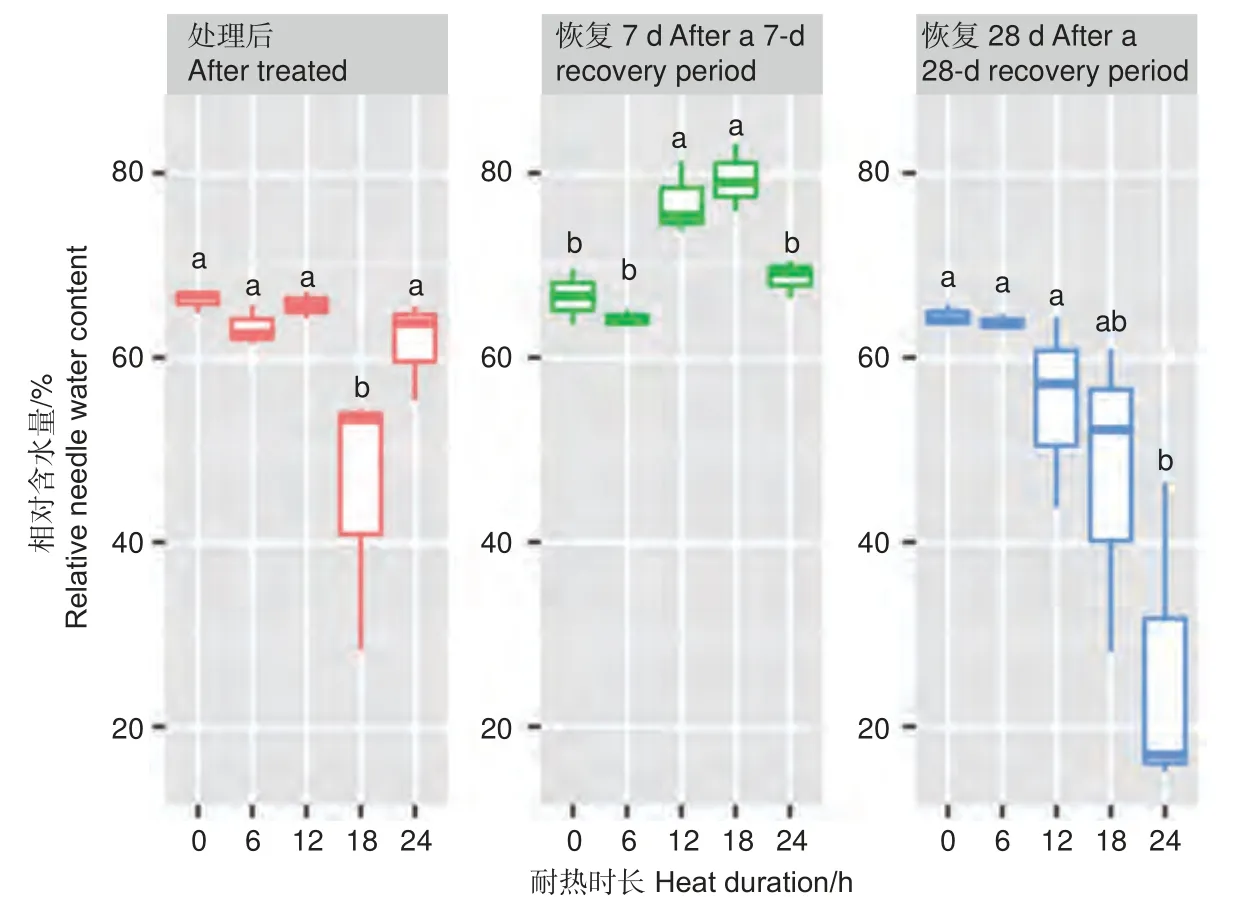
图6 针叶相对含水量在45 ℃不同时长处理下多重比较Fig. 6 DUNCAN comparation of the relative needle water content under different duration with 45 ℃ treatment
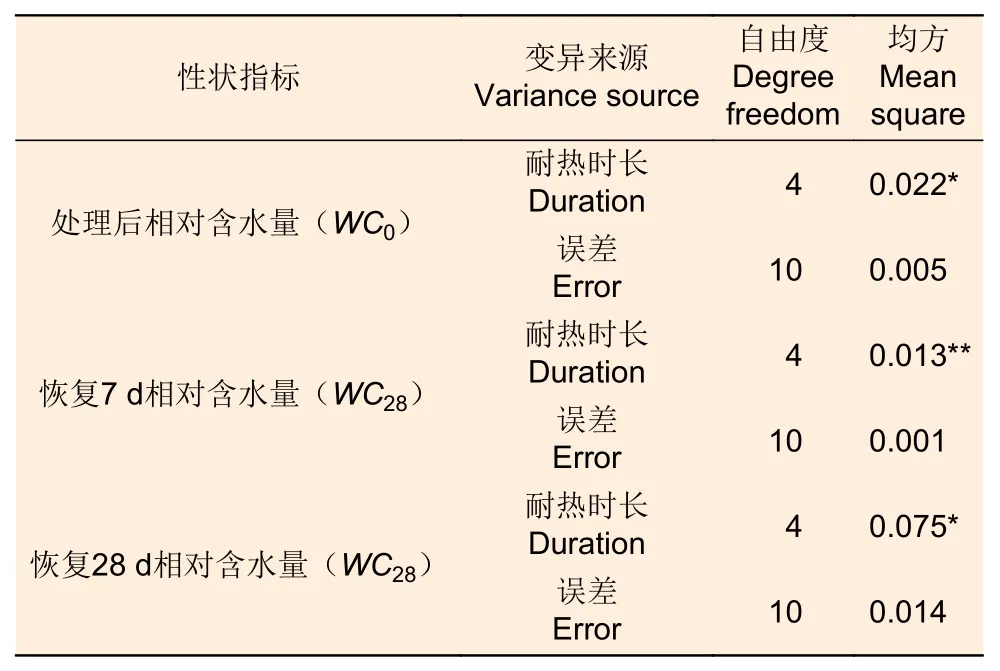
表4 45 ℃不同耐热时长处理蓝云杉针叶相对含水量方差分析Table 4 Variance analysis of the relative water content of needles of Picea pungens under different duration with 45 ℃ treatment
2.2.3 叶绿素荧光参数 45 ℃处理后,针叶PSI 荧光参数(Y(I)、ETR(I)、Y(ND)、Y(NA))在耐热时长处理间差异极显著(P<0.01,表5)。经DUNCAN 多重比较,对照下Y(I)值为0.36,显著高于6 h(0.14)、12 h(0.11)等全部处理,12、18 和24 h3 种时长处理间差异不显著(0.08~0.11)。ETR(I) 和Y(I) 趋势一致。Y(ND) 趋势则相反,对照处理下值最低(0.27),6 h 处理下最高0.64,12、18 h 间无显著差异(0.55、0.49)。Y(NA)在对照、12、18 h 处理间差异不显著,低于24 h 处理,6 h 处理居中。恢复7 d 时,Y(I)、ETR(I) 在耐热时长处理间差异极显著(P<0.01);恢复28 d 时,耐热时长处理显著影响Y(I)、ETR(I)和Y(ND) 值(P<0.05)。经DUNCAN 多重比较,恢复7 和28 d,Y(I)、ETR(I)在时长6 h处理值最高,分别为0.37、33.56 和0.32、28.7,和对照无显著差异,显著高于其他3 种时长处理;恢复28 d 时,Y(ND)在时长24 h 处理值最高,其他时长处理间无显著差异。
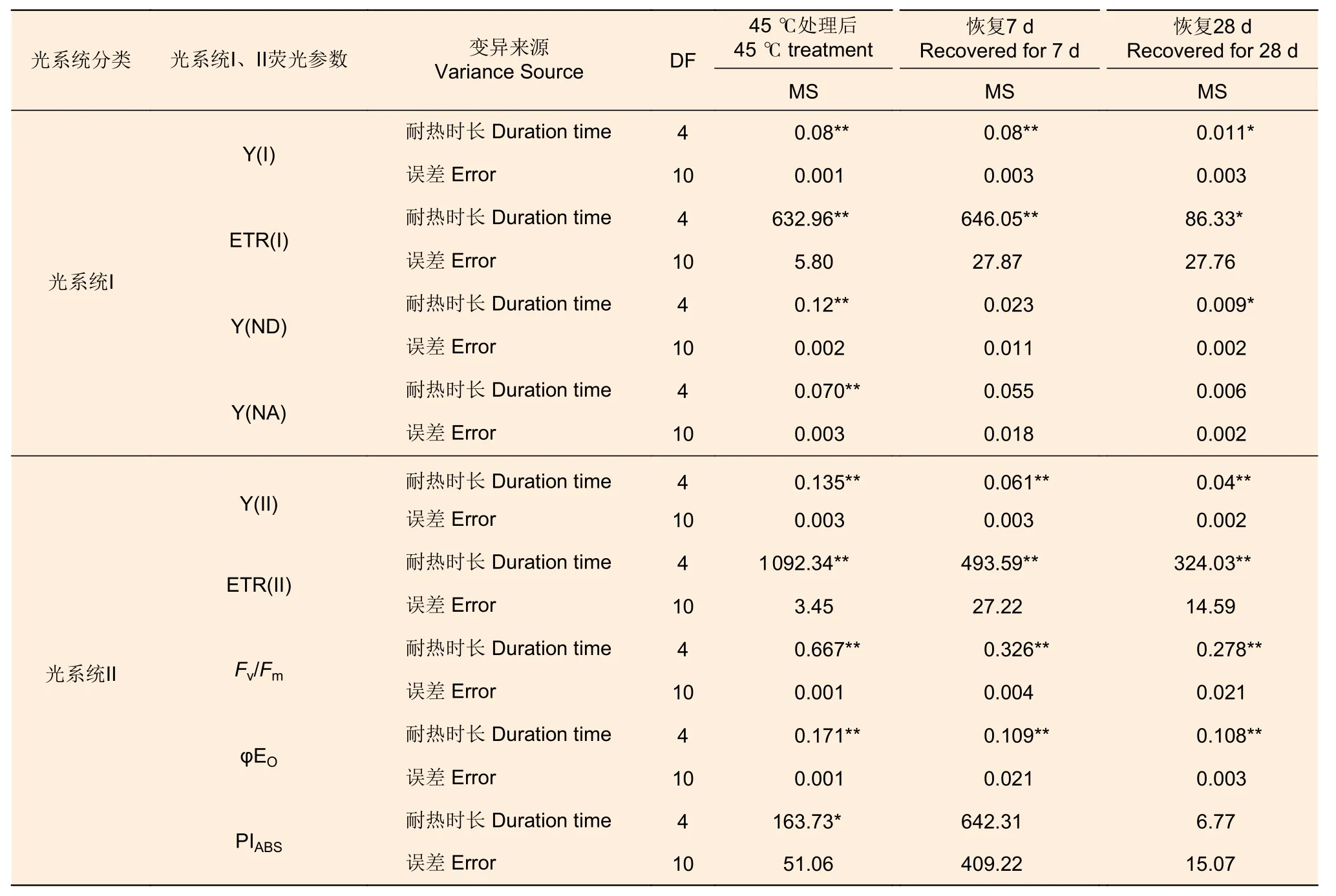
表5 45 ℃不同耐热时长处理蓝云杉荧光参数方差分析 Table 5 Variance analysis of chlorophyll fluorescence parameters of needles of Picea pungens under different duration with 45 ℃ treatment
针叶PSII 荧光参数(Y(II)、ETR(II)、Fv/Fm、φEo)在处理后、恢复7、28 d 在耐热时长处理间差异均极显著(P>0.01,表5)。经DUNCAN 多重比较,处理后,Y(II) 的值在对照下最高(0.33),其他各时长值均为0。恢复7 d 时,时长为6 h 的处理Y(II)值由0 恢复到0.25,和对照无显著差异,显著高于其他时长处理(几乎为0)。ETR(II) 和Y(II) 趋势基本一致。在6 h 时长处理下,Fv/Fm(0.11)显著低于对照(0.86),而其他时长Fv/Fm几乎为0。恢复7 d 时,6 h 时长处理Fv/Fm由0.11 恢复到0.47,其他时长依然几乎是0。恢复28 d 时,6 h 时长处理恢复到0.75,和对照无显著差异,12、18 和24h 时长处理分别恢复到0.33、0.21、0.19,显著低于对照。φEo的变化趋势和Fv/Fm基本一致,只是18 h 和24 h 处理后和恢复期φEo几乎为0(图7)。
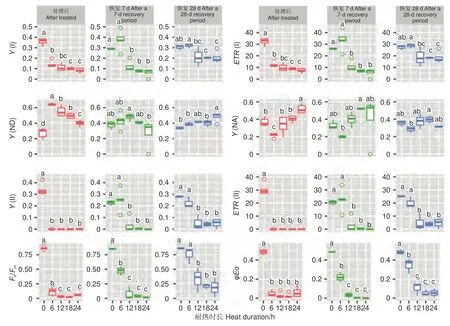
图7 针叶荧光参数在45 ℃不同时长处理下多重比较Fig. 7 DUNCAN comparation of chlorophyll fluorescence parameters under different duration with 45 ℃ treatment
2.2.4 OJIP 曲线 蓝云杉不同耐热时长处理后、恢复7 d 和恢复28 d 的经标准化后的OJIP 曲线(图8)显示45 ℃处理6 h 后OJ 相上升,且出现K 峰,至JI 相开始下降,到IP 相趋于平缓。恢复7 d 时候除了JI 相外其他基本恢复正常,到恢复28 d 时,OJIP 曲线基本恢复正常。而处理12、18 h 后恢复7 d 和恢复28 d 时,OJIP 曲线KJ、JI相偏离对照较多,处理24 h 后的曲线一直未恢复。
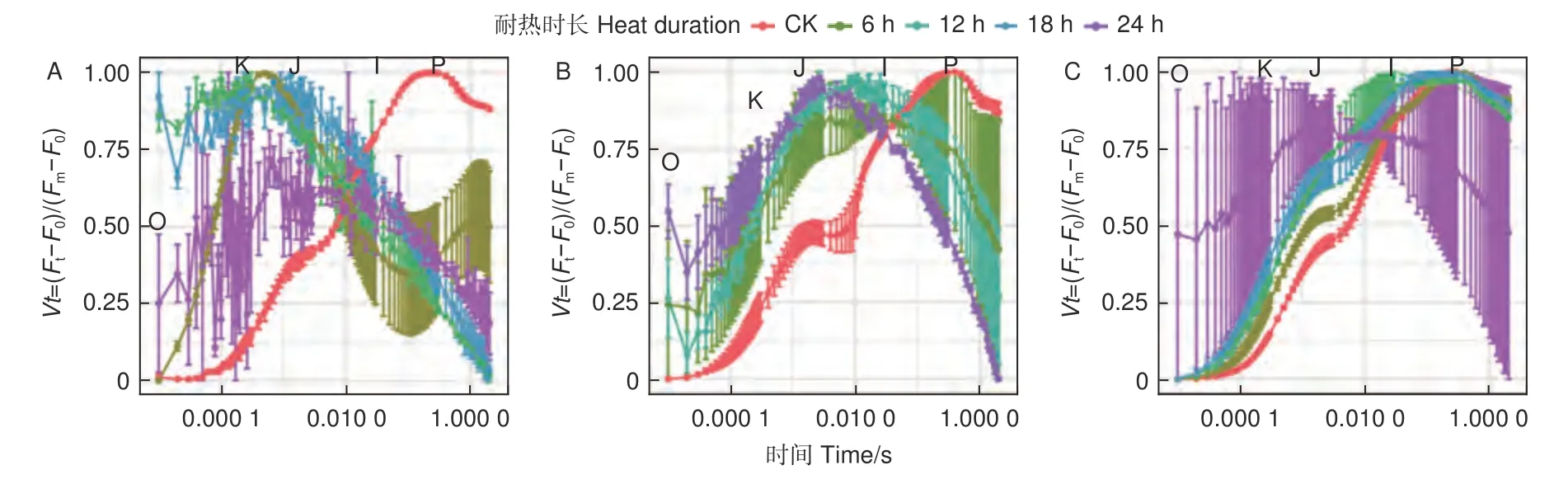
图8 5 种耐热时长处理后(A)、恢复7 d(B)、恢复28 d(C)后的OJIP 曲线Fig. 8 OJIP curve of the three temperatures under five durationsfor after treatment (A) and the recovery period 7 d (B) and 28 d (C).
3 讨论
3.1 蓝云杉对高温的热适应
在较冷地区生长的树木通常不耐高温[23]。适中的温度促进云杉生长[24]。当温度超过植物生长的最佳温度,光合作用和呼吸作用失衡可能会导致生长受到抑制[25-26]。夏季高热对云杉生长有负面影响[27],比如丽江云杉(Picea likiangensis(Franch.)E. Pritz.)、林芝云杉(Picea likiangensisvars.linzhiensisW. C. Cheng & L. K. Fu)、红皮云杉(Picea koraiensisNakai)和白杄(Picea meyeriRehder & E. H. Wilson)4 种云杉在高温(白天温度35 ℃)下生物量降低[5],生长受到抑制[26,28],表明35 ℃超过了适宜云杉生长的最佳温度[25]。研究发现9 种云杉属植物半致死温度在45~50 ℃之间[29]。本研究中蓝云杉可耐45 ℃处理6 h,处理后表型变化小,且在28 d 后基本能恢复,但不耐50 ℃和55 ℃处理。这可能与其针叶相对含水量是分不开的。恢复期,只有45 ℃处理6 h 的苗木针叶相对含水量和对照无明显差异,50 ℃和55 ℃处理远低于对照。而通常热胁迫和干旱是连在一起的,失水伤害是影响苗木质量的首要因素。干旱似乎是云杉生长的最大限制因素。当水势下降到-2.0~3.0 MP 之间时,黑云杉(PiceamarianaBritton, Sterns & Poggenb.)、西加云杉(Picea sitchensis(Bong.) Carrière)和白云杉气孔迅速关闭,净光合速率也会随水势的下降,降到光补偿点[30]。50 ℃和55 ℃处理蓝云杉在恢复期整株针叶颜色变黄并伴有针叶脱落。虽然落叶是一种应对胁迫的积极反应,但是蓝云杉在这个过程中失水严重,恢复28 d 时相对含水量均显著低于45 ℃处理和对照。Tabbush 和 Paul 发现西加云杉苗木晾晒3 h 18 min 后,2 a 后的优树保存率下降到68%,同时高生长也受到影响[14]。所以在极端高温胁迫出现时,温室可以通过降低叶面温度保护植物不被高温损伤。比如适时通风、外遮阳、喷雾降温、增湿等[31],以减少胁迫程度和胁迫时间。此外,气温上升可能会对树木的碳储存产生负面影响[32]。对高温的高度敏感性间接导致植株碳饥饿[33]。在35~40 ℃的温度下,红云杉(PicearubensSarg.)表现出零碳平衡或负碳平衡[34]。因此,温度升高可能导致储备的碳水化合物过度消耗[35]。
3.2 蓝云杉对不同时长的热适应
热损伤不仅与温度有关,还与高温持续时间有关[12]。较低的温度和较短的暴露时间通常导致间接叶损伤,而较高的温度和较长的暴露时间会发生直接叶损伤[12]。光合功能退化和细胞损伤程度依赖于累积的热量,和温度、热胁迫的时间长短是相关联的[12]。同样时间下温度越高或者同样的温度,胁迫时间越长累积的热量越多,叶片受损更严重。白云杉在48~48.5 ℃下30 min 产生50% 的叶损伤,而52 ℃及以上的温度30 min 则可以产生100%的叶损伤[16]。高温对黑云杉的破坏作用随暴露时间呈指数级变化,温度越高,造成破坏所需的时间越短。50% 黑云杉幼苗受到直接损伤需要在暴露47 ℃下51 min,而 48 ℃下只需要24 min[36]。当幼苗持续在高温下时长达180 min 时,黑云杉叶损伤阈值低至44 ℃[36]。当高温胁迫时间达到一定阈值时,胁迫所造成的损伤无法恢复[19,36]。本研究中,蓝云杉在45 ℃处理6 h 可以恢复正常生长,而45 ℃处理24 h 后整株针叶发生损伤,干枯掉落,植株无法恢复正常生长。杨树在42 ℃下热激胁迫短于6 h 时,PSII 经过自我修复可恢复正常功能,但超过6 h 就会造成不可逆转的损伤[19]。
3.3 蓝云杉对高温胁迫的光合响应
众所周知,PSII 在对逆境的光合反应中起着重要作用[37-38]。光合作用对热应激敏感,尤其PSII 高度敏感[11,39]。Fv/Fm比值是研究植物对逆境响应的重要生理指标,它用来度量PSII 原初光能转换效率,常被作为植物是否发生光抑制的标准之一[40]。Fv/Fm比值是决定PSII 最大量子效率的重要参数,它反应线性电子传递速率和整体光合能力。Björkman 发现,植物在正常情况下(包括不同生态类型),其Fv/Fm比值均稳定在0.832 ± 0.004左右[41]。在不同胁迫下该比值出现不同程度下降,表示一定比例的PSII 反应中心被破坏或失活,这种现象称为光抑制[42]。45 ℃处理6 h 后Fv/Fm低至0.07,50、55 ℃处理后、恢复7 和28 d,蓝云杉的Fv/Fm都为0,表明PSII 反应中心可能发生了不可逆失活,或光合机构受到破坏或损伤[43]。研究50、55 ℃处理6 h 和45 ℃处理大于6 h 后蓝云杉的针叶发黄可能是Fv/Fm值下降的原因之一,因为针叶发黄常常意味着发生光氧化和叶绿素浓度降低[44]。对欧洲冷杉(Abies albaMill.)的研究中,初始胁迫温度范围是 42.7 ~43.2 ℃,Fv/Fm降至 50%的极限胁迫温度是51 ℃[45]。黑云杉在 23 ℃时,净光合速率就会显著下降;而当气温达到或大于35~40 ℃时,光合速率将会很低甚至停止[26]。本研究中,45 ℃处理6 h 后恢复期,Fv/Fm恢复至0.75,和对照无显著差异,表明PSII 恢复正常。φEo的变化趋势和Fv/Fm基本一致,只是50、55 ℃,18 、24 h 处理后和恢复期φEo几乎为0。表明QA后的电子传递受到了抑制,PSII 的受体测遭到了毁坏[46]。
尽管和PSII 相比,PSI 在高温胁迫中比较稳定[11]。但有证据表明,在高温下存在相当大的环式电子流,维持跨类囊体膜的能量以及三磷酸腺苷稳态,可能参与预防高温条件下的不可逆损伤[47-48]。蓝云杉经过45 ℃处理6 h 后PSI 的Y(I)、ETR(I)、Y(ND)和Y(NA) 在恢复期和对照差异不显著,表明45 ℃温度处理6 h 对蓝云杉PSI 影响不大。PSI 通过维持强氧化态(P700+),将PSI 受体测的过剩光能耗散吊,减少PSI 损伤[49]。45 ℃处理12、18、24 h 后PSI 多少有些恢复,而50、55 ℃处理后的恢复过程中蓝云杉PSI 的Y(I)和ETR(I)均为0,表明PSI 遭受到了严重损坏。PSI 一旦发生抑制,由于恢复时间较长,往往对光合作用造成更大的影响[50]。
4 结论
蓝云杉的热损伤不仅与温度有关,还与高温胁迫的时间有关。蓝云杉可耐45 ℃处理6 h,但不耐50 和55 ℃处理6 h,蓝云杉PSI 和PSII 遭受到了严重损坏。在45 ℃处理时长超过12 h,φEo几乎为0,针叶发黄掉落,难恢复正常生长。因此,随着全球气候变暖,持续的夏季高温将不利于蓝云杉的生长。本研究为进一步深入探讨蓝云杉耐高温机制研究提供了基础。
致谢:感谢北京市公园管理中心科技课题“云杉属树种引种、抗高温评价与新优种质高效繁育”(ZX2021012)和中央财政林业科技推广示范项目“蓝云杉栽培繁育技术推广示范”(京[2023]TG05 号)资助!感谢林木遗传育种国家重点实验室科研仪器平台。

