miR-3189-3p对结直肠癌患者预后的影响及作用机制探讨
曹宇生, 梁浩源, 李林涛, 蒋开海, 黄天赋, 李广生, 黄许森
作者单位:1.右江民族医学院临床医学院,百色 533000;2.右江民族医学院附属医院胃肠外科,百色 533000
结直肠癌(colorectal cancer,CRC)是发病率第三、死亡率第二的恶性肿瘤[1]。预计到2040年,全球CRC新增病例超过300万,每年可造成约160万例患者死亡[2]。CRC的早期诊断和治疗都极为困难,患者预后差,且患病年龄有年轻化的趋势,给社会带来很大的负担。CRC的发生与年龄、生活习惯、遗传因素、环境因素等密切相关[3-5]。林奇综合征、家族性腺瘤性息肉病会增加CRC的发生风险。有研究显示,一级亲属中有CRC病史者,罹患CRC的风险可升高约20%[6]。CRC患者预后不佳,尽管近年治疗方法有所发展和改进,但患者的5年总生存率仍不理想[7-8]。miR-3189是一种嵌入GDF15基因内含子的新型灵长类动物特异性微小RNA(micro RNA,miRNA)[9]。由miR-3189编码的前体序列在茎环内包含2个成熟的miRNA序列,即miR-3189-3p和miR-3189-5p,长度分别为21个核苷酸和25个核苷酸[10]。有研究显示,miR-3189-3p在肿瘤的发生发展中起到重要作用[11-12],但其在CRC中的报道较少。本文旨在探讨miR-3189-3p对CRC相关生物活动的作用,为CRC的诊疗方法研发提供参考。
1 材料与方法
1.1生物信息学分析 应用CancerMIRNome数据库(http://bioinfo.jialab-ucr.org/CancerMIRNome/),点击“query”,在“search a miRNA”模块中输入“miRNA-3189-3p”,在“TCGA pan-cancer”和“TCGA project”模块分析miRNA-3189-3p在癌组织与正常组织中表达水平的差异,以及miRNA-3189-3p表达水平对CRC患者生存预后的影响。应用ENCORI数据库(https://starbase.sysu.edu.cn/),点击“pan-cancer”,在“miRNA differential expression”及“miRNA survival analysis”模块中进一步验证miRNA-3189-3p在CRC组织与正常组织中表达水平的差异,以及miRNA-3189-3p表达水平对CRC患者生存预后的影响。
1.2主要实验材料 DMEM高糖培养基(武汉普诺赛生命科技有限公司);标准级胎牛血清(赛业生物科技有限公司);磷酸缓冲盐溶液(phosphate buffer saline,PBS)(北京索莱宝科技有限公司);Opti-MEMTMI减血清培养基(美国Gibco公司);0.25%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),含酚红(美国Gibco公司);高效RIPA裂解液(北京索莱宝科技有限公司);Lipofectamine 3000转染试剂(美国Invitrogen公司);hsa-miR-3189-3p mimics、U6的聚合酶链式反应(polymerase chain reaction,PCR)引物(上海生工生物工程有限公司);蛋白上样缓冲液(loading buffer)(上海雅酶生物医药科技有限公司);miRNA第一链cDNA合成(茎环法)试剂盒(上海生工生物工程有限公司);0.2%结晶紫染色液(北京索莱宝科技有限公司);4%组织细胞固定液(北京索莱宝科技有限公司);hsa-miR-3189-3p mimics、miR-3189-3p NC(上海吉玛制药技术有限公司);无蛋白快速封闭液(上海雅酶生物医药科技有限公司);N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)及磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗,辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(武汉三鹰生物技术有限公司);通用型抗体稀释液(上海雅酶生物医药科技有限公司);ECL超灵敏化学发光检测试剂盒(上海雅酶生物医药科技有限公司)。二氧化碳细胞培养箱(MVS-83,Thermo Scientific);超速离心机(WX100+,Thermo Scientific)。
1.3细胞培养与转染 将人CRC细胞LOVO从-80 ℃冰箱取出,37 ℃水浴快速解冻,加入3倍体积完全培养液(DMEM高糖培养基与胎牛血清比例为9∶1)重悬,以1 000 r/min离心5 min后,尽量吸去上清液,加完全培养液重悬后接种至T25培养瓶,摇晃培养瓶使细胞分布均匀后转移至培养箱中培养。待T25培养瓶中细胞融合度达到约90%时,按2×105cells/孔接种至6孔板中,待细胞融合度达到90%后换Opti-MEMTMI减血清培养基饥饿处理2 h。通过Lipofectamine 3000转染试剂将溶解于Opti-MEMTMI减血清培养基的miR-3189-3p mimics和miR-3189-3p NC转染至LOVO细胞中,分别设为实验组和对照组。转染6 h后,将Opti-MEMTMI减血清培养基换成完全培养液。
1.4实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)法检测miRNA-3189-3p表达水平 细胞转染24 h后,采用Trizol法提取总RNA,应用miRNA第一链cDNA合成(茎环法)试剂盒将总RNA逆转录成cDNA,以cDNA为模板进行RT-qPCR,反应体系:2×Power Up SYBR Green Master Mix 10 μL,正向、反向引物各0.4 μL,cDNA 2 μL,ddH2O 7.2 μL。所用引物序列见表1。反应程序:预变性95 ℃ 2 min,1个循环;变性95 ℃ 15 s,退火/延伸60 ℃,1 min,40个循环。每组均设3个复孔,以U6为内参,通过2-ΔΔCt法计算miRNA-3189-3p的相对表达量。
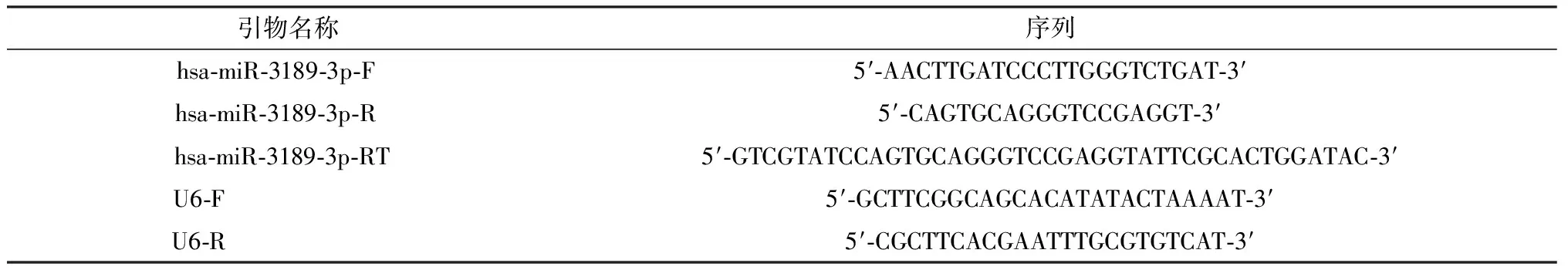
表1 引物序列
1.5Western blot法检测上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)关键蛋白表达水平 细胞转染48 h后,使用RIPA裂解液提取细胞总蛋白。按蛋白体积4∶1的比例加入5×loading buffer液,100 ℃金属加热仪上变性处理15 min。以每孔30 μg蛋白上样量进行电泳实验,初始电压为80 V,待条带至下层胶后电压调高至120 V。通过电转法(200 mA,110 min)将凝胶中的蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。用无蛋白快速封闭液封闭处理PVDF膜2 h,然后用1×TBST液清洗PVDF膜3次,10 min/次。将PVDF膜与N-cadherin、vimentin及GAPDH一抗液(1∶5 000稀释)在4 ℃条件下孵育过夜。用1×TBST液清洗PVDF膜3次,10 min/次。将PVDF膜与二抗液(1∶10 000稀释)室温条件下孵育1 h。用1×TBST液清洗PVDF膜3次,10 min/次。应用ECL超灵敏化学发光检测试剂盒进行显影处理。以GAPDH为内参计算目标蛋白的相对表达量。重复四次独立实验。
1.6细胞划痕实验 细胞转染6 h后,向6孔板内加入700 μL 0.25%胰蛋白酶,在37 ℃培养箱中孵育10 min。以1 000 r/min条件离心5 min,重悬后进行细胞计数。将划痕实验插件放入6孔板孔内,用镊子轻轻按压固定,每孔接种2×105cells后继续培养。待划痕实验插件小孔中细胞长满后拔除插件,用PBS清洗2次,每孔加1 mL无血清培养液,镜下测量细胞划痕宽度并做记录,24 h后再次记录划痕宽度。细胞迁移比例=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。重复四次独立实验。
1.7Transwell侵袭实验 在实验前1 d,向Transwell小室中加入基质胶。转染6 h后,将LOVO细胞经消化、离心、重悬处理,计数后以Opti-MEMTMI减血清培养基配制为2.5×106cells/mL的细胞悬液。向小室的上室加入200 μL LOVO细胞悬液,下室加入650 μL完全培养液。培养48 h后吸去上室Opti-MEMTMI减血清培养基,予PBS清洗2次。在小室的上室和下室分别加入200 μL、600 μL 4%组织细胞固定液,固定30 min。使用棉签轻轻擦去上室细胞,PBS冲洗2次,予0.2%结晶紫染色液染色20 min,在倒置显微镜下记录染色细胞数量。重复四次独立实验。
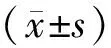
2 结果
2.1生物信息学分析结果 CancerMIRNome在线数据库分析结果显示,与正常组织相比,miR-3189-3p在肺腺癌(lung adenocarcinoma,LUAD)、结肠腺癌(colon adenocarcinoma,COAD)、胃腺癌(stomach adenocarcinoma,STAD)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、胆管癌(cholangio carcinoma,CHOL)、膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、乳腺浸润癌(breast invasive carcinoma,BRCA)、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、肝细胞癌(liver hepatocellular carcinoma,LIHC)、前列腺腺癌(prostate adenocarcinoma,PRAD)、甲状腺癌(thyroid carcinoma,THCA)、子宫体子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)等癌组织中呈高表达(P<0.05),在嗜铬细胞瘤和副神经节瘤(pheochromocytomas and paragangliomas,PCPG)组织中呈低表达(P<0.05),见图1ⓐ。CRC组织的miR-3189-3p表达水平显著高于正常组织(P<0.05),见图1ⓑ。miR-3189-3p高表达CRC患者的生存预后较低表达者更好(P<0.05),见图1ⓒ。通过ENCORI数据库数据也验证了上述miR-3189-3p与CRC的相关结果,见图2。
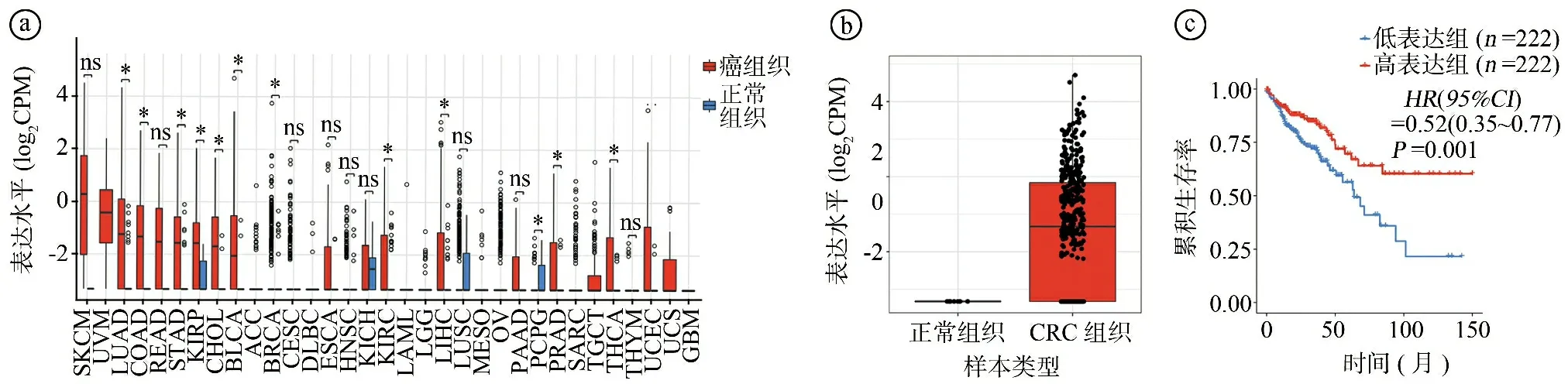
ⓐmiR-3189-3p在泛癌组织中存在差异表达,*P<0.05,ns为P>0.05;ⓑCRC组织和正常组织miR-3189-3p表达水平比较,P=0.002;ⓒmiR-3189-3p高表达与低表达CRC患者的生存曲线比较
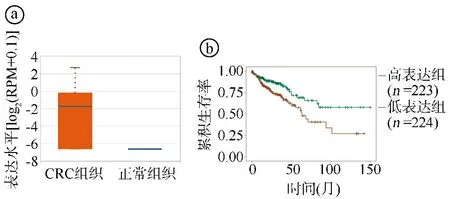
ⓐCRC组织和正常组织miR-3189-3p表达水平比较,P<0.001;ⓑmiR-3189-3p高表达与低表达CRC患者的生存曲线比较,P<0.05
2.2实验组与对照组miR-3189-3p表达水平比较 RT-qPCR实验结果显示,实验组miR-3189-3p表达水平高于对照组,差异有统计学意义(t=11.840,P=0.007),见图3。提示miR-3189-3p mimics转染成功。
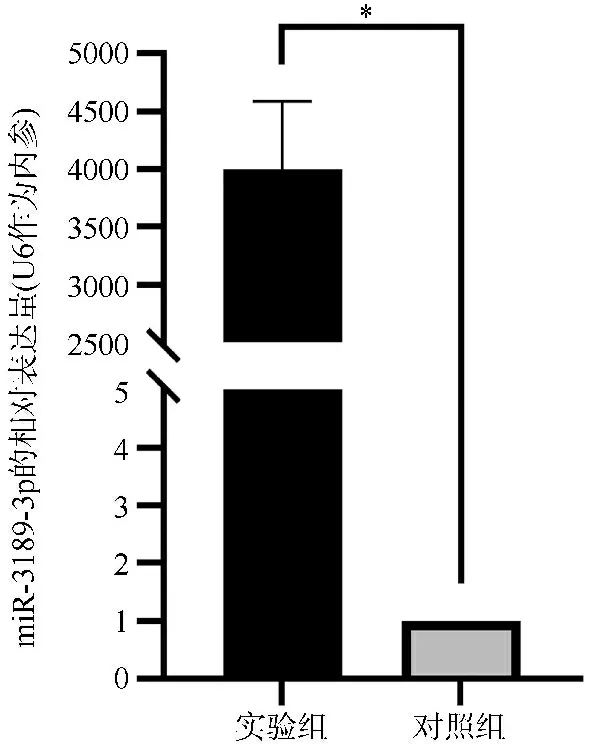
图3 实验组与对照组miR-3189-3p表达水平比较图(*P<0.05)
2.3实验组与对照组EMT关键蛋白表达水平比较
Western blot实验结果显示,实验组N-cadherin、vimentin相对表达量低于对照组,差异有统计学意义(t=7.142,P=0.006;t=3.292,P=0.046),见图4。
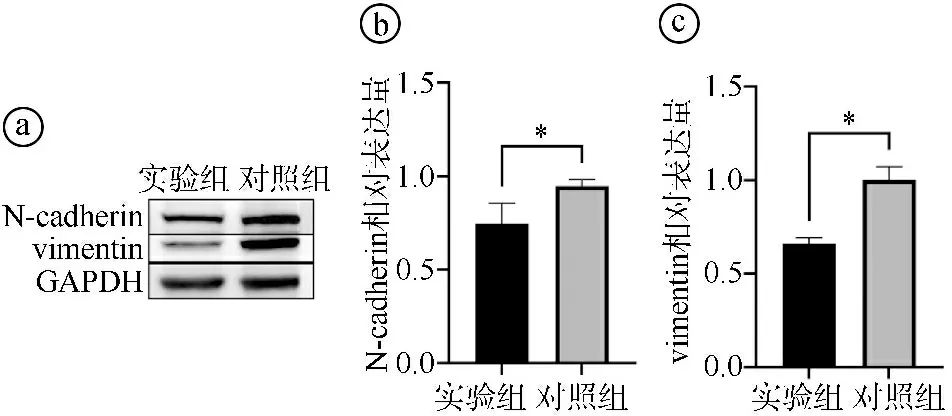
ⓐWestern blot实验结果图;ⓑ两组N-cadherin相对表达量比较(*P<0.05);ⓒ两组vimentin相对表达量比较(*P<0.05)
2.4实验组与对照组细胞迁移能力比较 划痕实验结果显示,实验组细胞迁移比例小于对照组,差异有统计学意义(t=7.266,P=0.005),见图5。
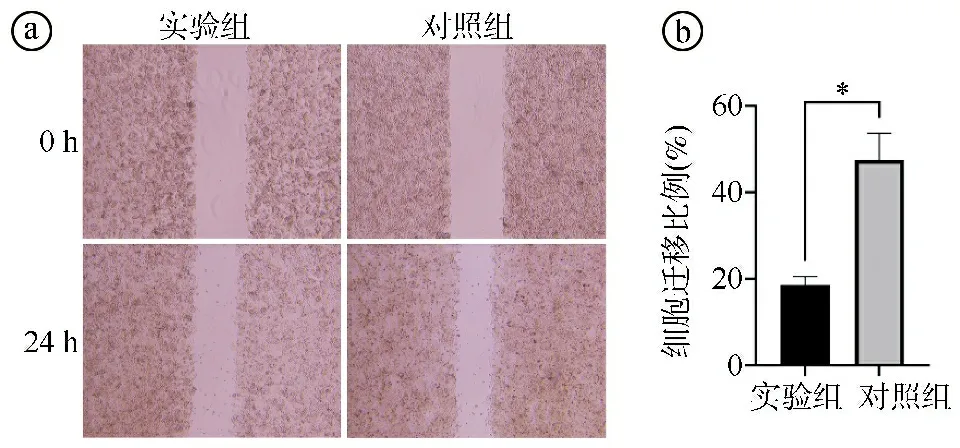
ⓐ划痕实验结果图;ⓑ两组细胞迁移比例比较(*P<0.05)
2.5实验组与对照组细胞侵袭能力比较 Transwell侵袭实验结果显示,实验组细胞侵袭数量少于对照组,差异有统计学意义(t=8.792,P=0.003),见图6。
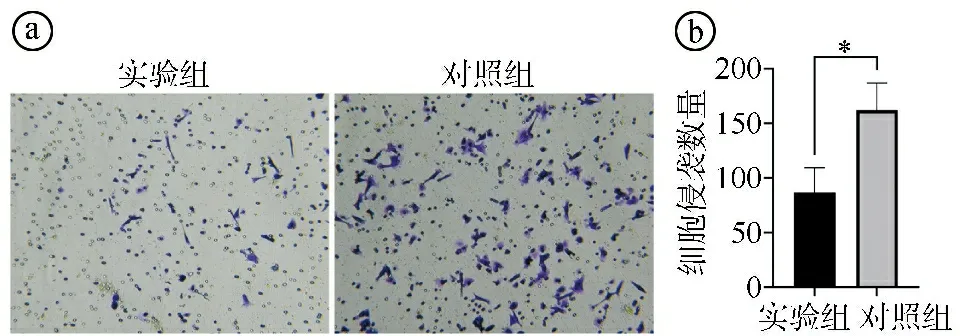
ⓐTranswell侵袭实验结果图;ⓑ两组细胞侵袭数量比较(*P<0.05)
3 讨论
3.1研究表明,CRC的发生发展与饮食、遗传等因素有关[13]。随着医疗技术的发展,越来越多的新发病例得以被发现,我国的CRC患病率正逐年增高[14]。因此,在CRC的治疗上对改善患者生存预后及生活质量等方面提出了更高的要求。miRNA是一种短分子RNA,长度一般为19~25个核苷酸,单个miRNA可以靶向多个mRNA,调节相关基因的表达,影响其功能[15]。miRNA在癌症的早期筛查中也有一定作用[16]。有研究指出miR-3189-3p是67GDF15基因嵌入产生的主要miRNA[17]。在星形细胞瘤和胶质母细胞瘤中,miR-3189-3p的表达下调,miR-3189-3p过表达可显著抑制肿瘤细胞的增殖和迁移[10,18]。此外,miR-3189在胆管癌和口腔癌中显示出潜在的诊断应用价值[19-20]。也有研究发现,miR-3189-3p可抑制胃癌细胞的糖酵解过程,并能通过调节丝切蛋白2(cofilin 2,CFL2)抑制胃癌细胞的增殖和迁移[11]。真核细胞始因子4E结合蛋白1(eukaryotic translation initiation factor 4E-binding protein 1,4EBP1)通常被认为是蛋白质翻译的抑制剂,其在癌症中常过度表达[21-22],而miR-3189-3p可通过调控4EBP1来介导骨髓细胞瘤病毒癌基因同源物(myelocytomatosis viral oncogene homolog,v-MYC)的翻译,抑制三阴性乳腺癌细胞的增殖和迁移[12]。胶质母细胞瘤是最具侵袭性的脑肿瘤之一,miR-3189-3p在胶质母细胞瘤组织中呈低表达,并可通过调控E2F家族转录因子-1(E2F transcription factor-1,E2F-1)的表达抑制细胞生长[10]。miR-3189-3p不仅在癌症中发挥重要作用,对骨关节炎也有一定影响。有研究发现,circ_0110251缓解了软骨细胞的凋亡和细胞外基质(extracellular matrix,ECM)降解,而miR-3189-3p过表达可逆转此作用[23]。
3.2EMT是一种上皮细胞在各种因素的作用下,上皮特征向间充质表型转变,并表现出对应行为的细胞过程[24]。EMT常见于各种肿瘤细胞的病理活动中,参与肿瘤的发生,并影响着肿瘤细胞的侵袭、转移等行为,且与肿瘤耐药也有一定关联[25]。miRNA在EMT相关癌症转移中也起到调节作用[26]。参与Wnt-β-连环蛋白通路的miR-504可通过下调卷曲类受体7(frizzled homolog 7,FZD7)表达来抑制多形性胶质母细胞瘤的侵袭、迁移以及EMT等行为[27]。有研究表明,miR-4319能够通过靶向叉头框Q1(forkhead box Q1,FOXQ1)基因来抑制肝细胞癌的增殖、EMT和肿瘤干性[28]。miR-145可靶向多个干细胞转录因子,研究发现其作用与CRC的EMT呈负向关系。此外,锌指转录因子1(snail homolog 1,Snail 1)可以通过抑制miR-145的表达使肿瘤细胞对放疗产生抗性[29]。也有学者发现来源于癌症相关成纤维细胞(cancer-associated fibroblast,CAF)的外泌体,其包含的miR-625-3p可通过抑制CUGBP和ETR-3样因子2(CUGBP and ETR-3-like factor 2,CELF2)/WW域的氧化还原酶基因(WW domain containing oxidoreductase,WWOX)通路促进CRC细胞的迁移、侵袭、EMT以及化疗耐药[30]。
3.3本研究基于CancerMIRNome在线数据库和ENCORI数据库分析发现miR-3189-3p在多种肿瘤中存在表达异常,且CRC组织中miR-3189-3p表达水平高于正常组织,进一步分析发现,miR-3189-3p高表达CRC患者的生存预后情况较低表达者更好。细胞实验结果也显示,过表达miR-3189-3p的LOVO细胞,其迁移和侵袭能力减弱,且对EMT存在一定的影响。提示miR-3189-3p对CRC的发生发展有重要作用,并影响患者的生存预后。关于miR-3189-3p在CRC中的调控网络值得进一步探讨。
综上所述,miR-3189-3p对CRC细胞的迁移、侵袭以及EMT有一定影响,并与患者的生存预后相关联,研究结果为CRC的诊疗技术开发提供了参考。

