气道压力释放通气通过调控ITGB4相关通路减轻ARDS肺部炎症的机制研究
马爱佳, 魏灿征,2*, 董美玲, 程江丽, 海依尔别克·阿达力, 秦艺玮,3, 薛 杨,高 慧, 赵利灿, 李建波, 周永方, 王 波, 杨 婧#, 康 焰,4
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是以肺部炎症反应、肺容积减少、顺应性降低、通气血流比例失调为主要病理生理特征的临床常见危重症[1]。迄今为止,ARDS仍缺少有效的药物治疗方法,机械通气是治疗ARDS的最有效方法之一[2-3]。小潮气量通气(low tidal volume ventilation,LTV)作为肺保护性通气策略的核心,面对ARDS患者肺部损伤的“不均一性”,在一定程度上受到气体交换和气道压的限制[4]。而气道压力释放通气(airway pressure release ventilation,APRV)可通过持续的气道高压使ARDS患者肺泡得到开放,短暂的释放通气时间避免了肺泡塌陷,在锻炼了呼吸肌的同时避免了人机不同步,理论上可以有效保护呼吸机相关性肺损伤(ventilator-induced lung injury,VILI)[5]。本团队前期临床研究显示,APRV相较于LTV可以增加ARDS患者28 d不带机时间并缩短患者住院时长[6]。动物研究结果显示,APRV机械通气模式相较于LTV机械通气模式可以有效改善ARDS后的氧合指数及肺顺应性[7-8]。然而,尽管前期结果APRV机械通气展现出一定肺保护性优势,但其改善机制目前并不明确。大量研究表明炎症介质释放在ARDS中发挥了重要作用[9-12]。因此,本研究通过巴马小型成年猪ARDS模型的测序数据与体外肺上皮细胞牵张模型,探索APRV与LTV周期性牵张刺激引起炎症反应的机制,为ARDS患者VILI的防治提供思路。
1 材料与方法
1.1实验模型及主要试剂 动物实验使用巴马小型猪(n=14,7月龄,体重25~35 kg)。通过生理盐水灌洗肺构建重度ARDS模型,应用LTV与APRV机械通气模式进行48 h机械通气治疗,分为空白对照组(control组,n=3)、疾病对照组(ARDS组,n=3)、LTV机械通气组(LTV组,n=4)以及APRV机械通气组(APRV组,n=4)。机械通气使用深圳迈瑞生物医疗电子股份有限公司生产的SV800呼吸机。细胞实验使用A549细胞系,RPMI 1640细胞培养基(美国Invitrogen Gibco,C11875500BT)及胎牛血清(美国Invitrogen Gibco,CB14808348)。应用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测动物实验肺泡灌洗液以及细胞上清液中炎症因子白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),试剂盒购自上海茁彩生物科技有限公司。Trizol试剂盒购自美国Thermo Fisher Scientific(15596026),一步法逆转录试剂盒、PCR反应试剂盒购自南京诺唯赞生物科技股份有限公司。沉默ITGB4小干扰RNA(siRNA)设计序列由山东维真生物科技有限公司设计提供,sense:GGUCACCUCCAAGAUGUUC;antisense:GAACAUCUUGGAGGUGACC。p38抑制剂购自上海碧云天生物技术股份有限公司(SB203580)。动物实验获四川大学华西医院动物伦理委员会审批(批号:2018073A)。
1.2ARDS动物模型建立 采用生理盐水灌洗肺构建重度ARDS猪模型。准备37 ℃生理盐水约3 000 mL,肺泡灌洗从左到右,从上至下,依次灌洗肺段。经支气管镜快速注射,每个肺段灌注10~50 mL生理盐水,完成后吸出灌洗液,肺泡灌洗液回收率应达到灌入总液体的50%~60%。肺泡灌洗后每30 min进行动脉血气分析,氧合指数[氧分压(partial pressure of oxygen,PaO2)/吸氧浓度(fraction of inspired oxygen,FiO2)]≤100并稳定维持30 min,即为造模成功。若氧合指数未能达到标准,则根据肺泡灌洗液回收率再次灌注10~50 mL生理盐水,并在30 min后进行动脉血气检测,直至氧合指数达到标准。
1.3机械通气初始参数设置及调节 重度ARDS模型构建成功后,LTV组和APRV组分别进行48 h的LTV、APRV机械通气支持。LTV组应用容量控制的辅助/控制(assisted/control-volume control ventilation,A/C-VCV)通气模式,潮气量6 mL/kg,呼吸频率14~16次/min,根据ARDSnet推荐的higher呼吸末正压(positive end-expiratory pressure,PEEP)/lower FiO2表格依次调整PEEP和FiO2[13],维持平台压≤30 cmH2O。APRV组根据A/C-VCV通气模式时所测得的力学指标进行APRV参数设置,若平台压≤30 cmH2O,Phigh=平台压;若平台压>30 cmH2O,Phigh=30 cmH2O,Plow=5 cmH2O,初始释放频率为10~14次/min,Tlow=1~1.5倍时间常数。
1.4差异mRNA筛选及靶基因预测 ARDS组、LTV组、APRV组经肺动脉持续灌注肺组织后,根据猪的解剖学结构,于右上、中、下肺的前、中、后段随机取10块肺组织。鉴于前期研究病理学结果显示,右肺下叶肺部损伤严重[8],本研究取右肺下叶后段组织进行转录组高通量测序。测序结果通过国家生物技术信息中心(National Center for Biotechnology Information,NCBI)参考基因组版本GCF_000003025.6_Sscrofa11.1进行比对。使用R软件“limma”包筛选差异基因,差异倍数绝对值>1.5且P值<0.05,从中筛选出与机械应力相关靶基因。使用R软件“clusterProfiler”软件包,对差异基因进行KEGG与GO富集分析,筛选出与机械应力相关基因的通路及生物功能,adjustedP<0.05,Q<0.05的通路被视为显著富集。
1.5细胞牵张仪LTV样牵张与APRV样牵张模式设定 通过细胞牵张仪模拟建立体外APRV样牵张及LTV样牵张模型。将A549细胞接种至细胞牵张膜,LTV样牵张4 h,牵张幅度为12.5%,牵张回复时间0.8 s,复位时间0.8 s;牵张时间0.8 s,牵张维持时间0 s。将A549细胞接种至细胞牵张膜,APRV样牵张4 h,牵张幅度为12.5%,牵张回复时间0.8 s,复位时间0 s;牵张时间0.8 s,牵张维持时间2.15 s。
1.6ELISA检测炎症因子IL-1、IL-6、IL-8、TNF-α含量 将IL-1、IL-6、IL-8、TNF-α抗体包被于96孔微孔板。制备不同浓度的标准品,将不同浓度的标准品和同一体积的肺泡灌洗液或细胞上清液加入到对照孔和样本孔中。每孔加入检测抗体,密封平板并在室温下孵育1 h。用1×ELISA抗体稀释液稀释抗生物素蛋白-HRP连接的荧光二抗,密封平板并在室温下孵育30 min。每孔加入1×TMB溶液,在室温下孵育15 min,随即每孔加入终止液。在450 nm读取OD值,使用平均OD确定标准曲线方程和计算实验样品中蛋白的浓度。
1.7逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测IL-1、IL-6、IL-8、TNF-α mRNA表达水平 使用Trizol法从肺组织和A549细胞中提取总RNA,采用逆转录试剂盒一步合成法合成cDNA,逆转录完成后进行PCR扩增,PCR反应体系如下:SYBR Green Supermix 10 μL,无酶核酸水7.2 μL,引物0.8 μL,cDNA 2 μL;将样本放入实时荧光定量仪上进行反应后,导出实验结果,以18 s为内参,使用2-ct法计算出结果并在Prism 9.0中进行结果绘图。
1.8蛋白免疫印迹实验(Western blot,WB)检测肺组织及细胞的ITGB4、FAK、FAK磷酸化(p-FAK)、p38、p38磷酸化(p-p38)、β-tubulin蛋白表达水平 用细胞刮刀收集1×106个细胞。若为组织,则将组织匀浆研磨至粉末,向其中加入含蛋白酶抑制剂的RIPA裂解液,冰上裂解1 h,14 000 r/min、4 ℃离心20 min,取上清液制备蛋白样品。使用SDS-PAGE胶进行电泳,转膜,封闭后滴加一抗(1∶1 000)4 ℃孵育过夜。将膜置于稀释的二抗(1∶4 000)中室温孵育2 h后显影。
1.9统计学方法 应用SPSS 23.0统计软件进行数据分析。应用GraphPad Prism 6.0进行作图。两组间比较采用成组t检验。多组间比较采用单因素方差分析,以LSD-t检验进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1APRV相较于LTV显著改善重度ARDS炎症
ELISA检测结果显示,在造模前(T0)、造模成功(T1),APRV组与LTV组肺泡灌洗液IL-1、IL-6、IL-8、TNF-α水平比较差异无统计学意义(P>0.05)。通气48 h(T2),APRV组IL-6、IL-8水平显著低于LTV组(P<0.05),两组IL-1、TNF-α水平差异无统计学意义(P>0.05),见图1。与control组比较,ARDS组、LTV组肺组织IL-1、IL-6 mRNA表达水平显著升高(P<0.05);ARDS组肺组织IL-1、IL-6、IL-8 mRNA表达水平显著低于LTV组(P<0.05),APRV组肺组织IL-6、IL-8 mRNA表达水平显著低于LTV组(P<0.05)。control组、ARDS组、LTV组与APRV组肺组织中TNF-α mRNA表达水平比较差异无统计学意义(P>0.05),见图2。
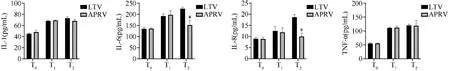
图1 LTV组与APRV组不同时间点肺泡灌洗液炎症因子表达水平比较图(*P<0.05)
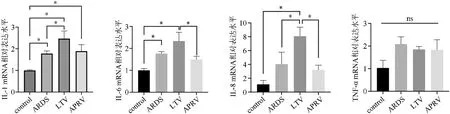
图2 四组肺组织炎症因子mRNA表达水平比较图(*P<0.05,ns为P>0.05)
2.2机械通气过程中ITGB4-FAK-p38-MAPK通路显著激活 选取ARDS组、LTV组及APRV组猪肺组织进行转录组高通量测序。以差异倍数2倍以上,P<0.05为界筛选差异基因。对非共同差异基因进行KEGG富集分析,结果显示在细胞外基质受体交互通路(ECM-receptor interaction)与黏着斑(focal adhesion)信号通路显著富集(见图3ⓐ)。对非共同差异基因进行GO富集分析,结果显示在细胞黏附(cell adhesion)与细胞基质黏附(cell-matrix adhesion)过程显著富集。GO富集分析发现丝裂原活化蛋白激酶活化过程(activation of MAPK activity)与整合素介导的信号通路(integrin-mediated signaling pathway)显著富集(见图3ⓑ)。对细胞外基质受体交互通路与黏着斑信号通路差异基因作聚类热图(见图3ⓒ),ITGB4为显著差异基因之一。通过WB检测验证control组、ARDS组、LTV组、APRV组猪肺组织中ITGB4、FAK、p38、p-FAK、p-p38蛋白表达水平。结果显示,ARDS组ITGB4、p-FAK、FAK、p-p38、p38蛋白表达水平均较control组显著升高(P<0.05)。LTV组ITGB4蛋白表达水平(1.08±0.04)与APRV组(0.74±0.05)存在显著差异(P<0.05)。APRV组p-FAK蛋白表达水平显著低于LTV组(P=0.043)。尽管LTV组与APRV组p38蛋白表达水平差异无统计学意义(P>0.05),但LTV组p-p38蛋白表达水平(1.08±0.10)相较于APRV组(0.80±0.11)显著升高(P=0.049),见图4。
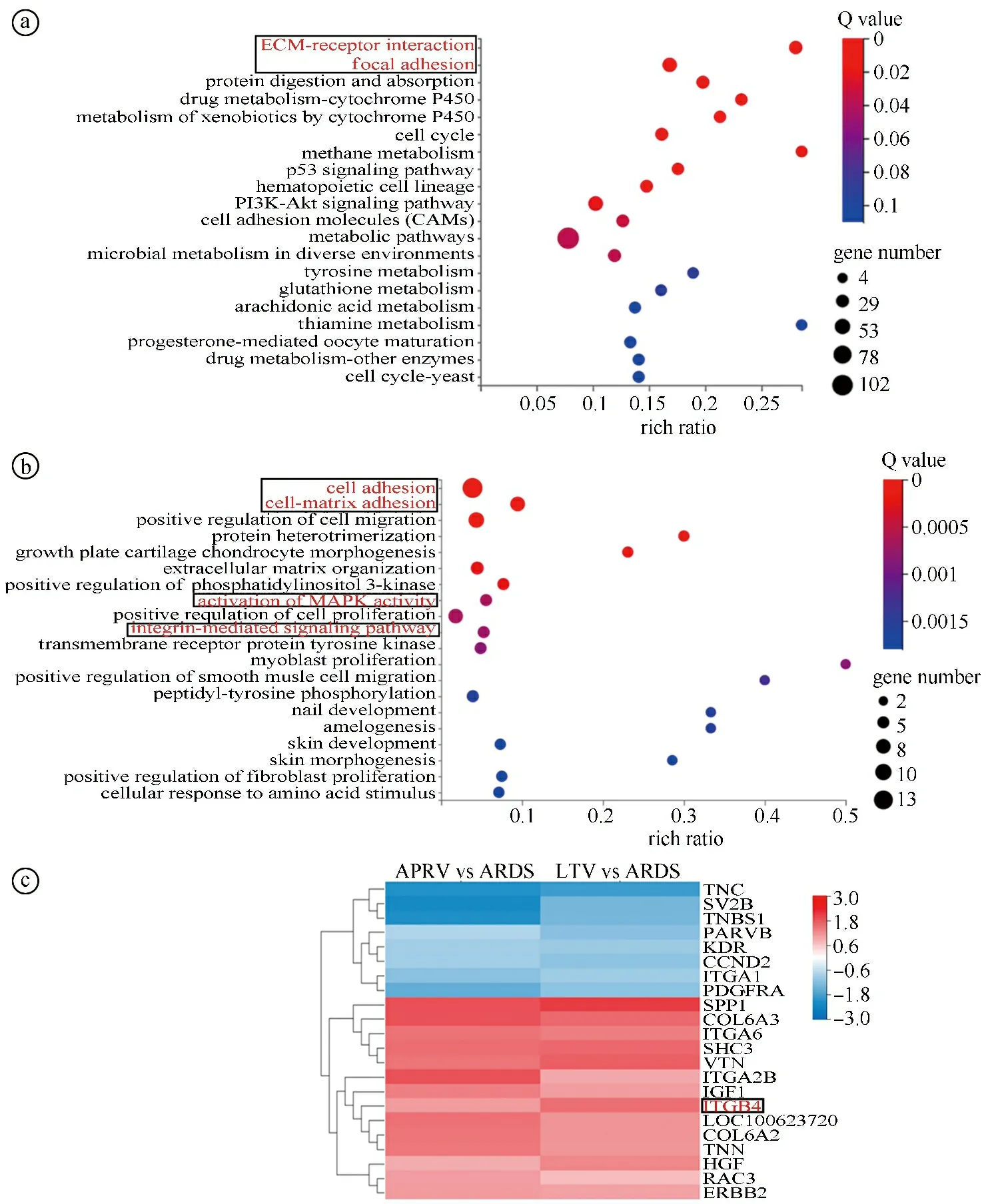
ⓐKEGG信号通路富集气泡图;ⓑGO生物过程富集气泡图;ⓒ细胞外基质受体交互通路与黏着斑信号通路差异基因聚类热图
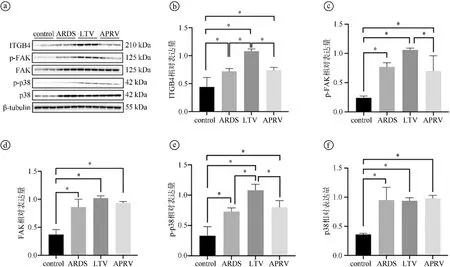
ⓐcontrol组、ARDS组、LTV组和APRV组肺组织蛋白表达灰度图;ⓑ~ⓕITGB4、p-FAK、FAK、p-p38、p38蛋白表达统计图。*P<0.05
2.3体外模拟LTV与APRV模式牵张对肺上皮细胞炎症的影响 ELISA检测A549细胞经APRV与LTV样牵张后细胞上清液中IL-6、IL-8水平结果显示,三组IL-6水平比较差异无统计学意义(P>0.05),而APRV组IL-8表达水平[(68.94±5.84)pg/mL]显著低于LTV组[(107.4±3.16)pg/mL](P<0.001),见图5ⓐⓑ。RT-PCR检测结果显示,与control组(1.00±0.09)相比,LTV组(1.25±0.34)与APRV组(1.26±0.34)IL-6 mRNA表达水平稍有升高,但差异无统计学意义(P>0.05)。LTV组(1.95±0.22)、APRV组(1.55±0.16)IL-8 mRNA表达水平显著高于control组(1.00±0.05),APRV组显著低于LTV组(P=0.049),见图5ⓒⓓ。
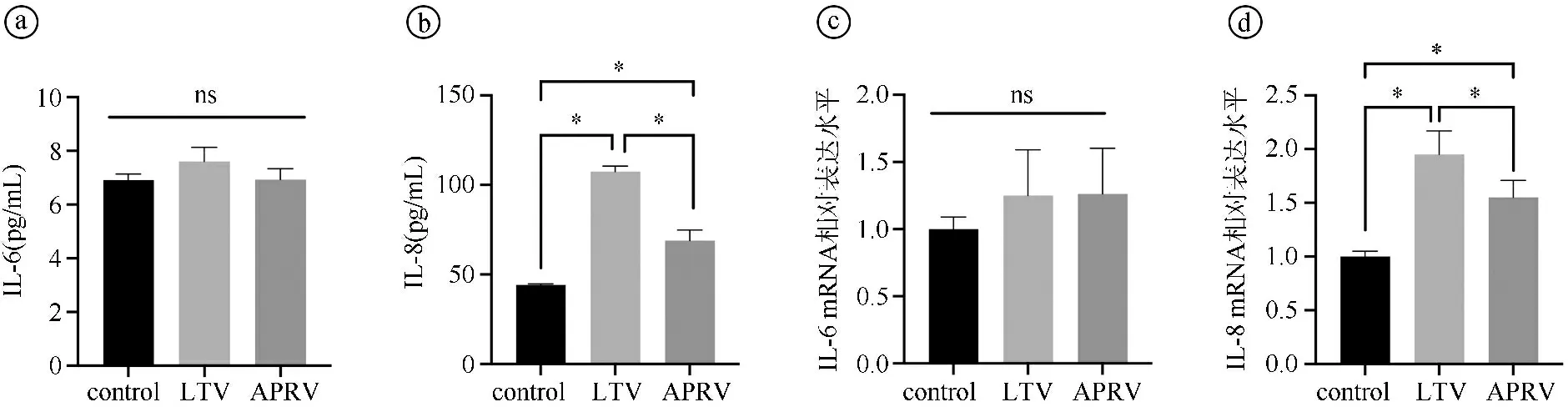
ⓐⓑA549细胞牵张6 h后细胞上清液IL-6和IL-8表达水平;ⓒⓓA549细胞牵张6 h后细胞IL-6和IL-8 mRNA表达水平。*P<0.05,ns为P>0.05
2.4体外模拟LTV与APRV模式牵张对ITGB4-FAK-p38-MAPK通路的影响 WB检测control组、LTV样牵张、APRV样牵张对A549细胞ITGB4、FAK、p38、p-FAK、p-p38蛋白表达水平的影响。LTV组(0.95±0.07)ITGB4蛋白表达水平显著高于control组(0.25±0.16)(P<0.001)与APRV组(0.62±0.07)(P=0.024)。APRV组(0.73±0.09)p-FAK蛋白表达水平显著低于LTV组(1.04±0.06)(P=0.046)。APRV组与LTV组的FAK和p38蛋白表达水平差异不显著(P>0.05)。LTV组(1.09±0.11)p-p38蛋白表达水平显著高于control组(0.34±0.09)(P<0.001)及APRV组(0.62±0.13)(P=0.046),见图6。
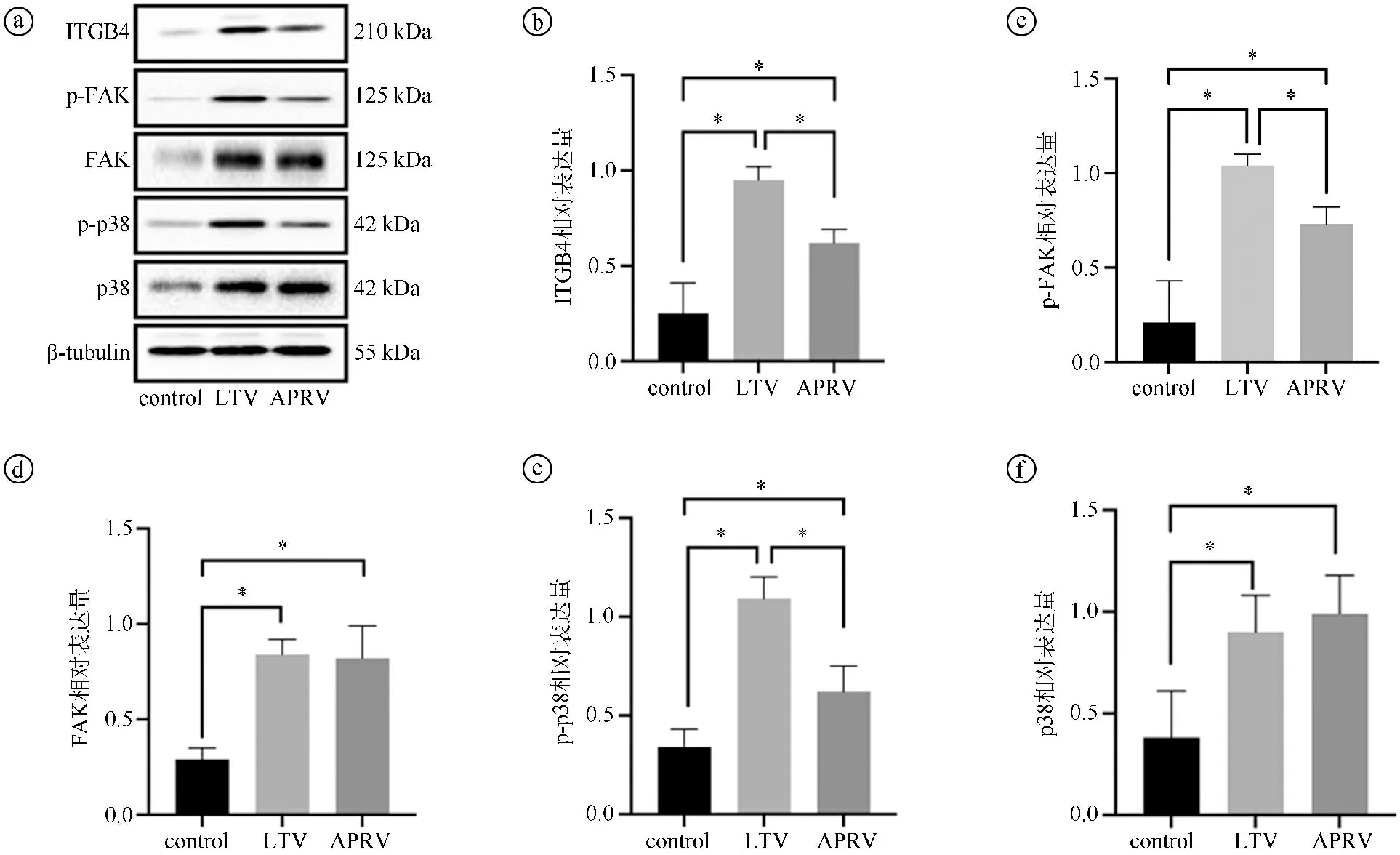
ⓐ蛋白表达灰度图;ⓑ~ⓕITGB4、p-FAK、FAK、p-p38、p38蛋白表达统计图。每组样本量n=3。*P<0.05
2.5ITGB4沉默对ITGB4-FAK-p38-MAPK-IL-8通路的影响 使用siRNA沉默ITGB4的表达,实验分组为细胞未牵张对照组(control组)、细胞未牵张并使用siRNA干扰组(control+siRNA组)、细胞LTV样牵张组(LTV组)、细胞APRV样牵张组(APRV组)、细胞LTV样牵张并使用siRNA干扰组(LTV+siRNA组)、细胞APRV样牵张并使用siRNA干扰组(APRV+siRNA组)。WB检测各组ITGB4、FAK、p38、p-FAK、p-p38蛋白表达水平。结果显示,沉默ITGB4可显著下调LTV+siRNA组p-FAK和p-p38蛋白表达水平(P<0.05),FAK蛋白与p38蛋白在ITGB4沉默后无明显差异(P>0.05)。尽管ITGB4沉默降低LTV+siRNA组ITGB4相关通路的磷酸化水平,但仍高于APRV+siRNA组。沉默ITGB4后,APRV+siRNA组ITGB4相关通路磷酸化水平降至control组水平,见图7ⓐ~ⓕ。ELISA检测细胞上清液中IL-8水平,结果显示,沉默ITGB4可显著降低LTV+siRNA组及APRV+siRNA组细胞上清液IL-8水平(P<0.05)。鉴于LTV组样牵张后IL-8水平上调明显,沉默ITGB4下调IL-8水平尤为显著。APRV+siRNA组在ITGB4沉默后,IL-8水平降至control组水平。APRV+siRNA与LTV+siRNA组差异无统计学意义(P>0.05),见图7ⓖ。
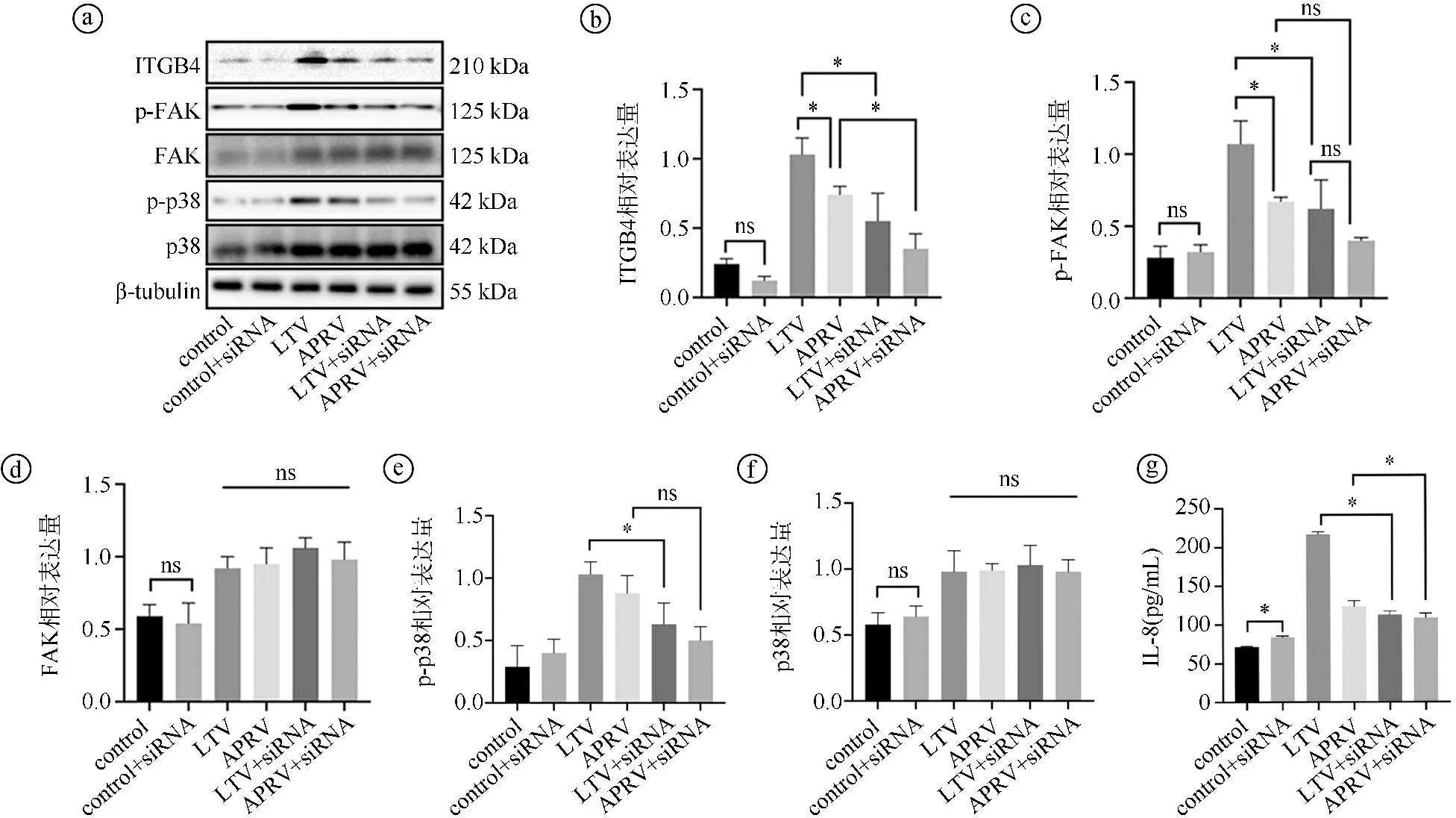
ⓐ蛋白表达灰度图;ⓑ~ⓕITGB4、p-FAK、FAK、p-p38、p38蛋白表达统计图;ⓖELISA检测细胞上清液IL-8水平。每组样本量n=3。*P<0.05,ns为P>0.05
2.6p38抑制剂对LTV和APRV样牵张后炎症因子的影响 为验证p-p38与不同机械通气模式IL-8表达水平的关系,对不同牵张模式下A549细胞使用p38抑制剂(SB203580),观察其炎症因子改变。实验分组为细胞未牵张对照组(control组)、细胞未牵张并使用SB203580组(control+SB203580组)、细胞LTV样牵张组(LTV组)、细胞APRV样牵张组(APRV组)、细胞LTV样牵张并使用SB203580组(LTV+SB203580组)、细胞APRV样牵张并使用SB203580组(APRV+SB203580组)。使用p38抑制剂后,LTV+SB203580组和APRV+SB203580组p38水平相较于LTV组和APRV组均无显著差异(P>0.05)。使用p38抑制剂后,APRV+SB203580组p-p38蛋白表达水平相较于LTV+SB203580组显著下调(P=0.032),见图8ⓐ~ⓒ。ELISA检测各组细胞培养液中IL-8水平,应用p38抑制剂后,APRV+SB203580组和LTV+SB203580组中IL-8水平相较于LTV组和APRV组显著降低(P<0.05)。鉴于LTV组样牵张分泌更高的IL-8水平,LTV+SB203580组IL-8水平降低更为明显,APRV+SB203580组和LTV+SB203580组差异无统计学意义(P=0.973),见图8ⓓ。RT-PCR检测各组A549细胞IL-8 mRNA表达水平,其结果与ELISA检测结果一致,见图8ⓔ。

ⓐ蛋白表达灰度图;ⓑⓒp-p38、p38蛋白表达统计图;ⓓⓔp38抑制剂对细胞培养液中IL-8水平及细胞内IL-8 mRNA表达水平的影响。每组样本量n=3。*P<0.05,ns为P>0.05
3 讨论
3.1本研究使用大型动物猪构建重度ARDS实验模型,并随机分组维持48 h的APRV或LTV机械通气。相较于LTV组,APRV组肺泡灌洗液IL-6、IL-8水平以及ITGB4、p-FAK、p-p38蛋白表达水平显著降低。另外,研究构建了A549细胞体外LTV样及APRV样牵张模型。结果显示,与LTV样牵张相比,APRV样牵张通过p38-MAPK信号通路下调ITGB4,减少IL-8分泌。在ARDS的机械通气支持过程中,靶向ITGB4-p38-MAPK信号通路可能是一种有前景的治疗策略。
3.2机械通气对于维持ARDS患者氧合及机体稳态至关重要。APRV在持续气道正压的基础上,通过高压与低压之间形成压力差以周期性地释放进行肺通气,并允许自主呼吸的存在。其持续的气道高压给予塌陷肺泡以支持,使得肺泡充分开放。动脉血氧分压是机械通气治疗的重要指标,其对应的氧合指数是ARDS的诊断标准及严重程度的分级标准。本课题组前期研究结果显示,APRV机械通气模式相较于LTV机械通气模式能更好地改善氧合、肺顺应性以及肺通透性,从而减少肺部损伤[6-8]。Roy等[14-16]的多个动物实验以及近期的3项临床试验荟萃分析[17-19]都得到了相同的结论。
3.3炎症因子在ARDS发生发展过程中极其重要,是VILI的关键节点。与LTV相比,APRV对炎症因子的作用尚存在争议,本研究结果为此提供了新的证据。本实验中,IL-1、IL-6、IL-8、TNF-α水平在造模成功后显著升高。APRV的机械通气模式相较于LTV机械通气模式可以有效控制早期肺泡灌洗液及肺组织IL-1、IL-6、IL-8水平。IL-8是中性粒细胞的激活和趋化因子,增强中性粒细胞和单核细胞向肺的募集[20],导致持续炎症反应。隆云等[21]研究发现LTV通气后第3天至第7天血浆IL-8水平显著升高,于第3天达到高峰。与大潮气量通气或常规潮气量通气相比,LTV可降低IL-6、IL-8水平,且患者预后更好[22-23],提示IL-6、IL-8是与VILI密切相关的炎症因子。而与LTV相比,Roy等[16]的研究发现APRV显著降低肺泡灌洗液IL-6水平。Kubiak等[24]的研究发现APRV显著降低肺泡灌洗液IL-8水平,这与本研究结果一致,提示APRV可以比LTV更好地保护肺脏。
3.4机械通气对肺泡上皮细胞产生周期性机械牵张刺激,导致细胞内信号通路活化,引起细胞因子合成和释放,促进肺部炎症反应,是ARDS机械通气所致肺炎症损伤的重要环节[25]。气道上皮细胞通过紧密的细胞间连接和在基底膜上的黏附形成对环境有害刺激的屏障。整合素在上皮细胞的黏附、组织修复和维持细胞稳态等功能上起着重要作用,其表达水平在多种疾病中具有指导预后的临床意义[26-27]。在上皮细胞与基底膜的黏附中,ITGB4尤其重要,这种整合素具有独特的长细胞质尾巴,可促进细胞核内小体的装配[28]。机械损伤肺上皮细胞后ITGB4的表达增加,ITGB4的上调促进了肺泡上皮细胞创伤修复能力和抗氧化能力[29]。周期性过度牵张肺泡内皮细胞可通过ITGB4促进IL-6、IL-8表达。在心肌细胞中,机械牵张引起p-FAK,激活p38-MAPK,促进炎症反应。在人类正常胸腺上皮细胞中,ITGB4-p38-MAPK信号通路可调节IL-6表达[12]。抑制小鼠肺p38-MAPK表达在大潮气量机械通气中具有肺保护作用[30]。周期性牵张可诱导气道上皮细胞p38-MAPK磷酸化,并增加IL-8的分泌[31]。在本研究中,ITGB4、p-FAK、p-p38蛋白表达水平在ARDS造模后显著增加,且LTV组的增加更为明显,高于ARDS组和APRV组。本研究结果及多项研究证实,LTV组比APRV组有更重的病理损伤,机体可能通过代偿机制上调ITGB4来对抗损伤,修复肺组织。上调的ITGB4又将细胞外基质与细胞间的机械信号转导至细胞内,引起p-FAK,激活p38-MAPK信号通路,增加了IL-6、IL-8的分泌,加重了LTV组的炎症反应。
综上所述,APRV机械通气模式通过ITGB4-p38-MAPK通路显著改善重度ARDS后炎症因子IL-8的分泌,可能为ARDS治疗提供潜在的干预靶点。

