FIRST简易版虚弱评估量表评分在新诊断多发性骨髓瘤患者中的应用价值分析
姚 琼, 王鑫炜, 杨 慧, 李林宇, 赵 洁, 贺少龙, 田卫伟
作者单位:1.山西医科大学,太原 030000;2.山西医科大学第三医院(山西白求恩医院 山西医学科学院 同济山西医院)血液内科,太原 030032
多发性骨髓瘤(multiple myeloma,MM)是一种单克隆浆细胞异常增殖的恶性疾病,主要见于老年人,目前仍无法治愈。患者确诊时中位年龄为63~70岁[1-3],超过30%的患者年龄大于75岁[4]。约有三分之二的MM患者处于不同程度的虚弱状态,至少40%的患者处于重度虚弱状态[5]。评估患者的虚弱情况,对于为其选择合适的化疗方案至关重要。国际骨髓瘤工作组(International Myeloma Working Group,IMWG)虚弱评估量表是临床应用最早且广泛的虚弱评估方法[6]。然而,由于IMWG虚弱评估量表需要评估患者日常活动能力、工具性日常生活活动能力以及查尔森合并症指数(Charlson comorbidity index,CCI),需要花费的时间长,在临床实际工作中适用性有限[7]。Facon等[8]在2020年基于FIRST临床研究,将日常活动能力和工具性日常生活活动能力评估调整为东部肿瘤协作组体能状态(Eastern Cooperative Oncology Group performance status,ECOG PS)评分,提出FIRST简易版虚弱评估量表,使评估指标精简,评估时间缩短,并能有效对患者的虚弱情况进行分层[9]。本研究旨在探讨FIRST简易版虚弱评估量表评分在新诊断多发性骨髓瘤(newly diagnosed multiple myeloma,NDMM)中的应用价值,旨在为临床医师使用该量表提供参考。
1 资料与方法
1.1临床资料 回顾性分析2014年7月1日至2021年12月31日山西医科大学第三医院收治的131例NDMM患者的临床资料。收集患者年龄、性别、CCI、ECOG PS评分、国际分期系统(International Staging System,ISS)评分[10]、乳酸脱氢酶、血红蛋白、血小板、肌酐、血钙、细胞遗传学风险分层[11]、诱导方案、治疗期间疗效、累积早期≥3级感染发生率、早期死亡率(1年内)和生存情况等资料。本研究获山西医科大学第三医院医学伦理委员会批准(批号:YXLL-2023-109)。
1.2纳入与排除标准 纳入标准:(1)符合《中国多发性骨髓瘤诊治指南(2020年修订)》中关于MM的诊断标准[12]。(2)新诊断的MM患者。(3)患者住院期间需要开始系统应用一线治疗,接受至少1个周期化疗方案。(4)病历资料完整。排除标准:(1)失访。(2)患者及其家属未能配合治疗、检查及随访。(3)入院时间不足24 h。
1.3FIRST简易版虚弱评估量表评分方法 对NDMM患者进行赋值:年龄≤75岁赋值0分,76~79岁赋值1分,≥80岁赋值2分;CCI≤1赋值0分,>1赋值1分;ECOG PS 0级赋值0分,1级赋值1分,≥2级赋值2分。上述指标分数总和0分者13例,1分者68例,共81例纳作非虚弱组,≥2分者50例纳作虚弱组[8]。
1.4治疗方案和疗效评估 所有患者接受新药为基础的联合治疗方案[12-16]。包括硼替佐米+地塞米松,硼替佐米+来那度胺+地塞米松,硼替佐米+环磷酰胺+地塞米松,来那度胺+地塞米松,硼替佐米+多柔比星脂质体+地塞米松,硼替佐米+沙利度胺+地塞米松,多柔比星脂质体+长春地辛+地塞米松+沙利度胺,伊沙佐米+地塞米松,伊沙佐米+来那度胺+地塞米松,沙利度胺+地塞米松,沙利度胺+环磷酰胺+地塞米松。无移植禁忌证的患者,根据国内指南[12-16]推荐进行自体造血干细胞移植。疗效根据IMWG标准[17]进行评估,分为严格意义的完全缓解、完全缓解、非常好的部分缓解(very good partial response,VGPR)、部分缓解、微小缓解、疾病稳定和疾病进展。
1.5感染诊断标准 根据患者临床表现、典型感染影像学表现或从有临床症状患者的外周血或分泌物中分离出微生物来诊断感染[18]。根据美国卫生及公共服务部国家癌症研究所发布的常见不良事件评价标准版本5.0对感染进行分级:3级感染定义为需要静脉注射抗生素(抗真菌或抗病毒药物治疗)或者需要接受侵入性治疗;4级感染定义为危及生命或需要紧急治疗;5级感染为死亡。NDMM早期感染定义为在治疗过程中前4个月内发生的感染[19]。
1.6随访 通过医院信息系统、电话和微信等方式进行随访。早期死亡定义为从确诊之日至1年内因任何原因死亡。总生存(overall survival,OS)时间定义为自确诊之日至末次随访或死亡时间。无进展生存(progression-free survival,PFS)时间定义为从诊断之日开始至首次疾病进展或死亡的时间。随访截至2022年12月31日。

2 结果
2.1两组临床特征比较 与非虚弱组相比,虚弱组年龄较大,CCI评分>1分、ECOG PS评分≥2分的人数比例更大,联合治疗使用≥3种药物、接受自体移植的人数比例较小,差异有统计学意义(P<0.05),见表1。
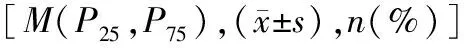
表1 两组临床特征比较
2.2两组早期≥3级感染发生情况比较 53例(40.46%,53/131)患者在早期发生≥3级感染,其中虚弱组发生26例(52.00%,26/50),非虚弱组发生27例(33.33%,27/81)。与非虚弱组相比,虚弱组早期≥3级感染相关预后更差(log-rank检验:χ2=4.472,P=0.020),见图1。

图1 两组早期≥3级感染发生情况比较图
2.3两组OS、PFS情况比较 虚弱组和非虚弱组分别有10例和6例在1年内发生死亡,虚弱组中位OS时间短于非虚弱组(36个月 vs 81个月),非虚弱组OS情况显著优于虚弱组(log-rank检验:χ2=8.413,P=0.003)];虚弱组中位PFS时间短于非虚弱组(16个月 vs 34个月),非虚弱组PFS情况显著优于虚弱组(log-rank检验:χ2=24.600,P<0.001)];对于未行自体移植的患者,虚弱组中位OS时间短于非虚弱组(34个月 vs 60个月),非虚弱组OS情况显著优于虚弱组(log-rank检验:χ2=5.936,P<0.015);虚弱组中位PFS时间短于非虚弱组(15.5个月 vs 30个月),非虚弱组PFS情况显著优于虚弱组(log-rank检验:χ2=16.170,P<0.001);见图2。由于虚弱组自体移植患者只有2例,统计意义不佳,故未针对自体移植患者进行组间OS和PFS预后分析。
图2 两组OS、PFS时间比较图
2.4接受硼替佐米为基础诱导方案的亚组分析结果
2.4.1 接受硼替佐米为基础诱导方案亚组的临床特征比较 共100例NDMM患者接受硼替佐米为基础诱导方案治疗,以虚弱发生情况分亚组:虚弱组38例,非虚弱组62例。与非虚弱组相比,虚弱组年龄较大,CCI评分>1分、ECOG PS评分≥2分的人数比例更大,联合治疗使用≥3种药物、接受自体移植的人数比例较小,差异有统计学意义(P<0.05),见表2。
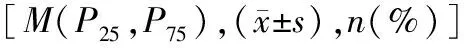
表2 接受硼替佐米为基础诱导方案亚组的临床特征比较
2.4.2 接受硼替佐米为基础诱导方案亚组的早期≥3级感染发生情况比较 对于接受硼替佐米为基础诱导方案治疗的患者,虚弱组和非虚弱组分别有20例(52.63%)和20例(32.26%)在早期发生≥3级感染。与非虚弱组相比,虚弱组早期≥3级感染相关预后更差(log-rank检验:χ2=4.075,P=0.030),见图3。
图3 接受硼替佐米为基础诱导方案亚组的早期≥3级感染发生情况比较图
2.4.3 接受硼替佐米为基础诱导方案亚组的OS、PFS情况比较 虚弱组和非虚弱组分别有8例和5例在1年内发生死亡。虚弱组中位OS时间短于非虚弱组(34个月 vs 84个月),非虚弱组OS情况优于虚弱组(log-rank检验:χ2=14.040,P<0.001);虚弱组中位PFS时间短于非虚弱组(15个月 vs 33个月),非虚弱组PFS情况优于虚弱组(log-rank检验:χ2=27.460,P<0.001);对于未行自体移植的患者,虚弱组中位OS时间短于非虚弱组(28个月 vs 84个月),非虚弱组OS情况显著优于虚弱组(log-rank检验:χ2=11.120,P<0.001);虚弱组中位PFS时间短于于非虚弱组(14.5个月 vs 30个月),非虚弱组PFS情况显著优于虚弱组(log-rank检验:χ2=19.710,P<0.001);见图4。由于虚弱组接受自体移植者只有2例,统计意义不大,故未针对自体移植患者进行组间OS和PFS预后分析。

图4 接受硼替佐米为基础诱导方案亚组的OS、PFS时间比较图
3 讨论
3.1目前,MM患者的虚弱状态已成为研究的热点,虚弱评分工具在治疗方案选择、预后和生存情况方面起着关键作用。通过对NDMM患者进行虚弱评分,能更早地发现患者的虚弱状况,有助于及时采取干预措施,提高患者生活质量[20]。因此,在MM的分层治疗中,选择简便、易操作的虚弱评估工具有重要的临床意义。本文旨在探讨FIRST简易版虚弱评估量表在NDMM中的应用价值。结果提示,FIRST简易版虚弱评估量表评分在≥3级感染事件发生、OS、PFS等方面均有较高的预测价值。在临床实践中,医师可以考虑将FIRST简易版虚弱评估量表评分作为评估NDMM患者健康状况和预测感染风险的有效工具。
3.2目前最常使用的MM虚弱评估工具是IMWG虚弱评估量表和修订版骨髓瘤共病指数(revised-myeloma comorbidity index,R-MCI)[6,21]。但这些评估工具使用耗时较长,在临床实际工作中的适用性不强。Facon等[8]基于3期FIRST(MM-020)临床试验提出了FIRST简易版虚弱评估量表评分方法,发现虚弱患者的生存预后更差。Stege等[22]基于临床研究数据也验证了FIRST简易版虚弱评估量表的应用价值,同样发现虚弱组患者的生存预后较非虚弱组更差。以硼替佐米为基础方案是目前在NDMM中广泛使用的诱导治疗方案[23]。但在Facon等[8]和Stege等[22]的研究中,大多数是基于免疫调节药物来那度胺为基础的方案进行诱导治疗,因此有必要进一步探讨FIRST简易版虚弱评估量表在接受以硼替佐米为基础的诱导治疗方案患者中的应用价值。本研究结果显示,在接受以硼替佐米为基础诱导治疗的患者中,虚弱组患者的OS及PFS情况均较非虚弱组更差,提示FIRST简易版虚弱评估量表是一个可靠且有应用价值的风险评估工具。
3.3与Facon等[8]和Stege等[22]研究不同,本研究虚弱组患者中位OS、PFS时间更短,考虑与不同临床研究的纳入、排除标准差异有关。本研究中部分患者接受了自体造血干细胞移植,而上述两项研究纳入的研究对象均为非移植患者。对于虚弱患者,临床往往推荐使用双药联合治疗方案以避免给患者带来更大的毒性和不良反应[24],但也有学者认为更强化的治疗对于虚弱患者并不一定是有益的[20]。近期的一项回顾性研究结果显示,接受硼替佐米、来那度胺和地塞米松三药联合治疗方案的虚弱患者较接受来那度胺和地塞米松两药联合治疗方案者有更好的获益[25]。鉴于FIRST简易版虚弱评估量表评分在临床实践中对虚弱患者有很好的区分作用,有必要开展前瞻性的临床研究探讨该评分方法在指导治疗方面的价值。
3.4在NDMM中,早期感染是患者死亡的重要原因之一[26]。本研究结果表明,虚弱组早期≥3级感染的发生率显著高于非虚弱组,提示经FIRST简易版虚弱评估量表评分判定为虚弱的患者,临床医师应更关注其感染的发生情况。值得注意的是,本研究NDMM患者早期≥3级感染累积发生率为40.46%,高于其他相关研究的12.00%~20.37%[27-29],这可能与本研究纳入患者年龄偏大、基础健康状况较差、合并症较多等因素有关。
3.5本研究存在一些局限性。首先,本研究样本量有限,且为单中心研究。其次,本研究收集数据周期较长,在评估过程中可能会出现选择偏倚。未来将通过更大规模、多中心的前瞻性研究,以及优化数据收集和分析方法,进一步验证FIRST简易版虚弱评估量表评分在临床中的应用价值。
综上所述,FIRST简易版虚弱评估量表评分在NDMM患者中的应用价值得到验证,虚弱患者早期≥3级感染率较高,生存预后不佳。该评分方法简单、易于操作,对临床实践有较好的指导和应用价值。

