奶渣酪蛋白酸钙的制备及在植脂末中的应用
许涌捷,刘卫震,袁延佩,王冠华,伍昌军,隋文杰*
(1.天津科技大学 食品营养与安全国家重点实验室,食品科学与工程学院,天津 300457;2.天津科技大学 轻工科学与工程学院,天津 300457;3.湖北百特威生物科技有限公司,湖北 仙桃 433099)
奶渣是牦牛乳提取酥油后留下的一种副产物,由提制酥油后的脱脂乳经加热后凝固沉淀、过滤、晒干制得,呈淡黄色块状[1-2]。奶渣作为一种副产品,产量高并且价格低,营养丰富,富含蛋白质、乳糖、矿物质及多种维生素[3-4]。目前,奶渣相关产品的开发有限,奶渣的利用附加值较低。
酪蛋白酸钙是一种较好的补钙物质,其中钙离子与酪蛋白中丝氨酸的磷酸残基稳定结合[5],可以被人体更好地吸收利用,并且含有丰富的赖氨酸[6]。一般纯度较低的酪蛋白酸钙产品主要用于工业制造,如造纸工业、皮革工业、乳胶工业等[7];而纯度较高的酪蛋白酸钙因具有特定的功能性质,如增稠性、乳化性、起泡性等,故可应用于食品加工中[8]。目前,酪蛋白酸钙的制备主要以牛奶酪蛋白为原料,国内外鲜有以奶渣为原料的制备实例,并且缺乏对酪蛋白酸钙的理化性质及其乳化性的研究和相关应用实例的报道。因此,本文以奶渣为原料,探究奶渣酪蛋白酸钙制备的条件、理化性质和以其作为乳化剂制备植脂末产品的稳定性,旨在为食品工业开发成本低、乳化性好的植脂末产品提供依据。
1 材料与方法
1.1 材料与仪器
奶渣:四川甘孜藏族自治州理塘县;酪蛋白酸钙:市售;谷氨酰胺转氨酶(120 U/g):江苏一鸣生物股份有限公司;椰子油:文昌纯椰食品有限公司;葡萄糖浆:亿隆生物科技有限公司;十二烷基硫酸钠(sodium lauryl sulfate,SDS)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、邻苯二甲醛、Tris-甘氨酸:北京索莱宝科技有限公司;Tris-盐酸缓冲溶液:国药集团化学试剂有限公司。以上试剂均为分析纯。
高速离心机(H1850):湖南湘仪有限公司;凯氏定氮仪(Kjeltec):福特(中国)有限公司;高压均质机(AHBASIC):安拓思纳米技术(苏州)有限公司;紫外分光光度计(UV-6100 型):美国尼高利仪器公司;激光粒度分析仪(C 型):美国Sequoia Scientific 公司。
1.2 奶渣酪蛋白酸钙的制备
参考许涌捷等[9]的方法,通过脱脂、碱溶酸沉从奶渣中提取酪蛋白,将奶渣酪蛋白与蒸馏水按照一定比例混合,不断搅拌,水浴加热至43 ℃,缓慢加入浓氨水至奶渣酪蛋白溶解,然后加入Ca(OH)2悬浊液搅拌,2 h后过滤除去不溶解的奶渣酪蛋白,最后经过干燥得到奶渣酪蛋白酸钙。
1.3 单因素试验
以pH 值、料液浓度及Ca(OH)2添加量为因素,以钙含量为指标,分别进行单因素试验。探究溶液pH值(6.0、6.5、7.0、7.5、8.0)、料液浓度(0.50%、0.75%、1.00%、1.50%、2.00%)、Ca(OH)2添加量(1.0%、1.2%、1.6%、2.0%、2.4%)对奶渣酪蛋白酸钙中钙含量的影响。
1.4 奶渣酪蛋白酸钙理化性质的测定
1.4.1 奶渣酪蛋白酸钙基本组分的测定
粗蛋白的测定参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;粗脂肪的测定参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》;乳糖的测定参照GB 5009.8—2016《食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》;水分的测定参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》;灰分的测定参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》;钙含量的测定参照GB 5009.268—2016《食品安全国家标准食品中多元素的测定》。
1.4.2 奶渣酪蛋白酸钙乳化性的测定
参考Nishimura 等[10]的方法并稍作改动,取5 mL花生油与15 mL 待测样品溶液,混合后均质2 min,取均质后的液体100 μL,其余液体静置10 min,在静置前后的液体中加入0.1% SDS 溶液稀释,并在500 nm下测定吸光度。静置前后的液体吸光度分别记为A0和A1,样品乳化活力指数(emulsification activity index,EAI)和乳化液稳定系数(end system identifier,ESI)计算公式如下。
式中:X为乳化活力指数;A为样品在500 nm 下的吸光度;C为样品的浓度,g/mL;L为比色杯直径,1 cm;N为稀释倍数;Φ为油相体积分数;Y为乳化液稳定系数,%;A0为静置前液体吸光度;A1为静置后液体吸光度。
1.4.3 奶渣酪蛋白酸钙交联度的测定
参考闫爽等[11]的方法并稍作修改,称取2 g 谷氨酰胺转氨酶溶于水中,定容至50 mL 容量瓶中,在37 ℃下保温30 min。取20 mL 浓度为5 mg/mL 的样品溶液,添加3 mL 谷氨酰胺转氨酶溶液,在47 ℃的恒温水浴中反应120 min。反应结束后,在85 ℃的水中灭活5 min 后,稀释至0.5 mg/mL。分别取2 mL 交联前后的样品溶液,各加入2 mL 邻苯二甲醛溶液,静置反应2 min 后,在336 nm 下测定吸光度,稀释至0.5 mg/mL。依据公式计算样品中游离氨基的含量和交联度。
式中:V为游离氨基酸含量,μg/mg;Ai为样品的吸光度;C为样品的浓度,mg/mL;N为交联度,%;M1为样品交联前游离氨基含量,μg/mg;M2为样品交联后游离氨基含量,μg/mg。
1.4.4 奶渣酪蛋白酸钙起泡性和泡沫稳定性的测定
参考Wang 等[12]的方法测定起泡性,测定3 种样品的起泡性。取1 g 奶渣酪蛋白酸钙,加入100 mL 蒸馏水,在搅拌机中搅拌1 min,出现大量泡沫,将搅拌后的溶液移入200 mL 量筒中,泡沫体积记为V0,随后放置30 min,再次记录泡沫体积,记为V1。起泡性(W,%)和泡沫稳定性(S,%)的计算公式如下。
式中:V为液体总体积,mL;V0为泡沫所占的体积,mL;V1为泡沫的残留体积,mL。
1.5 植脂末的制备
参考王涛等[13]的方法并稍作修改,分别以市售酪蛋白酸钙、奶渣酪蛋白酸钙、实验室自制奶渣酪蛋白酸钠为原料,加入椰子油、葡萄糖浆和去离子水,搅拌后经过高压均质机均质,最后进行冷冻干燥。奶渣酪蛋白酸钙、市售酪蛋白酸钙和奶渣酪蛋白酸钠制备的植脂末,分别命名为植脂末1、植脂末2 和植脂末3。
1.6 植脂末特性测定
1.6.1 贮藏稳定性测定
参考Zhang 等[14]的方法测定植脂末的粒径和ζ-电位,考察贮藏时间对植脂末稳定性的影响。将制备的植脂末溶于水中,配制植脂末溶液,分别测定样品于4 ℃条件下放置0、6、12、24 h 后的粒径和ζ-电位。
1.6.2 pH 稳定性测定
参考Zhang 等[14]的方法测定植脂末的粒径和ζ-电位,考察pH 值对植脂末稳定性的影响。将制备的植脂末溶于水中,配制植脂末溶液,取等量的植脂末溶液,分别调节pH 值至2、4、9,用激光粒度分析仪分别测定植脂末溶液在不同pH 值下的粒径及ζ-电位。
1.6.3 温度稳定性测定
参考Zhang 等[14]的方法测定植脂末的粒径和ζ-电位,考察温度对植脂末稳定性的影响。将制备的植脂末溶于水中,配制植脂末溶液,分别调整溶液的温度为4、25、45 ℃,采用激光粒度分析仪分别测定植脂末溶液在不同温度下的粒径及ζ-电位。
1.7 数据处理
所有试验均重复3 次,试验数据采用SPSS 22.0 软件的方差分析进行显著性分析,利用Origin Pro 9.0 进行制图。
2 结果与分析
2.1 奶渣酪蛋白酸钙制备单因素试验结果
酪蛋白单体组分含有多个磷酸丝氨酸残基的磷酸基团,可与钙离子结合[5],通过加入氨水使氨根离子与酪蛋白形成水溶性盐,然后再加入碱性较强的氢氧化钙进行反应,形成酪蛋白酸钙,同时保证了钙离子与酪蛋白的充分结合,提高了钙的结合率。
2.1.1 溶液pH 值对奶渣酪蛋白酸钙中钙含量的影响奶渣酪蛋白酸钙制备时,pH 值对奶渣酪蛋白酸钙中钙含量的影响见图1。

图1 溶液pH 值对钙含量的影响Fig.1 Effect of solution pH on calcium content
由图1 可知,当pH 值为7.0 时,奶渣酪蛋白酸钙中的钙含量最高,随着pH 值升高或降低均会造成钙含量的损失,这可能是由于酸性条件下酪蛋白溶解度降低,而在碱性条件下,由于羧酸盐与质子化氨基的静电作用以及酪氨酸的羟基与羧基之间的氢键结合使得蛋白质的三级结构消失,降低了酪蛋白的稳定性[15],从而不利于钙离子与酪蛋白的结合,因此溶液pH 值选择7.0。此结果与葛静微等[7]探究pH 值对酪蛋白酸钙中钙含量影响的研究结果一致。
2.1.2 酪蛋白料液浓度对奶渣酪蛋白酸钙中钙含量的影响
酪蛋白料液浓度对奶渣酪蛋白酸钙中钙含量的影响见图2。

图2 料液浓度对钙含量的影响Fig.2 Effect of feed solution concentration on calcium content
由图2 可知,料液浓度为0.50%~1.00% 时,奶渣酪蛋白酸钙中的钙含量逐渐增加,料液浓度为1.00%时,奶渣酪蛋白酸钙中的钙含量最高,料液浓度大于1.00% 时,钙含量逐渐降低。这可能是由于料液浓度过高时,会使原料的黏稠度过高,不利于其与钙离子结合[7],因此料液浓度选择1.00%。
2.1.3 Ca(OH)2添加量对奶渣酪蛋白酸钙中钙含量的影响
Ca(OH)2添加量对奶渣酪蛋白酸钙中钙含量的影响见图3。

图3 Ca(OH)2 添加量对钙含量的影响Fig.3 Effect of Ca(OH)2 addition on calcium content
由图3 可知,随着Ca(OH)2添加量的增加,酪蛋白酸钙中钙含量呈先升高后降低的趋势。当Ca(OH)2添加到一定量时,钙离子与酪蛋白结合达到饱和状态,当Ca(OH)2添加量为1.6% 时,酪蛋白酸钙中的钙含量最高,达到1.35%,这与葛静微等[7]探究Ca(OH)2对酪蛋白酸钙中钙含量影响的研究结果一致。
2.2 奶渣酪蛋白酸钙理化性质的测定结果
2.2.1 奶渣酪蛋白酸钙基本组分测定结果
奶渣酪蛋白酸钙基本组分测定结果见表1。

表1 奶渣酪蛋白酸钙基本组分Table 1 Basic components of calcium caseinate from milk residues
由表1 可知,奶渣各组分中含量最高的为粗蛋白,为64.09%。由奶渣制备的酪蛋白和酪蛋白酸钙中的粗蛋白含量均较高,分别达到91.41%和93.76%,奶渣酪蛋白酸钙未检出乳糖,奶渣酪蛋白酸钙中的粗脂肪含量低于奶渣酪蛋白,为1.37%,乳糖未检测出,钙含量为1.35%,奶渣酪蛋白酸钙的粗蛋白含量和钙含量均高于市售酪蛋白酸钙,因此由奶渣酪蛋白制备的酪蛋白酸钙粗蛋白含量高、纯度较高。
2.2.2 奶渣酪蛋白酸钙乳化性分析
蛋白质的乳化性质是指能使油和水形成稳定乳化液的性质[16]。由于酪蛋白分子具有亲水基和亲油基,在油水混合液中,酪蛋白的疏水部分偏向脂质,亲水部分朝向水相,使表面张力降低,油水混合液形成稳定的体系[17-18]。奶渣酪蛋白酸钠、奶渣酪蛋白酸钙和市售酪蛋白酸钙的乳化性见图4。
由图4 可知,由奶渣酪蛋白制备的酪蛋白酸钙具有优异的乳化能力,ESI 高于奶渣酪蛋白酸钠和市售酪蛋白酸钙,ESI 达到70% 以上。这可能是由于酪蛋白与钙离子结合,形成更稳定的胶束体系,并且由于奶渣加工过程的影响,奶渣酪蛋白的二级结构稳定性相较市售酪蛋白增强[9],蛋白分子使得油-水界面稳定的时间延长,使得乳液在一定时间内保持其结构和状态的能力提高[19],因此奶渣酪蛋白酸钙可作为性能优异的乳化剂应用于食品领域[20]。同时,奶渣酪蛋白酸钙的乳化活力指数显著低于市售酪蛋白酸钙(P<0.05),这可能是由于奶渣加工过程中温度升高,使得酪蛋白胶束内部的疏水基部分转移到表面,从而蛋白质在油-水界面吸附形成乳状液的能力减弱[21]。
2.2.3 奶渣酪蛋白酸钙交联度分析
交联是常见蛋白改性技术之一,可改善其功能性质,从而发挥更广泛的作用。谷氨酰胺转氨酶可使蛋白质发生交联,引起蛋白质分子聚集,形成更加致密的网状结构,对外界有更强的抵抗能力,能够改善蛋白质的稳定性[22]。两种酪蛋白酸钙和奶渣酪蛋白酸钠的交联度见图5。

图5 奶渣酪蛋白酸钠、奶渣酪蛋白酸钙和市售酪蛋白酸钙的交联度Fig.5 Cross-linking degree of sodium caseinate and calcium caseinate from milk residues as well as commercially available calcium caseinate
由图5 可知,奶渣酪蛋白酸钙的交联度显著低于奶渣酪蛋白酸钠和市售酪蛋白酸钙(P<0.05),可能是由于奶渣加工过程中对酪蛋白结构产生影响,导致蛋白质侧链的赖氨酸及谷氨酰胺残基发生分子内及分子间交联时,产生的游离氨基较少。
2.2.4 奶渣酪蛋白酸钙起泡性分析
起泡性与蛋白质能产生的界面面积的量和稳定性有关[23],在蛋糕、面包和冰淇淋等食品加工中具有重要作用[24]。奶渣酪蛋白酸钠、奶渣酪蛋白酸钙和市售酪蛋白酸钙的起泡性结果见图6。不同大写字母表示泡沫稳定性差异显著(P<0.05);不同小写字母表示起泡能力差异显著(P<0.05)。
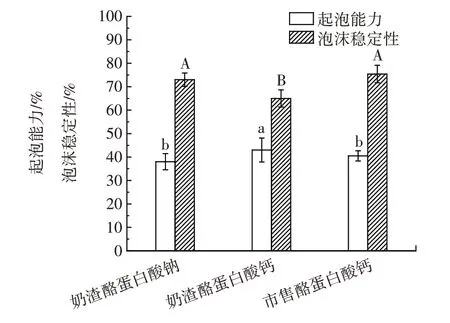
图6 奶渣酪蛋白酸钠、奶渣酪蛋白酸钙和市售酪蛋白酸钙的起泡性Fig.6 Foaming properties of sodium caseinate and calcium caseinate from milk residues as well as commercially available calcium caseinate
由图6 可知,奶渣酪蛋白酸钙的起泡能力显著高于奶渣酪蛋白酸钠和市售酪蛋白酸钙(P<0.05),达到43%,这可能是由于奶渣酪蛋白酸钙中的蛋白质含量最高,蛋白质在经过均质后,会吸附到水-空气界面,蛋白质分子部分展开,使得更多的空气进入,从而在气-液界面形成一层薄膜,并形成气泡[25]。因此,奶渣酪蛋白酸钙可应用于面包、啤酒等食品的加工过程中[24]。而奶渣酪蛋白酸钙的泡沫稳定性显著低于奶渣酪蛋白酸钠与市售酪蛋白酸钙(P<0.05),可能是由于奶渣加工过程中酪蛋白结构发生改变,蛋白质的分子结构会影响气-液薄膜的稳定性,并且钙离子使得游离酪蛋白含量减少,从而减慢在泡沫体系中形成界面膜,泡沫体系的黏度降低[5]。
2.3 植脂末稳定性分析
2.3.1 植脂末贮藏稳定性分析
3 种植脂末粒径随贮藏时间的变化见图7。

图7 3 种植脂末粒径随贮藏时间变化Fig.7 Variation of particle size of the three non-dairy creamers with storage time
由图7 可知,3 种植脂末在放置24 h 后粒径分布发生变化,粒径均变大,奶渣酪蛋白酸钙制备的植脂末1 在放置12 h 和24 h 后粒径变化最小,稳定性最好。
3 种植脂末乳液ζ-电位随储藏时间的变化见图8。

图8 3 种植脂末ζ-电位随储藏时间变化Fig.8 Variation of ζ-potential of the three non-dairy creamers with storage time
由图8 可知,随储藏时间的延长,3 种植脂末的ζ-电位在24 h 时出现小范围下降,由奶渣酪蛋白酸钙制备的植脂末1 乳液电位值变化最小,且ζ-电位最高,粒子间排斥力越大[26]。这是由于奶渣酪蛋白酸钙的ESI高于奶渣酪蛋白酸钠和市售酪蛋白酸钙,当其作为乳化剂制备植脂末时,酪蛋白酸钙分子在油-水界面的吸附性增强,可以更充分地与油相结合,同时由于附近蛋白可以在溶液表面形成薄膜[5],使得界面张力降低,乳浊液更稳定[27]。
2.3.2 植脂末pH 稳定性分析
植脂末1、植脂末2 和植脂末3 在不同pH 值下随时间的延长粒径和ζ-电位变化见图9。

图9 3 种植脂末粒径和ζ-电位值变化Fig.9 Variation of particle size and ζ-potential of the three non-dairy creamers with pH
由图9A~图9C 可知,3 种植脂末在pH2 和pH4时,随着时间的延长,植脂末乳液的粒径变化较大,在pH9 时,植脂末乳液的粒径变化较小,乳液最稳定,这可能是由于酸性条件下会导致蛋白质变性,液滴之间发生聚集,因此粒径变化较大,而在碱性条件下蛋白质溶解度高,乳液较稳定,粒径变化小。由图9D~图9F可知,在放置24 h 后,在pH2 和pH4 时,3 种植脂末的ζ-电位变化较大,在pH9 时,3 种植脂末的ζ-电位变化较小,且电位的绝对值最大,乳液最稳定。因此酸性条件对乳液的稳定性影响较大,这可能是由于乳液中液滴表面的静电荷量增大时,液滴之间的静电斥力增大,从而乳液液滴之间会处于平衡状态[28]。在强酸性条件下蛋白质与液滴之间相互排斥作用小,易发生聚集,使ζ-电位电势下降,进而造成乳液不稳定[29]。
2.3.3 植脂末温度稳定性分析
在不同温度条件下,植脂末乳液的粒径、ζ-电位随时间的变化见图10。

图10 3 种植脂末粒径和ζ-电位随温度的变化Fig.10 Variation of particle size and ζ-potential of the three non-dairy creamers with temperature
由图10 可知,在4 ℃时,由奶渣酪蛋白酸钙制备的植脂末乳液粒径和电位变化较小,在24 h 时没有出现大幅度的波动,且粒径最小,电位的绝对值最大,说明其在低温状态下乳液液滴之间的静电斥力较高[30],因此稳定性最好。在45 ℃条件下,3 种植脂末的粒径和ζ-电位的变化最明显,这是由于热处理使蛋白结构展开,暴露出更多带电基团,液滴之间的斥力势能较小,蛋白聚集程度增加,稳定性变差[31]。
3 结论
本试验通过单因素试验确定了奶渣酪蛋白酸钙制备的最优条件为溶液pH 值为7、料液浓度为1.00%、Ca(OH)2添加量为1.6%时,奶渣酪蛋白酸钙中蛋白质含量为93.76%,钙含量为1.35%。奶渣酪蛋白酸钙具有优异的乳化能力,ESI 高于奶渣酪蛋白酸钠,可达到70%以上,起泡能力也高于奶渣酪蛋白酸钠。由奶渣酪蛋白酸钙为原料制备的植脂末稳定性好,也进一步证明了奶渣酪蛋白酸钙优异的ESI,为奶渣酪蛋白酸钙在植脂末产品的应用上提供了一定的参考。

