右旋糖酐/蚕豆蛋白复合体系的流变及功能特性
陈玉春,汤回花,李欣忆,陈骏飞,刘毕琴,阚欢,史巧*
(1.西南林业大学 生命科学学院,云南 昆明 650224;2.云南省农业科学院农产品加工研究所,云南 昆明 650223)
蛋白质具有良好的增稠、胶凝、乳化、发泡、持水和持油等功能特性,为人类提供多种氨基酸,可以作为营养补充剂和功能性食品的成分[1]。近年来,由于植物基食品的兴起,植物蛋白已成为国内外的研究热点。蚕豆具有蛋白质含量高(29%),营养丰富等特点被视为一种有价值的蛋白质来源,可作为功能性食品配料或营养补充剂[2]。蚕豆蛋白(faba bean protein isolate,FPI)主要由球蛋白组成,其氨基酸均衡,含有生物活性物质[3]。球蛋白含量过高会导致蛋白质的溶解性差[4],而蚕豆蛋白由于球蛋白含量高,溶解性低,导致其功能特性差,因而在食品中的应用受到限制[5]。
多糖可以改善蛋白质的性质,是由于多糖加入蛋白体系中可以增加其黏度,阻止或延迟蛋白质颗粒沉淀[6]。Razi 等[7]研究发现罗勒籽胶能显著改善蛋清蛋白的流变学性质和功能特性。右旋糖酐(dextran,L12),是乳酸菌以蔗糖为底物产生的同型胞外多糖,由主链α-(1→6)、支链α-(1→3)、α-(1→2)或α-(1→4)连接而成,具有良好的生物相容性,作为增稠剂、稳定剂和胶凝剂等广泛应用于医药、食品、化工等领域[8]。据报道,20 g/100 mL 右旋糖酐能改善蚕豆蛋白的流变学性质[9],而较低浓度右旋糖酐对蚕豆蛋白流变学性质及功能特性的影响未见报道。
因此,本研究以右旋糖酐与蚕豆蛋白复合体系为研究对象,探究右旋糖酐浓度(1%、4%)对蚕豆蛋白体系流变学性质(流动曲线、频率扫描、触变性)及功能特性(乳化性能、泡沫性能、胶凝特性)的影响,以期为蚕豆蛋白的性质改善及开发应用提供理论参考。
1 材料与方法
1.1 材料与试剂
蚕豆蛋白:宝鸡森瑞生物化工有限公司;柠檬明串珠菌L12:保藏于云南省农业科学院发酵食品微生物菌种库;磷酸氢二钠、磷酸二氢钠(均为分析纯):天津市风船化学试剂科技有限公司;蔗糖(分析纯):西陇科学股份有限公司;无水乙醇(分析纯):天津市永大化学试剂有限公司;MRS 培养基:青岛高科技工业园海博生物技术有限公司;玉米油:中粮福临门食品营销有限公司;十二烷基硫酸钠(分析纯):北京索莱宝科技有限公司;透析袋(截留分子质量14 kDa):生工生物工程(上海)股份有限公司。
1.2 仪器与设备
YXQ-LS-75SII 高压灭菌锅:上海博迅仪器有限公司;MARS40 哈克流变仪、Multiskan Go 酶标仪:美国Thermo 公司;LGJ-25C 冷冻干燥机:北京四环科学仪器厂有限公司;FJ200-SH 数显高速分散均质机:上海沪析实业有限公司;S210 pH 计:梅特勒托利多科技(中国)有限公司;DAWN HELEOS 8 激光光散射仪:美国Wyatt 公司。
1.3 试验方法
1.3.1 右旋糖酐L12 的提取
参照汤回花等[10]的研究方法并稍作修改,取保藏于-80 ℃的柠檬明串珠菌L12,按1%(体积分数)接种于MRS 液体培养基中,37 ℃培养24 h,活化2 代后作种子液备用。然后取1% 的种子液接种到MRS 液体培养基,培养基中蔗糖含量为10 g/100 mL;培养条件为30 ℃、80 r/min、48 h。将发酵液于8 000 r/min 离心10 min 去除菌体,上清液用80%的三氯乙酸调至终浓度5%,磁力搅拌2 h,8 000 r/min 离心10 min 去除蛋白,所得上清液用3 倍无水乙醇沉淀12 h,8 000 r/min离心10 min 收集沉淀,每12 h 换一次蒸馏水,透析液经冷冻干燥得右旋糖酐(L12)。
1.3.2 L12 的性质测定
参照汤回花等[10]的研究方法,用多角度激光散射仪分析L12 的重均分子量,采用核磁共振氢谱(1H nuclear magnetic resonance,1H-NMR)分析L12 的结构组成,并参照Monteiro 等[11]的研究方法,选择毛细管内径为0.3~0.4 mm 的乌氏黏度计,25 ℃下测定L12 的特性黏度。使用Huggins 公式和Kraemer 公式来计算特性黏度[η]。
式中:K′为Huggins 常数;K″为Kraemer 常数;ηsp为增比黏度,值为ηr-1,dL/g;C为样品质量浓度,mg/mL;ηr为相对黏度,dL/g;特性黏度[η]为在无限稀释时的外推,dL/g。
1.3.3 FPI-L12 复合体系的制备
称取一定量的FPI 及不同质量分数的L12,加入pH7.0、0.1 mol/L 的磷酸盐缓冲溶液,使得FPI 的浓度为15%,L12 浓度为1%、4%,以不添加L12 的为对照,取用前将各体系用磁力搅拌混匀。
1.3.4 FPI-L12 复合体系的流变学性质测定1.3.4.1 流动曲线测定
参照汤回花等[10]的研究方法并稍作修改,采用流变仪平板pp50 系统,板间距1 mm,应变1%,剪切速率的范围为0.01~1 000 s-1,测量温度25 ℃,系统平衡3 min后测定复合体系的表观黏度,通过Carreau 模型拟合复合体系的表观黏度(η)随剪切速率(r)的变化趋势。
式中:η0为零剪切速率表观黏度,mPa·s;η∞为无限剪切时表观黏度,mPa·s;λ为破坏流体结构的时间常数,s;n为流动特性指数。
1.3.4.2 频率扫描
参照汤回花等[10]的研究方法并进行适当修改,采用振荡模式进行参数设定,应变1%(处于线性黏弹区范围),测量温度25 ℃,剪切速率范围为0.1~100 s-1,测定在不同角速度范围内复合体系的弹性模量(G′)与黏性模量(G″)。通过幂律模型拟合G′和G″随剪切频率(f)的变化趋势。
式中:K′、K″为黏度常数;n′、n″为频率模量常数。
1.3.4.3 触变性测定
参照胡方洋等[12]的研究方法并进行适当修改,采用平板pp50 系统,板间距1 mm,测定温度为25 ℃,剪切速率从0.01 s-1增加到100 s-1,随后从100 s-1下降到0.01 s-1,通过RheoWin Date Manager 软件计算滞后面积。
1.3.5 FPI-L12 复合体系的功能特性测定
1.3.5.1 乳化性能测定
乳化性能包括乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI),复合体系的乳化性能参照Baskıncı 等[13]的研究方法并进行适当修改,取8 mL 复合体系与2 mL 玉米油混合,用数显高速分散均质机在20 000 r/min 下均质2 min,立即取50 μL 乳液加入5 mL 0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,涡旋振荡均匀,以0.1% 的SDS 溶液为空白,在波长500 nm 处测定吸光度;静置10 min 后用同样方法测定乳液的吸光度。EAI 和ESI 的计算公式如下。
式中:E为乳化活性,m2/g;N为稀释倍数,100;C为蛋白质量浓度,g/mL;φ为乳液中油相的体积分数;S为乳化稳定性,%;A0和A10分别为乳液静置0、10 min时的吸光度。
1.3.5.2 泡沫性能测定
泡沫性能指标包括起泡性(foamability,FA)和泡沫稳定性(foam stability,FS),复合体系的泡沫性能参照Baskıncı 等[13]的研究方法并进行适当修改,取10 mL复合体系,用数显高速分散均质机在20 000 r/min 下均质2 min 后立刻转移到刻度管中,记录均质后0 min和30 min 的泡沫体积。起泡性和泡沫稳定性的计算公式如下。
式中:A为起泡性,%;F为泡沫稳定性,%;V0为初始体积,mL;V1和V30分别为均质后0 min 和30 min 的泡沫体积,mL。
1.3.5.3 胶凝特性测定
复合体系的胶凝特性参照李倩文等[14]的研究方法并进行适当修改,对不同浓度的FPI-L12 复合体系进行温度和频率扫描。温度扫描测试条件:样板间隙1 mm,上样1 mL,在样品暴露的边缘涂一圈硅油以防止水分蒸发,由20 ℃升温至90 ℃,90 ℃下保温30 min后再由90 ℃降至20 ℃,升降温速率均为5 ℃/min,频率1 Hz,应变1%。温度扫描结束后,立即对样品进行频率扫描,频率扫描的测试条件为样板间隙1 mm、角速度1~100 rad/s、应变1%、测试温度25 ℃。
1.4 数据处理与分析
每个试验做3 次重复,采用SPSS 26.0 和Origin 2021 软件进行统计分析与作图,用单因素方差分析法检验结果统计学意义;所有结果以平均值±标准差表示。
2 结果与分析
2.1 L12 的理化性质分析
L12 理化性质分析见表1。

表1 L12 理化性质分析Table 1 Physicochemical properties of dextran(L12)
由表1 可知,L12 的重均分子量为3.86×106Da,在0.01 s-1下的表观黏度为408.7 mPa·s。经过核磁分析后,L12 由α-(1→6)主链和α-(1→3)支链组成,其占比分别为87.79%和12.21%;此外,特性黏度一般用来衡量溶剂中多糖链所占据的流体体积,主要与多糖的分子结构和溶剂性质相关[15]。L12 在蒸馏水中的特性黏度为6.14 dL/g。在前期研究中,比较右旋糖酐浓度对蚕豆蛋白溶液流变学性质的影响,发现在15%蚕豆蛋白溶液中添加L12 的浓度低于1% 时,FPI-L12-1%复合体系的流变学性质与空白对照组相比无差异,而L12 的浓度为4% 时,接近实际添加浓度。故L12 的浓度选择为1%、4%,研究不同浓度下复合体系的流变学性质及功能特性。
2.2 FPI-L12 复合体系的流变学性质分析
2.2.1 流动曲线分析
L12 浓度对FPI-L12 复合体系表观黏度的影响见图1。

图1 L12 浓度对FPI-L12 复合体系表观黏度的影响Fig.1 Effect of dextran(L12)concentration on apparent viscosity of faba bean protein isolate(FPI)-L12 composite system
由图1 可知,随着剪切速率的增加,表观黏度先迅速下降后趋于平稳,表现出了剪切稀化行为,呈现假塑性特征。复合体系的表观黏度始终高于对照组且随着L12 浓度的增加逐渐升高,这可能是由于L12 具有增稠性,浓度越大使复合体系的黏度越高。吴云辉[16]研究发现酪蛋白-魔芋葡甘聚糖体系的黏度随着魔芋葡甘聚糖浓度的增加逐渐升高。
采用Carreau 模型对复合体系的流动曲线进行拟合,L12 浓度对FPI-L12 复合体系Carreau 拟合模型参数的影响见表2。

表2 L12 浓度对FPI-L12 复合体系Carreau 拟合模型参数的影响Table 2 Effect of dextran(L12)concentration on the Carreau fitting model parameters of faba bean protein isolate(FPI)-L12 composite system
如表2 所示,在0.01~1 000 s-1的剪切速率范围内能较好地拟合流动曲线。随着L12 浓度的增加,η0逐渐增大,说明复合体系在零剪切速率下的表观黏度随着其浓度的增加而逐渐升高。λ值是破坏流体结构的时间常数,λ值越小,表明破坏流体所需的剪切速率就越大[10]。从Carreau 拟合模型可以看出,随着L12 浓度的增加,复合体系的λ值逐渐增大,破坏体系所需的剪切速率逐渐减小。
2.2.2 频率扫描分析
复合体系的黏弹性行为可以通过黏弹性模量变化来表示,L12 浓度对FPI-L12 复合体系黏弹性的变化见图2。

图2 L12 浓度对FPI-L12 复合体系弹性模量(G′)与黏性模量(G")的影响Fig.2 Effect of dextran(L12)concentration on storage modulus(G′)and loss modulus(G")of faba bean protein isolate(FPI)-L12 composite system
由图2 可知,在角速度为0~50 rad/s 时,复合体系的弹性模量(G′)与黏性模量(G″)随角速度的增加而逐渐增大,且G′远大于G″,说明所有的样品都表现出弹性流体特征。加入L12 后,复合体系的G′和G″都高于对照组。白英等[17]研究果胶浓度(1~5 g/L)对乳清蛋白流变学性质的影响,发现随着果胶浓度的增加,果胶-乳清蛋白混合体系的黏弹性模量逐渐增大,推测是由于果胶增加了混合体系的黏度,导致复合体系的G′和G″逐渐增大。
G′和G″随频率的变化趋势用幂律模型拟合,L12浓度对FPI-L12 复合体系幂律模型参数的影响见表3。

表3 L12 浓度对FPI-L12 复合体系幂律模型参数的影响Table 3 Effect of dextran(L12)concentration on the power law model of faba bean protein isolate(FPI)-L12 composite system
K为黏度常数,数值越大,体系的弹性和表观黏度越高[18]。由表3 可知,复合体系的K′和K″高于对照组,随着L12 浓度的增加而逐渐增大,说明L12 能够增加FPI 体系的弹性和表观黏度,且浓度越高增加趋势越明显。频率模量指数n为黏弹性模量与频率的相关程度,数值越大影响越大[19]。复合体系的n′和n″值大于对照组,可能是由于L12 增加了体系的黏弹性模量,使FPI-L12 复合体系具有频率依赖性。
2.2.3 触变性分析
L12 浓度对FPI-L12 复合体系触变性的影响见图3。

图3 L12 浓度对FPI-L12 复合体系触变性的影响Fig.3 Effect of dextran(L12)concentration on thixotropy of faba bean protein isolate(FPI)-L12 composite system
滞后面积由哈克流变仪自带的软件计算得到,FPIL12 复合体系的滞后面积见表4。

表4 FPI-L12 复合体系的滞后面积Table 4 Hysteresis area of faba bean protein isolate(FPI)-dextran(L12)composite system
滞后环法是测定溶液触变性质的重要方法之一,滞后面积的大小与破坏触变结构所需的能量成正比[20]。由图3 和表4 可知,FPI 体系和不同浓度的FPIL12 复合体系都有一定的触变性,相较于对照组,加入L12 后FPI-L12 复合体系的触变性增强,且添加1%L12 复合体系的滞后面积低于添加4% L12 的复合体系,可能是由于多糖添加量增大时,复合体系的黏度增大,从结构改变到恢复至初始状态所需时间较长[21],所以添加4% L12 复合体系的滞后面积更大。FPI 体系的滞后面积为557.5 Pa/s,L12 浓度为4% 时复合体系的滞后面积为20 992.3 Pa/s,这个较高的数值可能与4%L12 与FPI 体系产生的更紧密的结构相对应。
2.3 FPI-L12 复合体系的功能特性分析
2.3.1 乳化性能分析
L12 浓度对FPI-L12 复合体系乳化性能的影响见图4。

图4 L12 浓度对FPI-L12 复合体系乳化性能的影响Fig.4 Effect of dextran(L12)concentration on emulsifying property of faba bean protein isolate(FPI)-dextran(L12)composite system
乳化活性与乳化稳定性可以反映出蛋白质形成及稳定乳化体系的能力,可用于衡量蛋白质的乳化性。由图4 可知,对照组的EAI 较低,为(19.42±1.33)m2/g。加入L12 后,复合体系的EAI 显著提升(P<0.05)。穆婉菊等[22]研究菊粉添加量(2.5%~20%)对小麦面筋蛋白-菊粉复合物乳化特性的影响规律,发现添加菊粉后小麦面筋蛋白的EAI 显著提高,推测是由于菊粉的吸水性强,改变了蛋白质内部水分分布,破坏了蛋白质分子间的静电斥力,促进蛋白质中疏水基团相互作用,从而增加了复合体系的EAI。此外,对照组的ESI为(80.62±1.09)%,随着L12 浓度的增加,ESI 也呈现上升趋势。推测是由于L12 浓度的增加使复合体系的黏度增加,限制油滴的聚集,从而使乳液的稳定性升高[23]。
2.3.2 泡沫性能分析
L12 浓度对FPI-L12 复合体系泡沫性能的影响见图5。
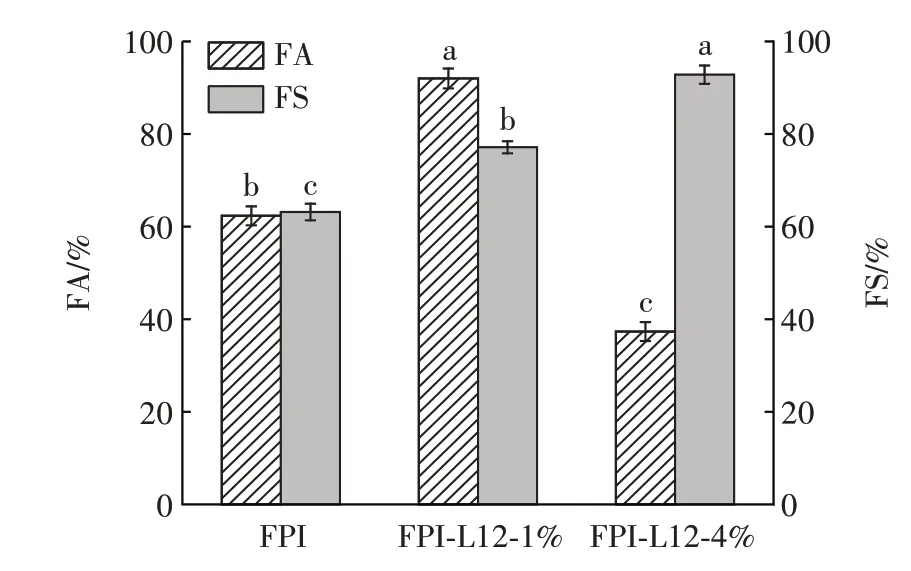
图5 L12 浓度对FPI-L12 复合体系泡沫性能的影响Fig.5 Effect of dextran(L12)concentration on foam property of faba bean protein isolate(FPI)-dextran(L12)composite system
由图5 可知,随着L12 浓度的增加,FPI-L12 复合体系的FA 呈现先增加后减小的趋势。与对照组的FA[(62.33±2.05)%]相比,当L12 浓度为1%时,复合体系的FA 增加至(92.00±2.16)%,说明一定浓度的L12可以增加FPI-L12 复合体系的起泡性。当L12 浓度为4% 时,复合体系的FA 降低至(37.33±2.05)%。结合2.2.1 流动曲线的结果可知,此时复合体系的黏度过高,影响蛋白质的发泡能力,会使起泡性变弱,这也与高黏度时气泡在蛋白质体系中的分散困难有关[24]。此外,FPI-L12 复合体系的FS 显著高于对照组[(63.15±1.78)%](P˂0.05),随着L12 浓度的增加,复合体系的FS 逐渐升高,这可能是由于多糖增加了复合体系的黏弹性和界面膜面积,提升了界面稳定性,降低了界面面积损失和气泡粗化[24]。
2.3.3 胶凝特性分析
L12 浓度对FPI-L12 复合体系胶凝特性的影响见图6。


图6 FPI-L12 复合体系温度扫描及频率扫描图Fig.6 Temperature and frequency scanning diagrams of faba bean protein isolate(FPI)-dextran(L12)composite system
在20~90 ℃对复合体系进行温度扫描以模拟凝胶的形成过程。由图6 可知,同一温度下,FPI-L12 复合体系的G′和G″始终高于对照组,这可能是由于多糖与蛋白质形成了复杂的网络结构[25]。在20~90 ℃升温阶段,对照组与添加1%L12 的复合体系分别在86.43 ℃和56.20 ℃时G′与G″出现交点,表明此温度下该体系由溶胶转变成凝胶。Tseng 等[26]研究菊粉浓度1%~4%对大豆豆浆流变学性质的影响,发现随着菊粉浓度的增加,豆浆形成凝胶的温度逐渐降低,推测是由于菊粉的加入改善了蛋白质之间的相互作用,从而促进蛋白质-胶质分散体在更低温度下形成凝胶。Lopes-Da-Silva 等[27]探究半乳甘露聚糖对大豆蛋白水解物胶凝特性的影响,发现半乳甘露聚糖可以降低复合体系的胶凝温度,推测是由于蛋白质与多糖之间发生相分离,导致局部蛋白质浓度增加,降低复合体系的胶凝温度。而添加4% L12 复合体系的G′始终大于G″,未出现交点,表明一定浓度的右旋糖酐可以促使蚕豆蛋白在室温下形成凝胶。Netsopa 等[28]研究魏斯氏菌生产的右旋糖酐不同浓度(2.5%、5%、10%)的流变学性质,发现右旋糖酐由液体行为转变为固体行为的临界范围浓度是2.5%~5%。在90 ℃恒温阶段,对照组与FPI-L12 复合体系的G′和G″继续增加。李倩文等[14]研究低聚木糖对乳清蛋白凝胶特性的影响,发现在90 ℃恒温阶段,复合体系的G′和G″继续升高,原因是此阶段二硫键的形成促进蛋白分子交联,此趋势与试验结果一致。在90~20 ℃降温阶段,各体系的G′和G″继续升高。Zhao 等[29]研究魔芋胶和结冷胶对硫酸钙诱导的大豆分离蛋白凝胶流变学特性的影响,发现在冷却阶段,所有复合凝胶的G′与G″都增加,推测是由于此阶段凝胶结构中形成了其他非共价键和共价键。
由图6(d)、图6(e)可知,FPI-L12 复合凝胶的G′大于G″,且随着角速度的升高,G′与G″逐渐增大,表明FPI-L12 复合凝胶具有频率依赖性且以弹性特征为主。与对照组相比,当L12 的浓度从1%增加到4%时,复合凝胶的黏弹性模量逐渐增大,Pang 等[30]也发现随着刺槐豆胶浓度增加,豆乳酸凝胶的黏弹性模量逐渐增加,推测刺槐豆胶增加了凝胶网络结构的致密性,这与本研究的结果一致。因此,蛋白质凝胶可能在高浓度的多糖体系下形成复杂的网络结构。
3 结论
本文探究L12 在不同浓度(1%、4%)下对FPI-L12复合体系的流变学性质和功能特性的影响。研究发现,随着L12 浓度的增加,FPI-L12 复合体系的表观黏度、黏弹性模量、触变性、乳化活性、乳化稳定性和泡沫稳定性都逐渐增加,而高浓度多糖由于使复合体系的黏度过高,气泡在蛋白质溶液中分散困难,导致起泡性呈现先升高后降低趋势。此外,添加L12 显著降低了FPI-L12 复合体系的胶凝温度,添加4%L12 的复合体系在常温下就形成了凝胶。总体而言,添加L12 能够改善FPI-L12 复合体系的流变学性质和功能特性。本研究为拓展FPI 的开发应用提供新思路。

