甘蓝型黄籽油菜粒色基因候选区间的QTL-Seq定位及连锁标记开发
王瑞, 郭青青, 徐新福, 卢坤, 李加纳, 曲存民
西南大学 西部(重庆)科学城种质创制大科学中心, 重庆 400715
黄籽油菜与遗传背景一致的黑籽油菜相比, 具有种皮厚度薄、油分含量高和蛋白质含量丰富等多种优点, 因而引起了广大育种家的关注[1], 成为油菜品质育种的目标之一.研究者们通过不断创新黄籽种质资源, 在甘蓝型黄籽油菜的遗传研究、基因定位、分子标记等方面开展了大量的工作.
甘蓝型油菜(AACC, 2n=38)是由芸薹属白菜(AA, 2n=20)和甘蓝(CC, 2n=18)自然杂交后加倍形成的异源四倍体物种[2].目前已有的甘蓝型黄籽油菜均是先通过异源杂交后经人工选育而来, 最早由Olsson[3]于1960年合成黄籽单株, 之后陆续有研究者利用突变、人工强制杂交等多种手段不断拓宽甘蓝型油菜的遗传基础, 创造出了新的更有价值的黄籽种质资源[4].Chen等[5]用芥蓝与黄籽白菜型油菜、Rashid等[6]用芥菜型油菜与埃塞俄比亚芥获得甘蓝型油菜黄籽品系, 而Meng等[7]则是用白菜代替芥菜型油菜提供黄籽基因.这些甘蓝型油菜黄籽基因的来源途径基本源于芸薹属植物内部, 成功转入属外黄籽基因的相关报道仍较为少见[8].
在甘蓝型油菜黄籽基因定位和分子标记方面, Van Deynze[9]用DH群体发现1个粒色连锁RFLP标记位于C连锁群上.刘雪平[10]通过不同年份粒色性状的QTL扫描, 发现在甘蓝型油菜LG18连锁群Me4em5e-BS28-400区间存在1个种皮颜色主效QTL.肖数数[11]通过对黄籽甘蓝型油菜No.2127-17的黄籽基因分析发现, 连锁K-C定位于甘蓝型油菜第9连锁群.Rahman等[12]以5个甘蓝型油菜黑籽品系和3个纯黄品系的F1, F2, F3和回交后代为材料, 利用序列相关扩增多态性(SRAP)技术在F2和回交群体中开发了1个与种皮颜色基因共分离的SRAP标记SA12BG18388, 位于甘蓝型油菜A09连锁群上, 同时利用染色体步移技术在C03连锁群上鉴定出1个SRAP标记SA7BG29245.Zhang等[13]在甘蓝型油菜HZ-1, HZ-2群体中均检测到3个种皮色泽相关QTL, 前者位于N18, N5和N3连锁群, 后者位于N9, N18和N3连锁群.Fu等[14]用2个重组自交系群体在A09染色体上检测出1个稳定主效QTL, 该区间与拟南芥第5号染色体同源性较高, 包含TT10基因, 推测是该QTL的重要候选基因.Liu等[15]利用甘蓝型油菜重组自交系获得了1个位于A09染色体上显著影响籽粒颜色的主效QTL.洪美艳[16]和李霞[17]均利用甘蓝型纯黄油菜No.2127-17和黑籽油菜94570构建近等基因系, 将黄籽基因定位于甘蓝型油菜A09连锁群上.刘福青[18]用SSR标记鉴定来自同一杂交组合自交8代的甘蓝型油菜黄籽、麻黄籽和褐籽, 发现9对引物在100~200 bp时出现3个材料的特征条带, 回收测序特征性差异片段, 结合使用BLASTn同源性分析推测TT7基因可能与黄籽形成有关.Somers等[19]用DH群体获得8个粒色连锁RAPD标记.董艳珍等[20]以甘蓝型油菜黄黑籽近等基因系筛选鉴定到6个特异片段可能是甘蓝型油菜黄籽基因的RAPD标记.刘志文[21]以甘蓝型油菜纯黄品系No.2127-17为材料, 筛选到2个RAPD标记和8个AFLP标记.梅德圣[22]用渝黄1号鉴定到显性黄籽基因连锁AFLP标记E35M52180和SSR标记P039230.曲存民等[23]利用20对SSR标记对20份黄籽甘蓝型油菜核心种质的遗传多样性进行了分析.
尽管通过遗传图谱和关联分析在甘蓝型油菜黄籽性状主效QTL定位和关联标记筛选方面开展了大量的研究工作, 但由于甘蓝型油菜黄籽基因来源不同, 且存在母性效应、多基因遗传、环境条件的影响等, 遗传机理较为复杂, 至今还未见黄籽主效QTL被克隆, 且关联标记也缺乏通用性, 限制了其在育种中的应用.因此, 基于传统的表型选择和遗传图谱构建进行黄籽QTL定位和连锁标记开发难以满足实际育种的需求.近年来, 随着基因组测序技术的发展, 利用二代测序技术进行作物重要农艺性状基因的快速定位及连锁标记开发, 效果显著[24-26].本研究以构建甘蓝型油菜粒色F2群体为材料, 基于BSA方法对基因组高通量测序进行分析, 从基因组水平上对黄籽性状基因进行快速定位并开发紧密连锁分子标记, 研究结果将有助于实现黄籽基因的精细定位, 对甘蓝型油菜黄籽材料的准确鉴定与选育具有重要指导意义.
1 材料与方法
1.1 试验材料
甘蓝型油菜黄籽63-2和甘蓝型油菜黑籽67-1均为小孢子培养加倍获得的DH纯系材料.2018年3月将黄籽亲本和黑籽亲本杂交, 获得F1代种子同时夏繁加代收获F2种子.2019年和2020年将亲本、F1代、F2代种于西南大学重庆市油菜工程技术研究中心歇马油菜基地, 行距、株距均为20 cm.2019年从F2群体中选取极端黄籽和极端黑籽构建黄籽子代池和黑籽子代池, 用于粒色基因候选区间定位.
1.2 田间试验和性状调查
本研究分别于2019年10月和2020年10月播种两个亲本和F2群体, 12月对苗期F2单株插牌编号, 取单株幼嫩叶装于2 mL离心管中, 存于-80 ℃冰箱备用; 2021年1月苗期对F2群体460个单株插牌编号, 6月单株收获记录460个单株的粒色.
1.3 子代池构建
2021年1月苗期, 对亲本及F2群体每个单株插牌编号, 取幼嫩叶0.2 g.然后用OMEGA HP Plant DNA试剂盒提取2个亲本以及F2代的30株极端黄籽和30株极端黑籽单株幼嫩叶DNA.等量混合F2代单株幼嫩叶DNA, 构建黄籽叶片DNA子代池和黑籽叶片DNA子代池.2个叶片DNA子代池和2个亲本叶片DNA建库类型为DNA-350 bp, 以illumina HiSeq PE150方法测序, 测序深度为30×.
1.4 数据处理
启动QTL-seq流程[26], 用fastq_quality_filter软件提取高质量reads; 将过滤后亲本reads与法国甘蓝型油菜参考组Darmor-bzh Brassica_napus.v4.1.fa(http: //www.genoscope.cns.fr/brassicanapus/)比对并替换SNP, 构建亲本参考基因组; 再将亲本reads比对到新构建的亲本参考基因组上, 重排InDel旁错配的reads, 使错配碱基数减少或去除错配数目超过阈值的reads等; 利用coval call软件分析亲本与参考组间的SNP和InDel变异, 计算2个叶片DNA子代池SNP-index及2个子代池SNP-index的差值Δ(SNP-index); 利用R包制作Δ(SNP-index)滑窗分析图, 鉴定粒色基因候选区间.
1.5 引物设计与电泳检测
利用GATK软件获得2个亲本和2个子代池bam文件, samtools截取4个bam文件候选区间, IGV软件查看2个亲本和2个子代池截取文件, 找出粒色基因候选区间的InDel, 锁定起始和终止物理位置, 用Vector和Blast设计InDel引物.利用MISA(http: //pgrc.ipk-gatersleben.de/misa/)进行粒色基因候选区间内的重复序列鉴定并使用Primer3在候选区间进行SSR引物设计, 引物序列由上海生工生物工程技术服务有限公司合成.随机选取F2群体极端黄籽和极端黑籽各11株幼嫩叶的DNA作为模板用于PCR扩增.PCR体系为2.2 μL模板, 0.25 μL dNTP, 前后引物各0.36 μL, 0.31 μL Taq酶(2.5 U/μL), 1.9 μL 10×PCR buffer(含Mg2+).PCR程序为94 ℃ 5 min; 94 ℃ 30 s, 52~60 ℃ 30 s, 72 ℃ 30 s, 共35个循环; 72 ℃ 5 min; 4 ℃保存.8%变性聚丙烯酰胺凝胶电泳分离PCR扩增产物, 最后通过银染法显影记录分析.
2 结果与分析
2.1 DH系黄籽63-2和黑籽67-1杂交后代表型观察和遗传分析
以黄籽63-2和黑籽67-1为亲本配制杂交组合, F1代均表现为黑籽, 与黑籽亲本67-1的籽粒颜色一致, 初步推断黑籽为显性性状(图1).F1自交获得F2群体, 通过考察F2群体的粒色性状进一步确定粒色遗传规律.统计数据并进行卡方拟合优度检验, 两年卡方检验值均小于χ2(0.05, 1)=3.84(表1), 说明黑籽和黄籽符合3∶1的分离比, 推测甘蓝型油菜黄籽性状受1对隐性主效基因控制.

图1 甘蓝型油菜黄籽63-2和黑籽67-1籽粒色泽

表1 黄籽63-2与黑籽67-1杂交F2粒色分离比例
2.2 测序及数据质量分析
将亲本和子代池重测序数据质控过滤后进行碱基平均测序深度及基因组覆盖率分析(图2), 结果显示, 甘蓝型油菜的A01-C09染色体上平均测序深度均达15×以上, 多数接近20×, 说明覆盖度和SNP检出率基本饱和.基于法国甘蓝型油菜Darmor-bzh基因组为参考, 测序数据与其比对结果正常, 可用于变异分析和鉴定目标性状基因候选区间.
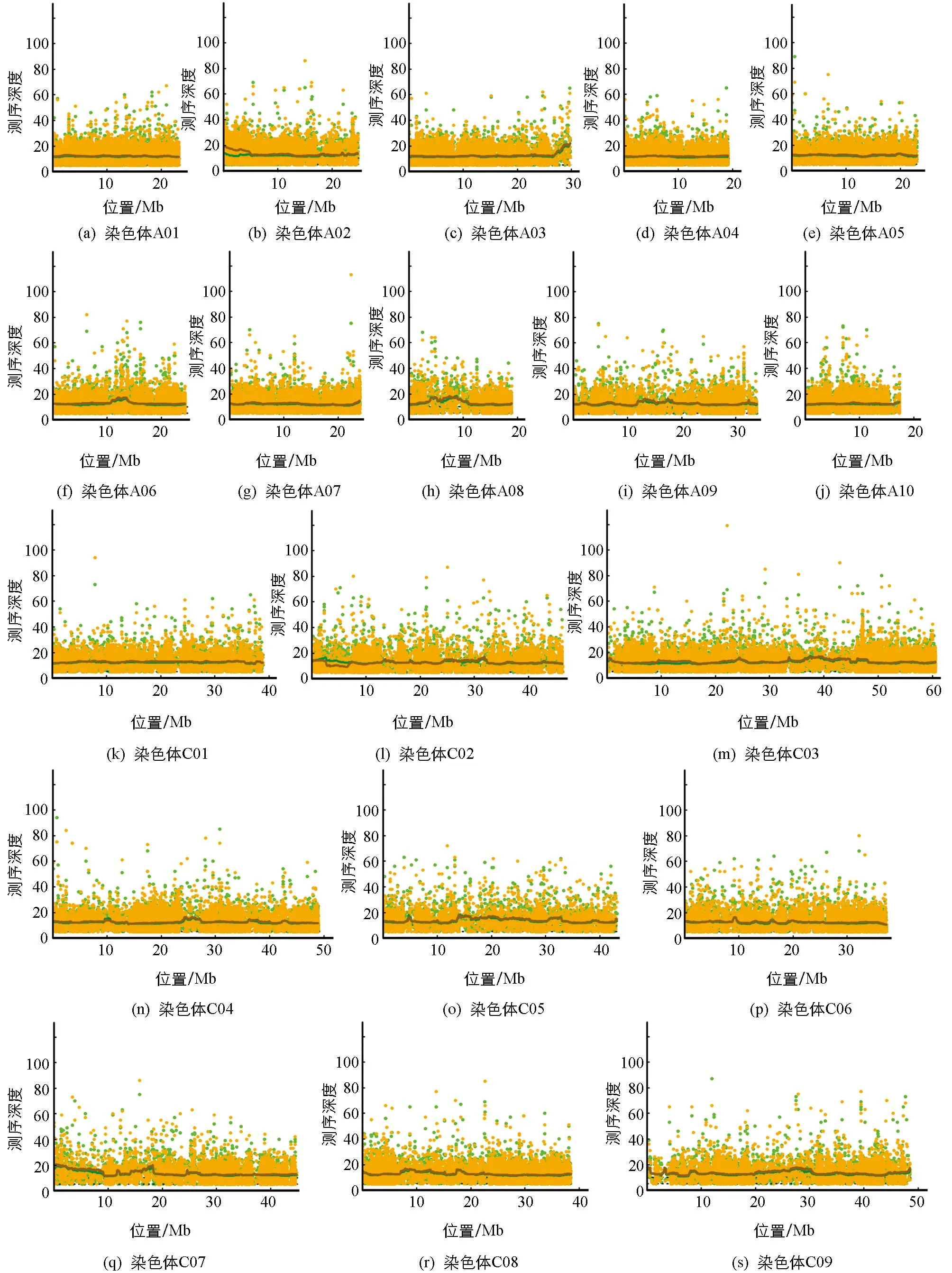
黑线为统计窗口内的平均覆盖深度, 黄点为黄籽混池, 绿点为黑籽混池.
2.3 极端黄黑籽混合池QTL-Seq分析
亲本黑籽67-1测序数据与法国甘蓝型油菜Darmor-bzh比对并替换SNP构建亲本参考基因组, 然后将黄籽和黑籽子代池测序数据再与亲本参考基因组比对计算出每个子代池的SNP-index.以0.3为阈值, 过滤小于0.3的SNP-index位点后, 计算黄黑籽2个子代池之间的Δ(SNP-index).基于滑动窗口法(滑动窗口大小为2 Mb, 步长为50 kb), 利用R-3.2.0软件制作Δ(SNP-index)在19条染色体上的分布图.结果显示Δ(SNP-index)数值沿其他染色体分布趋势在0附近波动, 仅C03染色体在6.1~9.0 Mb区间内Δ(SNP-index) 超过95%截断水平(图3), 但Δ(SNP-index)信号未超过99%截断水平.根据QTL-Seq方法原理, C03染色体6.1~9.0 Mb区间可作为粒色基因候选区间.
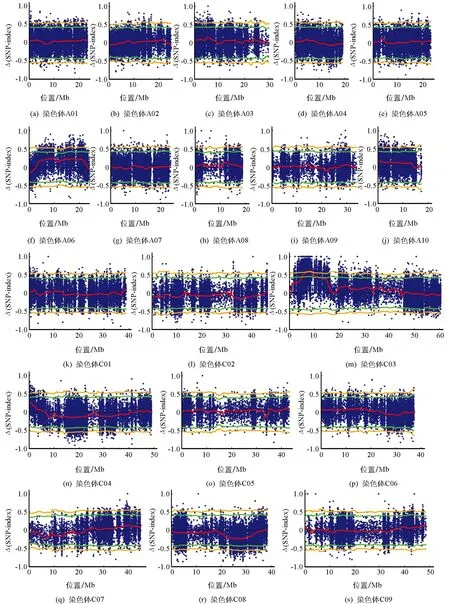
蓝点为Δ(SNP-index)位点, 红线为利用滑动窗口数计算Δ(SNP-index)的变化趋势, 绿线为显著性95%的阈值, 橘线为显著性99%的阈值.
2.4 SSR连锁标记开发
依据法国甘蓝型油菜Darmor-bzh参考序列, 在C03染色体6.1~9.0 Mb区间运用MISA和Primer3, 结合进行SSR引物设计, 先用两个亲本进行SSR引物初步筛选, 再用F2群体中的11株极端黄籽和11株极端黑籽单株完成关联SSR引物验证, 结果共筛选到4个能明显区分亲本和F2群体极端黄籽单株和极端黑籽单株的SSR标记(表2).本研究筛选出的4个标记反复用亲本及F2群体中极端黄籽单株和极端黑籽单株进行测试, 发现电泳带型在黄黑籽中存在一致稳定的差异(图4), 推测粒色性状主效候选基因与这4个SSR标记存在连锁关系.

表2 黄籽基因候选区间的紧密连锁SSR标记
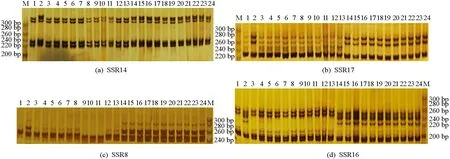
1为黄籽亲本63-2, 2为黑籽亲本67-1, 3~13为F2群体11个黄籽单株, 14~24为F2群体11个黑籽单株, M为DNA分子量标准.
2.5 InDel连锁标记开发
利用samtools软件view参数提取2个亲本和2个子代池BAM文件中C03染色体6.1~9.0 Mb区间序列, 然后将提取的BAM文件排序建立索引导入IGV软件, 可视化分析黑籽亲本67-1(P1)、黄籽亲本63-2(P2)以及黑籽子代池B和黄籽子代池Y中C03染色体6.1~9.0 Mb区间内存在的InDel变异, 结果在该区间内获得5个遗传稳定的InDel标记位点(图5).这些InDel差异在黑籽亲本67-1(P1)和黄籽亲本63-2(P2)之间、黑籽子代池B和黄籽子代池Y中均被稳定检测到, 表明亲本之间的差异DNA小片段遗传到了F2代中, 其中InDel-11和InDel-18缺失序列分别为8 bp和10 bp, 而InDel-16, InDel-17和InDel-20插入序列分别为20 bp, 27 bp和20 bp(图5).
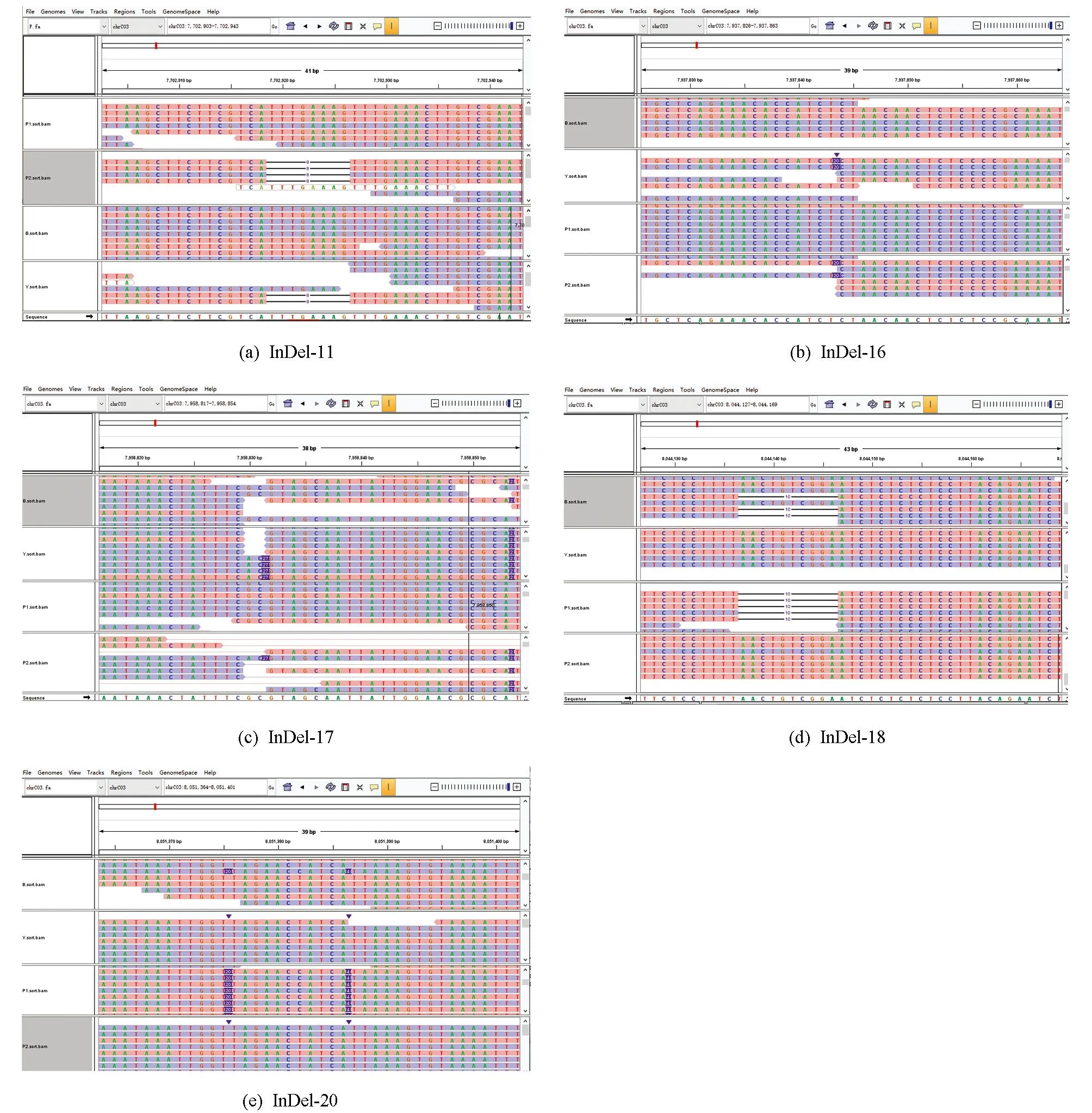
图5 IGV可视化黄籽基因候选区间InDel变异
以法国甘蓝型油菜Darmor-bzh基因组为参考, 利用IGV软件锁定5个InDel的起始和终止物理位置, 用Vector和Blast结合设计InDel引物(表3), 随后利用黑籽亲本67-1(P1)和黄籽亲本63-2(P2)以及F2群体中随机选取的11株极端黑籽和11株极端黄籽单株对其进行验证分析.结果显示, 这5对InDel引物可扩增出1至多条带, 扩增产物长度不等, 扩增带型清晰且重演性好(图6), 说明这些标记位点在不同黄、黑籽株系间多态性稳定.另外, 利用5个InDel标记主带能区分出F2群体中黄、黑籽极端单株, 并且与亲本带型高度一致, 推断黄籽主效基因与这5个InDel标记存在连锁关系.
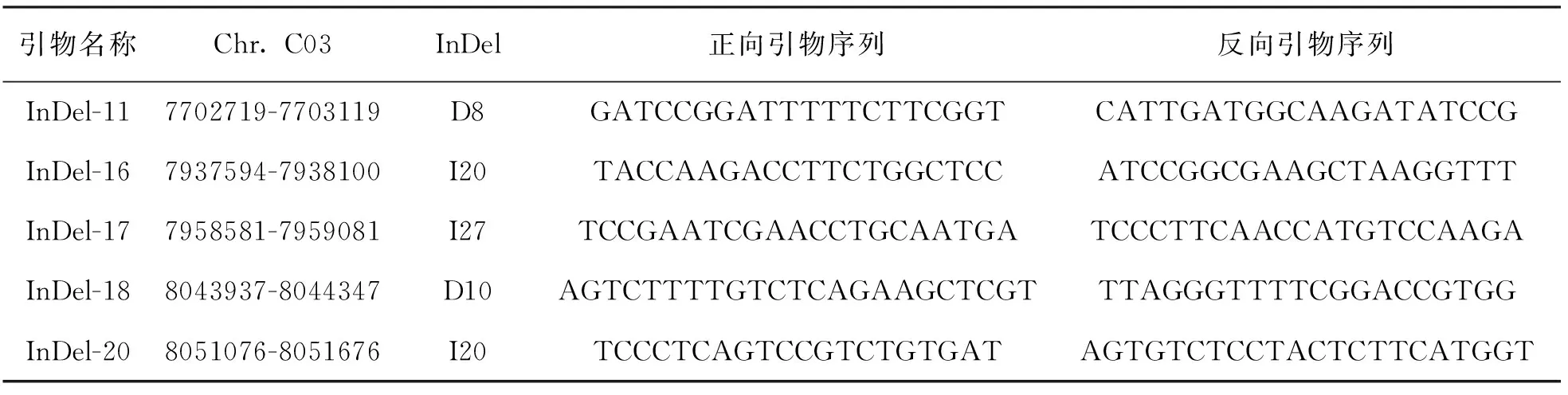
表3 黄籽基因候选区间的InDel引物序列

1为黄籽亲本63-2, 2为黑籽亲本67-1, 3~13为F2群体11个黄籽单株, 14~24为F2群体11个黑籽单株, M为DNA分子量标准.
3 讨论
目前研究表明, 甘蓝型油菜黄籽基因主要来自芸薹属不同种间杂交, 遗传背景有一定差异, 所带的黄籽基因也可能不同.多数学者认为由3对隐性基因控制, 且胚乳或者胚基因型也会对种皮色泽产生一定影响[27], 因此关于黄籽基因的遗传模式较为复杂[28-29].本研究利用甘蓝型油菜黄籽临保系63-2和黑籽67-1配制杂交组合发现, 黄籽由1对隐性主效基因控制.此外, Chen等[5]发现芸薹属的A和C染色体组控制籽粒颜色的机理可能并不相同.目前在A和C染色体组上均定位到了甘蓝型油菜黄籽基因, 其中位于A9连锁群的相关报道较多, 如肖数数[11]将标记K-C定位于第9连锁群; 洪美艳[16]发现种皮颜色基因D位于A9染色体27.65~32.73 Mb中; Rahman等[12]不仅鉴定到1个SRAP标记在甘蓝型油菜A9连锁群, 还利用染色体步移技术鉴定出了位于C3连锁群上的第2个SRAP标记SA7BG29245.本研究将甘蓝型油菜黄籽基因定位在C03染色体上, 区间为6.1~9.0 Mb, 与Rahman等[12]定位结论有一些相似之处, 推测来源于白菜A组染色体上的粒色基因在甘蓝C组染色体上有对应的同源基因, 由于二倍体基本种白菜和甘蓝与异源四倍体甘蓝型油菜间的多态性变异, 种子颜色的着色途径可能存在差异[5].另外, 根据法国甘蓝型油菜Darmor-bzh基因组注释信息, 在该区间内共有430个注释基因, 其中也包含了MYB,WD40和C4H等一些重要的候选基因, 但由于定位的区间比较大, 后续我们将针对该候选区间继续开发标记进行黄籽基因的精细定位.
甘蓝型油菜黄籽表现质量和数量性状特征由少数主效基因控制, 同时受微效基因和环境因素影响[19].借助正向遗传学手段可以有效地将甘蓝型油菜表型与其潜在的基因联系起来, 在二代测序推广以及法国甘蓝型油菜参考基因组公布之前, 利用正向遗传学对甘蓝型油菜重要性状定位主要是基于遗传分离群体构建连锁遗传图谱实施QTL定位, 但该过程步骤较为繁琐、费时费力, 并且在很多情况下得到的定位结果精确度较低、区间范围较大[30], 不利于后续分析.随着二代测序成本的降低, 加上三代测序和Hi-C技术的发展, 使得多种作物参考基因组序列得以破译和释放[31], 为基于NGS测序进行BSA分析提供了极大的便利, 也为高效定位农作物主效基因及快速进行作物育种提供了新的思路.QTL-seq最早应用于水稻数量性状的定位[26], 该方法将两个表型上具有明显差异的品种杂交形成一个定位群体, 在定位群体中构建两个混池进行全基因组重测序, 省去了传统QTL分析中耗时、昂贵的DNA标记开发和基因分型过程, 可以快速识别和分析植物的QTL位点.本研究正是基于BSA原理执行QTL-seq分析流程开展甘蓝型油菜黄籽主效基因定位分析, 具有简便、高效、成本低廉等优点.
甘蓝型油菜黄籽基因来源不同, 也缺乏通用性标记, 因此选择准确有效的分子标记并加以开发利用显得尤为重要.SSR和InDel标记均是基于生物基因组序列的共显性标记, 在选择隐性性状时较有优势[22].甘蓝型油菜基因组序列的公布使得SSR标记的开发变得简单易行.SSR是一种简单串联重复序列, 通常包含2~6个碱基.相较于其他常用的分子标记, SSR标记所受的影响因素相对较少, 多态性和灵敏度高于RFLP, 稳定性和重复性优于RAPD, 技术成本又低于AFLP, 且适合不同研究者合作开发.高通量测序技术的发展极大地促进了InDel标记的开发, InDel标记依据序列差异得以开发, 在基因组中的数目和分布密度远大于SSR, 仅居于SNP之后[32].InDel是一种准确性高、变异稳定、通用性高、带型清晰简单的多态性标记, 能避免分析模糊, 适于全基因组标记开发[33].本研究利用重测序分析定位粒色基因候选区间并获得粒色基因连锁的SSR和InDel标记, 通过随机选用F2粒色分离群体中的极端单株对其进行验证分析, 为甘蓝型油菜黄籽基因的精细定位提供了有效的标记信息, 也为甘蓝型油菜黄籽性状的辅助选择育种提供了有效的分子标记.

